Cell Reports:高脂肪饮食增加患肠道癌症的风险
时间:2021-06-17 11:02:41 热度:37.1℃ 作者:网络

结直肠癌是发病率最高的消化道恶性肿瘤,世界卫生组织(WHO)国际癌症研究署(IARC)发布的2020年全球最新癌症负担数据显示,2020年全球新增结直肠癌患者高达193万例,仅次于乳腺癌和肺癌。而在我国,结直肠癌发病率高居第二,仅次于肺癌。
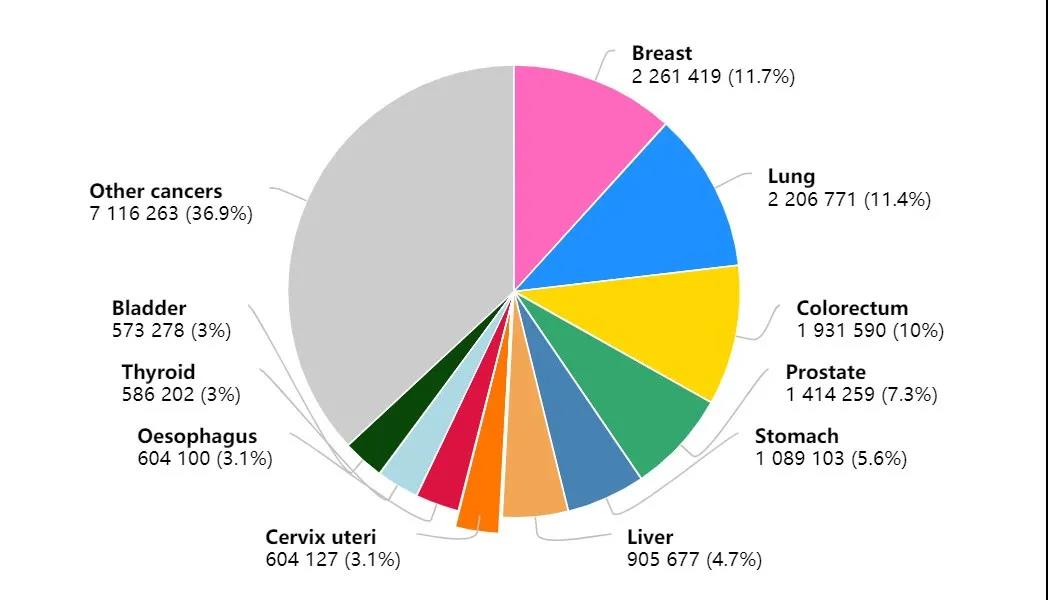
2020年全球发病率前十的癌症
肥胖是包括肠道在内的许多组织中公认的癌症风险因素。在所有结直肠癌风险因素中,饮食可能是最容易控制的环境和生活方式的因素。几十年来,医生和营养学家一直敦促人们限制对高脂肪食物的摄入,旨在减少因过量高脂饮食带来的糖尿病、心脏病和癌症风险。然而高脂饮食与结直肠癌发生之间确切的联系目前尚不完全清楚。阐明该问题将为结肠癌等早期癌症的形成及治疗提供新的重要线索。
2021年6月8日,美国麻省理工学院的研究人员在 Cell 子刊 Cell Reports 在线发表了题为:High-fat diet-activated fatty acid oxidation mediates intestinal stemness and tumorigenicity 的研究论文。
该研究比以往任何时候都更详细地显示了高脂肪饮食如何引发一系列的分子级联事件进而导致肠道癌症的发生,为结直肠癌的发生机制研究及预防和治疗提供了新的思路。
当食物被分解进入肠道时,肠道内表面的肠道干细胞(ISC)与它们相互作用,并通过细胞内的高脂肪传感器分子感知脂肪水平并作出反应。
在这个过程中,过氧化物酶体增殖物激活受体(PPARs)参与诱发细胞程序,增加癌症发生风险,但由于PPARs有PPARα、PPARγ、PPARδ三种亚型且作用复杂,其确切机制尚不清楚。
研究团队团队首先试图探索单个PPARα、PPARδ的作用。他们对小鼠给予长期高脂饮食或正常饮食,同时仔细监测单个PPARα和PPARδ活性,研究团队首先敲除了PPARδ基因,并将其与PPARα基因敲除小鼠对比,发现PPARδ基因敲除并未影响表型的发生(PPARα基因已有研究证实发挥作用),因此,研究团队认为PPARα、PPARδ之间存在补偿效应,均为干细胞内高脂饮食表型所需要。
高脂饮食中含有丰富的长链脂肪酸,Cpt1a是细胞脂肪酸氧化代谢过程中运输长链脂肪酸至线粒体所必需的一种线粒体蛋白。
研究团队进一步构建了Cpt1a敲除小鼠并给予高脂饮食,发现Cpt1a的敲除可以阻止干细胞的扩张和增殖,阻止肠道肿瘤的形成。

此外,这些研究数据可以追踪自饮食过程直至肿瘤形成的整个癌症发展过程。促肥胖的高脂饮食(HFD)中的脂肪被分解为游离脂肪酸,运送至线粒体后产生更多的能量,促进肠道组织中干细胞的繁殖、生长和再生,从而大大增加了基因突变的可能性,诱发了结直肠癌的发生。

更更重要的是,去除脂肪酸氧化过程中重要的线粒体蛋白CPT1a,在保证肠道安全性的同时阻断PPARs的致干和致瘤作用。
总而言之,这项研究为高脂饮食引发结直肠癌提供了可能的分子机制,并为治疗和预防人类结直肠癌等肠道癌症提供了新思路。
原始出处:
Miyeko D. Mana, et al. High-fat diet-activated fatty acid oxidation mediates intestinal stemness and tumorigenicity. Cell Reports, 2021.


