ASCO 2021:转移性乳腺癌专场口头摘要概览
时间:2021-06-06 12:01:46 热度:37.1℃ 作者:网络
6 月 4 日至 8 日,全球癌症研究中最大的活动之一——美国临床肿瘤学会 (ASCO) 年会召开,ASCO 将汇集肿瘤学领域最大、最多样化的受众。 2021 年的 ASCO 年会由于收到新冠疫情的影响,仍以在线形式举行,参会者能够与来自世界各地的科学家、临床医生和患者倡导者一起分享影响患者护理的最新临床癌症研究和试验。梅斯医学将持续关注并报道学术亮点,分享给各位同道。
更多内容关注梅斯医学ASCO专题页:https://meeting.medsci.cn/ASCO2020
2021年6月6日
汇报主席:Adam Brufsky,医学博士,博士,NSABP/NRG 肿瘤学和 UPMC Hillman 癌症中心| Olwen Mary Hahn,医学博士,芝加哥大学医学中心
主题:转移性乳腺癌
摘要介绍1
palbociclib(PAL)+氟维司群(FUL)在激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)晚期乳腺癌(ABC)女性中的总生存期(OS) :更新了 PALOMA-3 的分析
DOI:10.1200/JCO.2021.39.15_suppl.1000
PALOMA-3 是一项随机、双盲、安慰剂对照的 3 期研究,与安慰剂 (PBO) + FUL 相比,PAL+FUL 显着延长了无进展生存期 (PFS)(单侧P <0.0001)。最终方案指定的 OS 分析进行了中位随访 44.8 个月 (mo),显示 PAL+FUL 与 PBO+FUL 的 OS 改善(中位 OS,34.9 对 28.0 个月;风险比,0.814 [95 % CI,0.644–1.029];单侧P = 0.0429)。在这里,我们报告了 OS 分析的结果,中位随访时间较长,为 73.3 个月。
共有 521 名 HR+/HER2– ABC 患者 (pts) 在先前的内分泌治疗中出现进展,他们以 2:1 的比例随机分配至 PAL(口服 125 mg/d,3/1 周计划)+ FUL(500 mg 肌内注射)或PBO+FUL。研究人员评估的 PFS 是主要终点;OS 是一个关键的次要终点。当观察到 393 次事件(占总人口的 75%)时,进行了临时 OS 分析。在同意本研究的患者中进行了循环肿瘤 DNA (ctDNA) 分析。
随着随访时间的延长,继续观察到OS的改善,危险比为0.806(95%CI,0.654-0.994;单边名义P=0.0221)。PAL+FUL的5年OS率为23.3%(95%CI,18.7-28.2),PBO+FUL为16.8%(95%CI,11.2-23.3)。在大多数亚组中都观察到PAL+FUL与PBO+FUL的有利的OS,但对内分泌耐药或以前曾因ABC进行过化疗的患者除外。没有发现新的安全信号。18名患者仍在接受研究治疗,包括15名(4.3%)接受PAL+FUL,3名(1.7%)接受PBO+FUL。研究结束后,PAL+FUL组的20名患者(7.5%)和PBO+FUL组的32名患者(22.2%)接受了细胞周期蛋白依赖性激酶4/6抑制剂。还将介绍治疗结束时肿瘤突变情况(即ESR1、PIK3CA、RB1)的ctDNA分析及其对OS的影响。
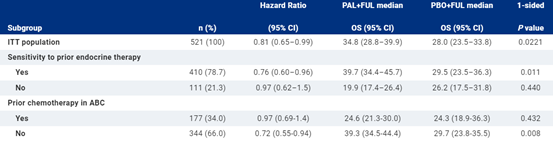 ITT人群和各亚组的最新OS情况
ITT人群和各亚组的最新OS情况
研究显示,在HR+/HER2-ABC患者中,在先前的内分泌治疗中出现进展的情况下,PAL+FUL对OS的临床意义的改善保持了6年以上的随访。
摘要介绍2
患有HR+/HER2-晚期乳腺癌(ABC)的绝经后患者(pts)接受氟维司群(FUL)±瑞博西尼(RIB)治疗的III期MONALEESA-3试验的最新总生存率(OS)结果
DOI:10.1200/JCO.2021.39.15_suppl.1000
III期MONALEESA-3试验(NCT02422615)曾证明,在HR+/HER2-ABC的绝经后患者中,RIB(一种细胞周期蛋白依赖性激酶4/6抑制剂(CDK4/6i))加FUL与安慰剂(PBO)加FUL作为一线(1L)或二线(2L)治疗相比,OS有显著改善(中位数,未达到VS. 40个月;[HR],0.72;95% CI,0.57-0.92,P =0.00455)) 该分析是按照方案进行的最终分析;在研究取消盲法后,允许仍在PBO组接受研究治疗的患者交叉到RIB组。我们报告了额外的中位数16.9个月的随访后的OS的探索性分析,以便进一步确定RIB的长期生存优势的特点。HR+/HER2− ABC 的绝经后患者以 2:1 的比例随机接受 RIB + FUL 或 PBO + FUL 的 1L 和 2L 设置。通过 Cox 比例风险模型评估更新的 OS,并使用 Kaplan-Meier 方法进行总结。还评估和总结了其他进展后终点,例如无进展生存期 2 (PFS2)、化疗时间 (CT) 和无 CT 生存期。
在数据截止时(2020 年10月30日),中位随访时间为56.3个月(分钟,52.7个月),分别有68名(14.0%)和21名(8.7%)患者仍在接受RIB组和PBO组的治疗,通过这种延长的随访,RIB+FUL继续证明OS获益与PBO+FUL相比(中位数,53.7 vs. 41.5个月;HR,0.73;95% CI,0.59-0.90)。RIB+FUL在1L(中位数,未达到 vs 51.8 mo;HR,0.64;95% CI,0.46-0.88)和 2L 亚组(中位数,39.7 vs 33.7 mo;HR,0.78;95)中的 OS 延长% CI,0.59-1.04)。与大多数亚组的意向治疗 (ITT) 人群相比,亚组分析还显示出一致的 OS 获益。ITT人群的 PFS2、CT 时间和无CT生存率有利于RIB + FUL(表)。在停止研究治疗的患者中,81.9%和86.4%接受了下一线的后续抗肿瘤治疗,而14.0%和30.0%接受了CDK4/6i作为RIB和PBO组的后续治疗。没有观察到新的安全事件。

研究显示,在HR+/HER2− ABC的绝经后患者中,经过近5年的随访后,RIB + FUL与PBO + FUL相比,先前证明的稳健且具有临床意义的OS益处得以维持。在1L和2L亚组中观察到RIB的OS益处,这进一步支持在这些人群中使用RIB。结果还表明,RIB与PBO的后续CT使用显着延迟。
摘要介绍3
Dalpiciclib 与安慰剂加氟维司群在先前内分泌治疗复发或进展的 HR+/HER2- 晚期乳腺癌 (DAWNA-1) 中的比较:一项多中心、随机、3 期研究
徐冰河,医学博士,博士
国家肿瘤中心/国家肿瘤临床研究中心/中国医学科学院、北京协和医学院肿瘤内科
DOI:10.1200/JCO.2021.39.15_suppl.1002
Dalpiciclib (SHR6390) 是一种新型CDK4/6抑制剂,作为单一疗法已在预处理的HR+/HER2−晚期乳腺癌 (ABC) 中证明了耐受性和初步抗肿瘤活性。在这里,我们在ABC中用氟维司群评估了dalpiciclib。
在这项随机、双盲、3期试验中,招募了HR+/HER2−局部晚期或转移性乳腺癌患者(pts),这些患者在之前的内分泌治疗中复发或进展。符合条件的患者以2:1 比例随机接受 dalpiciclib(dalp;150 mg po qd,d1-21,q4w)或安慰剂(PBO)和氟维司群(fulv;500 mg im,周期 1 d1,d15,然后 d1 q4w)。主要终点是研究者 (INV) 评估的 PFS。截至2020年11月15日,已发生162起(占总预测数的71.4%)疾病进展或死亡事件,并进行了预先计划的中期分析。
总体而言,361名患者随机接受 dalp-fulv(n = 241)或 PBO-fulv(n = 120)。中位随访10.5个月,与PBO-fulv相比,dalp-fulv 显着改善了INV评估的PFS(中位数,15.7 [95% CI 11.1-NR] vs 7.2 [95% CI 5.6-9.2] mo;HR,0.42 [95% CI 0.31-0.58];P < 0.0001)。每个IRC的PFS与INV评估一致(表)。根据到第一次后续化疗的时间,dalpiciclib的益处超出了初始研究治疗(TFSCT;HR,0.47 [95% CI 0.32-0.69];P < 0.0001)。OS 数据不成熟,总共记录了25例死亡。dalp-fulv组的中位暴露持续时间为9.4 (IQR, 4.3-11.4) mo,dalp-fulv组为9.9 (4.7-11.9) mo,氟维司群为6.1 (3.7-11.0) mo,PBO-fulv 组。dalp-fulv最常见(发生率≥3%)的3或4级 AE 是中性粒细胞减少症(84.2%;vs. PBO-fulv 0%)和白细胞减少症(62.1%;vs. 0%)。据报道,2.5%的dalp-fulv患者因AE中断治疗,而PBO-fulv患者为3.3%。dalp-fulv的SAE发生率为5.8%,而PBO-fulv为6.7%。
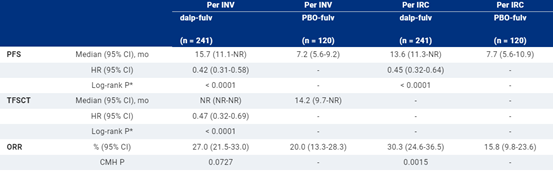
该研究达到了主要终点,表明dalpiciclib加氟维司群与安慰剂加氟维司群相比,能明显改善PFS,且安全性可控。我们的研究结果支持Dalpiciclib加氟维司群作为HR+/HER2-ABC患者的新治疗选择,这些患者在接受内分泌治疗后复发或进展。
摘要介绍4
曲妥珠单抗加内分泌治疗或化疗作为激素受体阳性和 HER2 阳性转移性乳腺癌的一线治疗:sysucc-002 随机临床试验
袁忠宇,教授
中山大学肿瘤中心肿瘤内科
DOI:10.1200/JCO.2021.39.15_suppl.1002
对于激素受体阳性和HER2阳性的转移性乳腺癌,没有证据显示哪种一线治疗方案更可取,是抗HER2治疗加内分泌治疗还是抗HER2治疗加化疗。本研究旨在确定曲妥珠单抗加内分泌治疗的疗效是否与曲妥珠单抗加化疗的疗效一样,并且毒性反应减少。
我们在中国的9家医院进行了一项开放标签、非劣效性、3期、随机对照试验。激素受体阳性和HER2阳性的组织学证实的晚期乳腺癌患者被随机分配(1:1)接受曲妥珠单抗加化疗(CT组)或内分泌治疗(ET组)。主要终点是无进展生存期,危险比(HR)的非劣势上限为1.35。
2013年9月16日至2019年12月28日期间,392名患者入组并随机分配接受曲妥珠单抗加内分泌治疗(n = 196)或曲妥珠单抗加化疗(n = 196)。在意向性治疗人群中,CT组的中位PFS为14.8个月(95%CI为12.8-16.8),ET组为19.2个月(95%CI为16.7-21.7)(HR 0.88,95%CI为0.71-1.09;Pnon-inferiority<0.0001)。与ET组相比,CT组的毒性反应频率明显较高,包括:白细胞减少症(98 [50%] vs 13 [6.6%])、恶心(93 [47%] vs 24 [12%])、疲劳(47 [24%] vs 31 [16%])、呕吐(45 [23%] vs 12 [6%])、头痛(65 [33%] vs 24 [12%] )和脱发(125 [64%] vs 8 [4%] )。没有病人死于与治疗有关的原因。
研究显示,在激素受体阳性和HER2阳性的转移性乳腺癌患者中,曲妥珠单抗加内分泌治疗不逊于曲妥珠单抗加化疗,且毒性降低。曲妥珠单抗加内分泌治疗可以提供更方便的治疗,并允许更好的治疗耐受性。
摘要介绍5
VERONICA 的结果:一项在雌激素受体 (ER) 阳性、HER2 阴性、局部晚期或转移性乳腺癌中进行的二线/三线维奈托克 (VEN) + 氟维司群 (F) 与 F 单独治疗的随机 II 期研究。
DOI:10.1200/JCO.2021.39.15_suppl.1004
对于 ER 阳性、HER2 阴性 MBC 的患者(pts),CDK4/6 抑制剂 + 内分泌治疗(ET)是标准的一线治疗,单药 ET 考虑用于二线。尽管如此,大多数 pts 取得了进展。一个新的治疗靶点是抗凋亡蛋白 BCL2,它在 85% 的原发性 ER 阳性乳腺癌中过度表达。VEN 是一种有效的选择性 BCL2 抑制剂,在先前接受过 ET 的 ER 阳性和 BCL2 阳性 MBC 患者中显示出有希望的临床活性。我们报告了 VERONICA (NCT03584009) 的预先指定的主要和更新的(对于总生存期 [OS])分析,这是一项在 ER 阳性、HER2 阴性 LA/MBC 中 VEN + F 与 F 的 II 期研究。
患者是≥18岁的ER阳性、HER2阴性的LA/MBC女性,之前接受过≤2种ET治疗,之前没有接受过LA/MBC化疗,在CDK4/6抑制剂治疗期间/之后出现疾病复发/进展(之前接受过≥8周)。患者按1:1的比例随机选择VEN(口服;每天800毫克)+F(肌肉注射;500毫克,第一周期的第1天和第15天;随后28天周期的第1天)或F,并接受治疗,直到疾病进展、不可接受的毒性、撤销同意、死亡或预定的研究结束。患者按LA/MBC环境下的先前治疗线(1 vs 2)和BCL2状态(高 vs 低)进行分层。主要终点是临床获益率(CBR;完全反应、部分反应和疾病稳定≥24周)。次要终点包括无进展生存期(PFS)和OS;还进行了安全性和探索性亚组分析。
在主要分析中(截止日期:2020 年 8 月 5 日),103 名患者被随机分组(意向治疗 [ITT] 人群)。VEN + F 组和 F 组的中位年龄分别为 58.0 岁和 59.5 岁。两组之间的 CBR 相似(VEN + F:11.8% [n = 6/51;95% 置信区间 (CI) 4.44–23.87];F:13.7% [7/51;5.70–26.26];风险差异:-1.96 % [95% CI -16.86–12.94])。VEN + F 组的中位 PFS 为 2.69 个月(95% CI 1.94-3.71),而 F 组为 1.94 个月(1.84-3.55)(分层风险比:0.94 [95% CI 0.61-1.45])。CBR 和 PFS 的结果在 BCL2 高和低亚组与 ITT 人群中相似。在 VEN + F 与 F 组中观察到更多的 3-4 级不良事件 (AE)(n = 13/50 [26%] 与 6/51 [11.8%])。使用 VEN + F 观察到的 AE 与其个体安全性特征一致。在更新的分析中(截止日期:2020 年 10 月 22 日),OS 数据不成熟(35.0% 事件/pt 比率);VEN + F 组的中位 OS 为 16.99 个月,而 F 组未达到(分层风险比:2.06 [1.04–4.09])。
从主要分析来看,在内分泌和 CDK4/6 抑制剂难治性 LA/MBC 患者中,VERONICA 与单独使用 F 相比,使用 VEN + F 并没有显示出改善的 CBR 或 PFS。生物标志物分析正在进行中。
摘要介绍6
治疗相关的副作用和关于维持生活质量的剂量评估的看法:倡导者主导的转移性乳腺癌 (MBC) 患者调查的结果
DOI:10.1200/JCO.2021.39.15_suppl.1000
转移性乳腺癌(MBC)通常是不可治愈的,大多数MBC患者将无限期地接受治疗。根据临床试验的结果,患者通常以FDA批准的标签上的推荐起始剂量(RSD)开始每种新的治疗。然而,患者在现实世界中对RSD的耐受能力可能与临床试验环境不同。虽然人们认识到患者报告结果的重要性,但缺乏从患者角度理解耐受性,也没有对患者讨论MBC治疗的个体化剂量的意愿进行评估。
来自“以病人为中心的用药倡议”的病人倡导者通过社交媒体群组、组织通讯和在线支持论坛向 MBC 患者分发了一份保密的在线调查。该调查由患者和医学肿瘤学家开发,旨在确定患者治疗相关副作用的发生率和影响、患者与医生沟通的质量、副作用的管理以及在开始新治疗时对 RSD 替代方法的兴趣或出现不良副作用。
1,221名MBC患者在15天内完成了调查。MBC治疗的中位数为2.5行(范围为1-≥5),46%(n = 564)的患者在接受调查后的两年内得到了MBC的诊断。86%(n = 1,051)的患者报告至少经历过一次与治疗相关的重大副作用,其中20%(n = 213)的患者去了急诊室/医院,43%(n = 454)的患者至少错过了一次治疗。98%(n = 1,026)有副作用的病人与他们的医生讨论了这些副作用,82%(n = 838)的病人得到了医生的帮助。最常见的(非唯一的)缓解策略是减少剂量(66%,n = 556)和处方药(59%,n = 494)。在给予减量的556名患者中,83%(n = 459)报告说感觉更好。值得注意的是,92%(n = 1,127)的病人表示愿意根据他们的个人特点和个人喜好与他们的医生讨论替代剂量的选择。
鉴于86%的MBC患者至少经历过一次与治疗相关的重大副作用,83%的患者在减少剂量后得到改善,因此需要采取与剂量相关的创新策略来维持生活质量。定期评估患者的身体特征和情况的医患讨论可以确定患者在开始治疗时和治疗后的正确剂量,而且绝大多数患者会接受这种讨论。
摘要介绍7
转移性三阴性乳腺癌 (mTNBC) 中的肿瘤微环境 (TME) 和 atezolizumab + nab-紫杉醇 (A+nP) 活性:IMpassion130
DOI:10.1200/JCO.2021.39.15_suppl.1006
IMpassion130是首个显示癌症免疫疗法 (CIT) 对未经治疗的PD-L1+ mTNBC 的临床益处的随机3期研究。在具有更丰富免疫 TME 的患者中观察到A + nP 疗效与安慰剂 (P) + nP 相比增强,但仅限于PD-L1 IC+患者(PD-L1表达免疫细胞在≥1% 的肿瘤区域;Emens JNCI 2021) . 虽然 TNBC 分子亚型和CD8定位在早期 TNBC 中具有预后作用,但尚不清楚这些特征是否与mTNBC中的CIT获益相关。该探索性分析旨在确定与IMpassion130中 A+nP 功效相关的 TME 成分。
IHC用于评估PD-L1状态(VENTANA SP142)和免疫表型(每个CD8基质/肿瘤内定位的炎症/排除/沙漠;Marithasan Nature 2018)。RNA-seq 用于分子亚型分析 (Burstein CCR 2015) 和通路分析 (MSigDB Hallmark)。Cox 回归用于比较A + nP与P + nP之间的PFS/OS,根据先前的紫杉烷类药物、肝脏代谢物进行调整。
样本分类和PD-L1分布见表。在PD-L1 IC+炎症性和排除性肿瘤中,A+nP与P+nP相比,PFS得到改善,但OS的改善仅限于PD-L1 IC+炎症性肿瘤。PD-L1 IC+基底类免疫激活(BLIA)和免疫抑制(BLIS)亚组的PFS获益,但OS获益仅限于PD-L1 IC+BLIA亚组。在PD-L1 IC+患者中,路径分析发现增殖/DNA损伤修复(基底样肿瘤特征)和血管生成/ER反应(在腔内雄激素受体[LAR]/间质[MES]肿瘤中更高)分别与PFS改善和降低有关。

PD-L1 IC+免疫炎症肿瘤和PD-L1 IC+ BLIA肿瘤表现出最高的CIT敏感性,而LAR肿瘤可能对 CIT具有抗性。这些数据值得进一步研究和验证。
摘要介绍8
法米替尼联合卡瑞珠单抗加白蛋白结合型紫杉醇作为免疫调节晚期三阴性乳腺癌 (FUTURE-C-PLUS) 患者的一线治疗:一项前瞻性、单臂、2 期研究
李晨
复旦大学上海肿瘤中心
DOI:10.1200/JCO.2021.39.15_suppl.1007
Camrelizumab(抗 PD-1 抗体)和白蛋白结合型紫杉醇(nab-P)在免疫调节 (IM) 亚型转移性三阴性乳腺癌 (TNBC) 患者中显示出有希望的抗肿瘤活性,在重度患者中观察到 52.6% 的 ORR在我们之前的伞形试验 (FUTURE) 中预处理过的患者。由于已知抗血管生成剂可增强对免疫检查点抑制剂的反应,我们评估了法米替尼(靶向 VEGFR-2、PDGFR 和 c-kit 的酪氨酸激酶抑制剂)、卡瑞珠单抗和白蛋白结合型紫杉醇的新型三联组合在患有以下疾病的患者中的疗效和安全性IM 亚型高级 TNBC。
在这项前瞻性、单臂、2 期研究中,符合条件的患者年龄在18-70岁之间,并且患有初治IM 亚型不可切除的局部晚期或转移性 TNBC。IM亚型被免疫组织化学定义为CD8+。符合条件的患者接受卡瑞珠单抗(200毫克 iv,第1天,第15天,q4w)和 nab-P(100毫克/米2 iv,第1天,第8天,第15天,第4周)和法米替尼(20毫克,每天口服,第1-28天,第 4 周)。治疗一直持续到疾病进展、患者退出或出现不可接受的毒性作用。在没有不能耐受的毒性的情况下,nab-P将至少给药6个周期。主要终点是根据RECIST v1.1的客观反应率。我们使用带有484个基因组的靶向测序探索了预测性生物标志物。
从2019年10月到2020年10月,共招募了48名患者。意向治疗人群中的 48 名患者中有 39 名(81.3%;95% CI 70.2%-92.3%)和46 名患者中的39名(84.8%;95% CI 74.4%-95.2%)实现了确认的客观缓解在符合方案的人群中。中位反应时间为 1.8 个月(95% CI 1.8-2.0 个月)。中位随访时间为 9.0 个月,无进展生存期 (PFS) 和缓解持续时间数据并不成熟。30 名患者 (62.5%) 仍在接受研究治疗。9 个月 PFS 率为 60.2%(95% CI,43.2% 至 77.3%)。3 级或 4 级不良事件为中性粒细胞减少 (33.3%)、贫血 (10.4%)、发热性中性粒细胞减少 (10.4%)、血小板减少 (8.3%)、高血压 (4.2%)、甲状腺功能减退 (4.2%)、蛋白尿 (2.1%)、败血症(2.1%)和免疫相关性心肌炎(2.1%)。6.3% 的患者发生了导致停用任何药物的不良事件。两名患者出现与治疗相关的严重不良事件。没有报告与治疗相关的死亡。生物标志物分析表明,体细胞突变GSK3A可能具有预测免疫治疗反应的潜力。
将法米替尼添加到卡瑞珠单抗和白蛋白结合型紫杉醇作为一线疗法显示出有希望的抗肿瘤活性,并且对 IM 亚型晚期 TNBC 患者具有可控的毒性特征。正在热切期待正在进行的随机对照试验 FUTURE-SUPER (NCT 04395989) 的结果。
摘要介绍9
3 周卡巴他赛与每周紫杉醇化疗在 HER2 阴性转移性乳腺癌 (MBC) 一线治疗中的随机多中心试验
DOI:10.1200/JCO.2021.39.15_suppl.1008
紫杉醇通常用作 HER2 阴性 MBC 的一线化疗药物。然而,由于有 21.5-53.7% 的缓解率和显着的周围神经病变风险,因此需要更有效和耐受性更好的化疗 (CCT)。
这项开放标签随机 (1:1) 2 期试验比较了每 3 周6 个周期的卡巴他赛 (25 mg/m 2 ),18 周内每周一次的紫杉醇 (80mg/m 2 ) 作为一线 CCT。HER2 阴性和体能状态≤1 名患者符合条件。使用卡巴他赛的患者接受 GCSF 预防。主要终点是无进展生存期 (PFS),需要 127 个事件以 85% 的功效检测 0.65 的风险比 (HR)。次要终点包括客观反应率(ORR;RECIST 1.1)、反应时间(TTR)、总生存期(OS)、安全性和耐受性以及生活质量(QoL)。
与每周使用紫杉醇相比,每周 3 次卡巴他赛作为 HER2 阴性 MBC 的一线化疗并未显着改善 PFS,尽管它具有较低的周围神经病变风险,并且患者报告的总体健康结果更好。Cabazitaxel 对 MBC 是安全且耐受性良好的,并且需要更少的医院就诊,这是 COVID 大流行及以后的重要考虑因素。


