Advanced Science:以子之矛、攻子之盾,南大董磊团队利用凋亡小体突破血脑屏障,递送治疗药物
时间:2021-05-12 14:07:45 热度:37.1℃ 作者:网络
血脑屏障(BBB)是限制性最强的屏障,可阻止大多数生物分子和药物进入大脑,为治疗脑血管疾病设置了“屏障”。
血脑屏障(BBB)是指脑毛细血管壁与神经胶质细胞形成的血浆与脑细胞之间的屏障,和由脉络丛形成的血浆和脑脊液之间的屏障,仅允许特定类型的分子从血流进入大脑神经元和其他周围细胞。
血脑屏障的存在,对于阻止有害物质由血液进入大脑具有重要意义,然而,血脑屏障同时也阻止了大多数小分子药物和大分子(例如肽,蛋白质和基于基因的药物)的转移,严重限制了神经中枢系统疾病(例如神经退行性疾病、脑肿瘤,脑部感染和中风等)的治疗。
随着日益严重的人口老龄化问题,阿尔兹海默症等神经退行性疾病正在快速增长,脑部疾病的治疗面临严峻挑战,因此,迫切需要有效突破血脑屏障的药物递送策略。
近日,南京大学生科院董磊教授、张峻峰教授、澳门大学王春明教授作为共同通讯作者,在 Advanced Science 期刊发表了题为:Delivering Antisense Oligonucleotides across the Blood‐Brain Barrier by Tumor Cell‐Derived Small Apoptotic Bodies 的研究论文。
该研究证实,脑转移性癌细胞分泌的纳米级凋亡小体,可作为一种新型的能够突破血脑屏障的药物递送载体,小鼠模型实验证实,携带反义寡核苷酸的凋亡小体,能够有效缓解帕金森氏病症状,并有望彻底改变许多脑部疾病的诊断、预防和治疗
凋亡小体(Apoptosis Body,ABs)是垂死细胞所分泌的一种囊泡结构,早在半个世纪前就已经被发现了,但是它们的作用却被低估了。
由于凋亡小体的大小分布不均匀(直径从数百到数千纳米不等)、组成复杂(包含较大的染色体DNA片段和各种胞质蛋白),因此很少考虑用于药物递送。
但是,对于具有多种天然生物活性脂质和丰富蛋白质的凋亡小体,不应当仅仅是一个体内回收系统,还应当具有更多的功能。
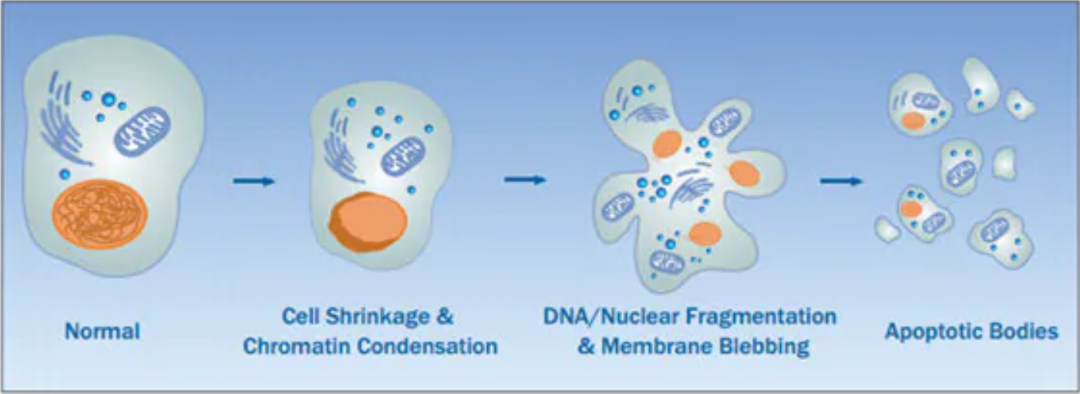
在本文中,研究小组分离了小凋亡小体(small Apoptosis Body,sABs),并揭示了它们作为靶向大脑的递送系统的潜在优势。
首先,与微米级的凋亡小体相比,小凋亡小体(sABs)的大小更均匀,DNA片段少,RNA丰富。
其次,小凋亡小体(sABs)在血清中稳定并且在体内具有长循环时间,不易被吞噬细胞吞噬。
第三,药物在sABs中的装载效率很高,并且该过程高效、可控。
最后,小凋亡小体(sABs)是从细胞膜上脱落的囊泡,因此细胞膜中的分子保留在这些囊泡上,提供了掺入靶向配体的方法。
凭借上述这些优势,小凋亡小体(sABs)可能成为药物递送的新的候选者。
接下来,研究团队发现,抗TNF-α反义寡核苷酸(ASO)与阳离子魔芋葡甘露聚糖(cKGM)结合,可以通过转染/凋亡诱导过程成功地加载到小凋亡小体(sABs)中,并且具有高大脑转移能力的黑色素瘤细胞(B16F10)细胞产生的小凋亡小体(sABs)具有极高的大脑递送效率 。
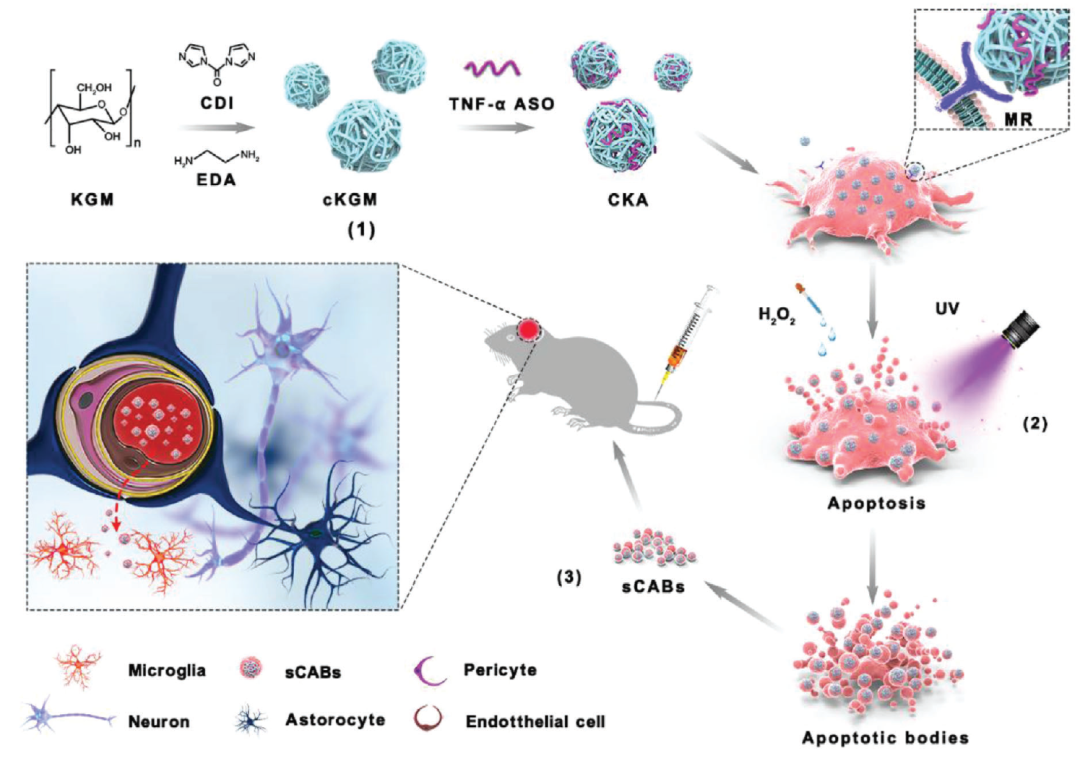
进一步的研究表明,装载ASO的小凋亡小体(sCABs)被脑血管内皮细胞(b.End3)转运,突破了由CD44v6介导的血脑屏障,最终被大脑中的小胶质细胞吸收。
在帕金森氏病(PD)小鼠模型中,装载ASO的小凋亡小体(sCABs)通过ASO的抗炎作用,极大地改善了小鼠帕金森氏病的症状。
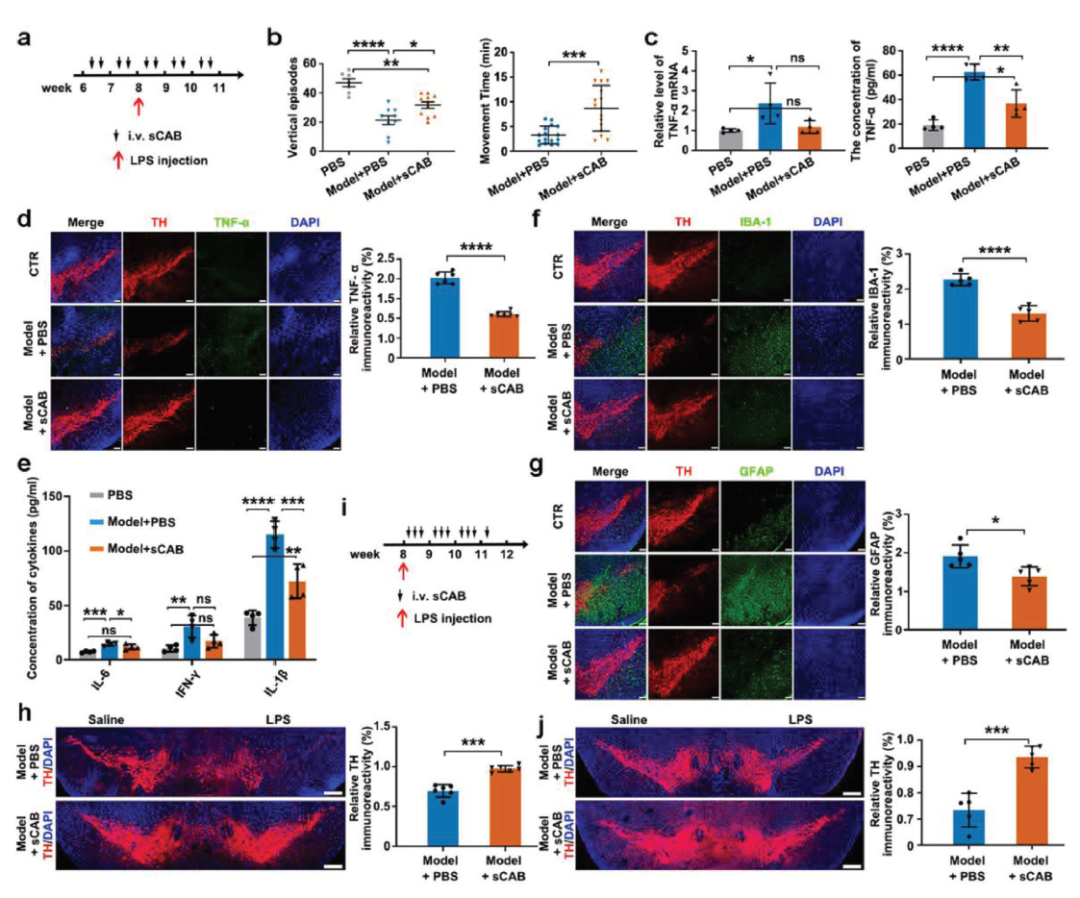
这项研究表明,来自脑转移性癌细胞的小凋亡小体(sCABs)是出色的靶向大脑的递送载体,它们不仅具有出色的递送效率,而且比其他细胞外囊泡具有更高的规模化生产潜力,有望彻底改变许多脑部疾病的诊断、预防和治疗。
该研究的通讯作者董磊教授表示,小凋亡小体(sCABs)将能够克服以外泌体为基础的治疗方法的瓶颈,有望成为一种新型体内药物递送系统。
原始出处:
Yulian Wang Jiayun Pang Qingyun Wang, et al. Delivering Antisense Oligonucleotides across the Blood‐Brain Barrier by Tumor Cell‐Derived Small Apoptotic Bodies. Advanced Science, 2021.


