Nature Medicine:如何消灭或防止SARS-CoV-2“越狱”
时间:2021-05-12 12:04:57 热度:37.1℃ 作者:网络
SARS-CoV-2可以逃避自然免疫应答,但病毒能否逃避单克隆抗体和疫苗介导的免疫应答?
新冠肺炎大流行充满了意外。致病性冠状病毒SARS-CoV-2仅在其RNA基因组发生微小变化的情况下,就轻松地在全球传播了近一年。然而,就在疫苗和疗法进入临床时,病毒变异开始堆积,这提出了一个重要的问题:当免疫系统与这个不断进化的敌人作战时,未来可能会发生什么。现在,在Nature Medicine杂志上,Chen等人、Wibmer等人、Xie等人和Planas等人对此提供了一些相关见解。
与其他快速进化的RNA病毒相比,SARS-CoV-2由于其校对功能,具有较低的基因组可变性。因此,为了控制大流行,研究人员赶忙根据最初在中国武汉发现的病毒序列生产疫苗和单克隆抗体(mAbs)。由于令人难以置信的技术进步、巨大的公共部门投资和全球科学合作,研制出了功效高达95%的疫苗和救命的单克隆抗体,并以前所未有的速度批准紧急使用。
对抗SARS-CoV-2的疫苗和单克隆抗体以刺突蛋白为靶点,刺突蛋白赋予病毒冠状轮廓。在感染开始时,刺突蛋白与人类细胞上的ACE2受体结合。在刺突蛋白上有两个不同的抗原“超级位点”——受体结合域(RBD)和N末端域(NTD)——是大多数中和抗体的靶点。针对RBD的抗体占COVID-19康复患者血清中发现的中和活性的90%,针对RBD的抗体比识别NTD的抗体的效力强10- 100倍。
到2020年12月初,首批批准的疫苗和单克隆抗体已经推出,但由于出现了多份令人担忧的病毒变异报告,这一线希望被蒙上了阴影。其中一些病毒迅速取代了在武汉发现的原病毒。
最受关注的变异是B.1.1.7(在英国分离)、B.1.351(在南非分离)和B.1.1.248(在巴西分离),它们被命名为“受关注变异”(variants of concern,VoC)。根据GISAID数据库收集的96万条完整、高覆盖率的SARS-CoV-2序列,英国、南非和巴西的VoC分别占到37.6% (n = 361273)、0.83% (n = 7969)和0.49% (n = 4750),并且呈持续上升趋势。
B.1.1.7变异的特征是在刺突蛋白编码区域存在8个突变,包括RBD上的一个突变(N501Y)。
这种变异与感染这种血统的人群的死亡率增加有关。B.1.351和B.1.1.248在RBD编码区有三个关键突变,分别是K417N、E484K和N501Y。新的病毒变异现在每天都有来自美国、日本和印度等地的报道,而且变异可能会继续出现在全球各地。目前观察到的病毒突变分析显示,大多数变异在RBD (K417N, E484K和N501Y)编码区域独立获得相同的突变,而NTD的突变似乎不集中于一组特定的突变。
在体外实验中,将病毒或假病毒与COVID-19康复者的中和性单克隆抗体或恢复期血清孵育,还发现许多在感染者中发现的突变是逃逸突变;这表明这些变异能够被观察到,因为它们在自然感染后已经获得了某种免疫力的人群中继续传播。趋同于类似突变可能是为了逃避主要的中和抗体应答,中和抗体应答主要来自免疫球蛋白G重链可变种系区IGHV3-53和IGHV3-669编码的抗体。事实上,恢复期血清处理B.1.351和B.1.1.248变异的能力有局限性。这些血清样本在面对变异时的中和能力比它们在武汉发现的最初SARS-CoV-2病毒的有效性低4至9倍;此外,40-48%的血清样本完全缺乏中和能力。相比之下,B.1.1.7只适度影响恢复期血清的中和能力。
这些变化正在产生显著的社会影响。一个关键的例子是巴西玛瑙斯的情况,那里的变异病毒再次感染了人,并在人群中传播,其中超过76%的人已经是SARS-CoV-2血清阳性。
一些突变对疫苗和单克隆抗体的影响也相当令人不安。已获得美国食品和药物管理局紧急使用授权的四种单克隆抗体中有三种对B.1.351和B.1.1.248变种无效,疫苗对B.1.1.248和B.1.351变种的有效性也低得多。事实上,大多数结合刺突蛋白受体结合基序(与ACE2直接相互作用的RBD区域)的抗体都受到突变E484K和K417N的强烈影响,而结合到与受体结合基序并置的区域的抗体则受到n501y的影响。针对NTD的抗体会受到不同逃逸变异中的替换、缺失和插入的影响。
T细胞似乎较少受到变异的影响。CD4+和CD8+ T细胞靶向的棘突蛋白表位在VoC中表现为高度保守。CD4+ T细胞靶向的保守表位分别占B.1.1.7、B.1.351和B.1.1.248变异体的95.5%、75.3%和89.8%,CD8+ T细胞靶向的保守表位更大,在这三种VoC中平均占96.1%
这些数据证实,RBD和NTD编码区域的突变使病毒能够逃避感染引起的多克隆和单抗反应,并克服一些自然免疫防御。然而,幸运的是,一些针对RBD的抗体仍然能够有效中和大部分VoC,这是第二代治疗配方开发的基础。已观察到对变种B.1.351疫苗效力的显著影响。Novavax疫苗NVX-CoV2373的疗效从96%下降到48%;强生疫苗JNJ-78436735的有效性从85%下降到57%;牛津-阿斯利康疫苗ChAdOx1的效力从62%下降到10%。与这些滴度相匹配的是,疫苗诱导的针对B.1.351变种的中和抗体滴度下降了7- 12倍,而对B.1.1.7变种的中和滴度没有观察到任何影响。此外, Planas等人表明, 15人在第一次注射辉瑞生物科技mRNA疫苗BNT162b2后2-3周内未产生针对B.1.351变体的中和抗体,而在第二次注射后的1周或3周内,分别只有60%或77%的人产生了低滴度的中和抗体。在所有情况下,E484K突变似乎是失去诱发中和抗体效力的主要驱动因素,这表明疫苗接种后会诱发自然感染样抗体反应,因为这一残留对于逃避自然感染和疫苗接种引起的抗体反应很重要。
幸运的是,尽管所分析的所有疫苗都失去了效力,但NVX-CoV2373和JNJ-78436735对由B.1.351变种引起的严重疾病显示出几乎完全的保护作用。临床试验已经开始测试第二代疫苗和单克隆抗体,以遏制VoC的传播。由于当前和未来的变异可能危及医疗干预,监测新变异可能对疫苗和抗体产生的影响将是至关重要的。
令人鼓舞的结果表明,含有B.1.351变种刺突蛋白的疫苗可以诱导广泛的中和抗体,这些抗体应该可以控制VoC的传播。此外,在先前受感染的人群中,单剂量的mRNA疫苗可将抗体反应提高1000倍,并使抗VoC的抗体中和滴度大大高于在未受感染人群中观察到的最高滴度。这表明,第一代疫苗可以提供可抵抗VoC的保护,如果它们增强了已经被感染启动的免疫系统,并且可能也可以保护已经接种了两剂疫苗的未被感染的人。值得注意的是,交叉中和抗体反应几乎完全是由于RBD结合抗体。这可能可以解释为编码RBD的序列有有限的突变选择,因为RBD需要保持与ACE2相互作用的能力,而编码NTD的序列有更多的灵活性来适应突变。
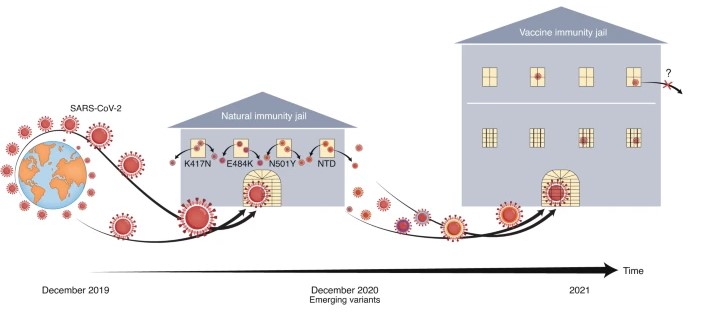
SARS-CoV-2的病毒变异和逃避免疫防御。2019年12月,新型冠状病毒(SARS-CoV-2)在全球自由蔓延。自然免疫帮助锁定病毒。然而,到2020年12月,一种新兴的病毒性VoC出现。这些突变具有编码病毒刺突蛋白RBD的收敛突变(K417N, E484K和N501Y)或刺突蛋白NTD编码区域的大量突变等特征,可以逃避某些自然防御,如某些抗体反应。疫苗和单克隆抗体正在临床开发中,以对抗这些新出现的变异,并有望提供一种更安全的方法来遏制SARS-CoV-2。
大流行的最初阶段可以被看作是动作片的情节,一个角色(病毒)在全球自由奔跑,躲避追捕,直到最后被送进监狱(由自然免疫建立)。然而,如果这个监狱不够安全,病毒可能会在某些变异的帮助下逃跑。通过基于VoC的棘突蛋白抗原实现的疫苗诱导免疫应该有助于确保这些逃跑路线被安全地关闭。但是电影还没有结束。尽管我们有信心第二代疫苗和单克隆抗体能够控制病毒,但病毒是否会继续通过发现新的和意想不到的逃跑路线而令人惊讶,仍然是一个未知数。
原文出处
Andreano, E., Rappuoli, R. SARS-CoV-2 escaped natural immunity, raising questions about vaccines and therapies. Nat Med (2021). https://doi.org/10.1038/s41591-021-01347-0


