WHO公布对我国COVID-19疫苗的评估报告
时间:2021-05-06 15:08:33 热度:37.1℃ 作者:网络
随着我国各地正在积极推进新冠病毒疫苗接种工作,据国家卫健委网站消息,截至2021年5月4日,31个省(自治区、直辖市)和新疆生产建设兵团累计报告接种新冠病毒疫苗28459.5万剂次。上一日接种约469万剂次。

5月3日,世界卫生组织发布了对中国国药集团北京生物疫苗BBIBP-CorV、科兴CoronaVac COVID-19疫苗的评估报告,并很可能进一步通过WHO的COVID-19疫苗全球获取(COVAX)计划为世界其他国家提供疫苗。


WHO
COVAX是一项由包括世卫组织在内的国际伙伴关系和机构领导的倡议,旨在确保COVID-19疫苗的公平分配。
迄今为止,COVAX只运送了其旨在2021年向全球提供的20亿剂疫苗中的约5000万剂。印度本应提供10亿剂量的Covishield疫苗,但由于该国目前的COVID-19危机,出口已经停止。辉瑞公司生产的另一种世卫组织清单上的疫苗向COVAX的交付量有限,而强生公司的疫苗还没有运出。Moderna的疫苗于4月30日被世卫组织列入名单。
在如此形势下,我国两款疫苗有望纳入到WHO紧急使用授权中。
在WHO公布报告中,肯定了国药集团BBIBP-CorV对18至59岁人群具有高保护效力(78.1%),有效力证据为“高度可信”,预防住院效力78.7%,安全性证据为“中度可信”。
但也指出了对60岁以上人群保护效力的证据为“低可信度”,安全性证据为“可信度极低”。
针对合并症人群的保护效力与安全性的证据可信度均为极低。
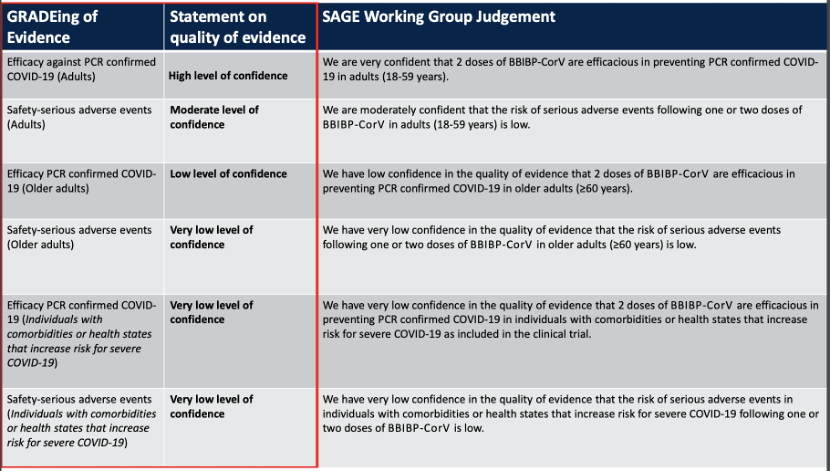
Evidence Assessment: Sinopharm/BBIBP COVID-19 vaccine.WHO
科兴CoronaVac对18-59岁且不合并危险因素的成年人预防有症状COVID-19的保护力为67%,对预防住院的保护力为85%,对预防病死的保护力为80%。有效力证据为“高度可信”,安全性证据为“中度可信”。
对60岁以上人群保护效力的证据为“中度可信”,安全性证据为“低可信度”。
针对合并症人群的保护效力“中度可信“,安全性的证据”低度可信“。
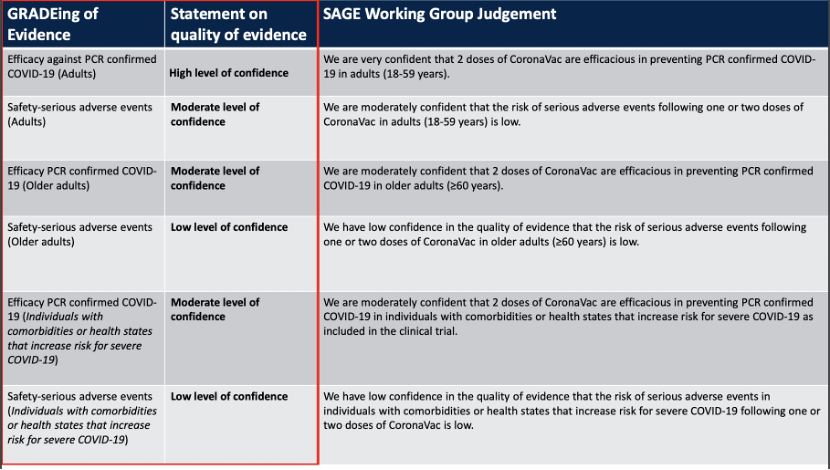
Evidence Assessment: Sinovac/CoronaVac COVID-19 vaccine.WHO
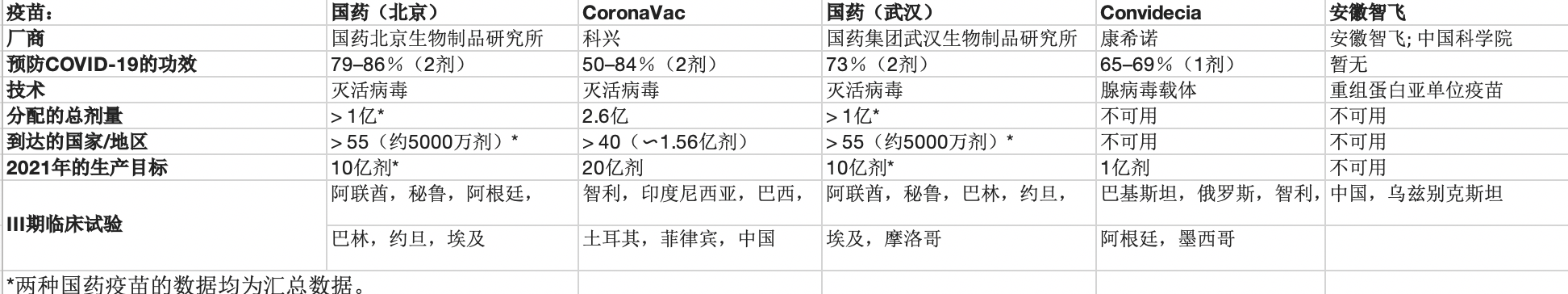
目前在我国大陆境内,共批准了5款疫苗,国药集团北京生物疫苗BBIBP-CorV、国药集团武汉生物疫苗、科兴、康希诺和安徽智飞龙科马疫苗。
BBIBP-CorV是我国最早获准紧急使用、国内供应和接种量最大的疫苗,也是全球范围内获批使用最广泛的中国疫苗。另一只国药疫苗由国药武汉生物制品研究所研发。两款国药疫苗以及科兴疫苗都属于灭活疫苗,灭活疫苗是传统技术,已很成熟。需要接种两剂,常规低温冷藏。
由天津CanSino生物制品公司生产的康希诺疫苗,该疫苗使用一种腺病毒将编码SARS-CoV-2尖峰蛋白的DNA引入人体细胞。
安徽智飞龙科马疫苗,通过将病毒的部分受体结合域蛋白引入人体细胞而发挥作用,目前正在乌兹别克斯坦进行第三期试验。
2020年12月,国药集团发表声明称临床III期中期数据显示BBIBP-CorV疫苗对预防新冠症状有效率为79%。
来自巴西、土耳其和印尼的试验结果显示其免疫效力在50.7%至83.5%之间不等。
批准使用国药疫苗的大约有30个国家,包括阿联酋、巴林、圭亚那、匈牙利、塞尔维亚等。
匈牙利是第一个批准国药疫苗BBIBP-CorV的欧洲国家。阿联酋正在首都阿布扎比与国药合资新建疫苗生产基地。
阿联酋接种的大部分是国药疫苗,塞尔维亚、柬埔寨和埃及的国药疫苗BBIBP-CorV订单也都较大。
现阶段WHO已经通过紧急使用授权先后批准了英国阿斯利康的腺病毒载体疫苗、美国辉瑞/德国BioNTech的mRNA疫苗,美国强生的腺病毒载体疫苗和美国Moderna公司的mRNA疫苗等四个疫苗。
如果国药疫苗BBIBP-CorV和科兴疫苗被WHO批准,则将成为第五个获得批准的疫苗,也将是第一个灭活病毒疫苗。
就在WHO发布评估报告后,紧接着Nature发表了有关我国批准的5个(3类)疫苗进行的概述。

China’s COVID vaccines are going global — but questions remain.doi: https://doi.org/10.1038/d41586-021-01146-0
概述坦言,疫苗得到世卫组织的支持非常重要。对疫苗开发商和需要获得这些疫苗的国家来说是非常好的消息。
世卫组织的批准程序评估了安全性、有效性和制造质量。如果获得批准,那么联合国机构可以购买该两款疫苗。如果不能获批,那么只能由各个国家单独来采购疫苗,而大多数国家将无法做到这一点。
概述指出,中国研究人员是首批在2020年初开始开发针对COVID-19的疫苗的国家之一,但尚未公布完整的试验结果。这令一些国家研究人员担心,缺乏透明度可能会助长疫苗的犹豫不决。
但事实上,由于中国本身没有足够的传播手段来进行试验,中国的疫苗不得不在其他地方进行试验,这也就造成了整理数据需要更多的时间和资源。
概述中,对于国药集团BBIBP-CorV重点事件线进行了整理。12月初,阿拉伯联合酋长国(UAE)和巴林都批准了该疫苗--使其成为首批在除中国外获得完全许可的COVID-19疫苗。批准是基于后期试验数据,包括一项涉及31,000名参与者的阿联酋研究。这些数据显示,该疫苗在注射2次后对预防COVID-19有86%的效果,免疫者中没有死亡。4月29日会议后发表的文件表明,几个国家的综合试验效果为78%。
关于CoronaVac的临床试验和国家疫苗接种活动的数据也已经出现,结果不一。巴西和土耳其的试验显示,疗效数字分别为50.7%和83.5%。较低的数字可能是因为巴西将COVID-19的轻度病例包括在其计数中,并且因为有P.1变体的流通,这种变体的传播性更强,可能更善于逃避免疫。智利大规模接种疫苗后的分析结果介于这些数字之间,为67%。
概述的最后也列出中国疫苗汇总数据。
现如今针对大流行阶段,疫苗俨然成为抵抗疫情的重要手段之一。疫苗试验是有科学根据的,在严格控制的条件下,通过成千上万人参与进行的,这是确定疫苗安全有效能大规模接种的唯一办法。
而如今,3期临床试验完成,数据的公开是疫苗批准的基本要求。


