Trends in Endocrinology& Metabolism:“饿死”癌细胞,氨基酸消耗疗法的途径与挑战
时间:2021-04-09 22:01:47 热度:37.1℃ 作者:网络
在过去数十年间,化学疗法的进步以及免疫疗法、靶向疗法的问世显着提高了癌症患者的存活率,然而对于部分癌症患者而言,随之而来的“后遗症”严重影响着生活质量。因此,如何降低癌症疗法的副作用、改善患者生活质量成为科学家们长期关注的焦点。
与正常细胞不同,癌细胞能够无限增殖并破坏正常的细胞组织。为了满足增殖的需求,癌细胞会提高代谢效率,汲取更多养分,而作为重要能量来源的氨基酸无疑是癌细胞发展的一大核心支撑,这也为人们阻止癌症进展提供了切入口。上世纪50年代,氨基酸不平衡(amino acid imbalance,AAI)概念的提出拉开了人们探索改变氨基酸摄入以影响癌症进展的序幕。
近日,荷兰玛西玛公主小儿肿瘤中心的研究人员在《Cell》子刊《Trends in Endocrinology& Metabolism》(IF:11.641)发表了一篇题为Amino Acid Depletion Therapies: Starving Cancer Cells to Death的综述性文章,阐述了当前肿瘤特异性氨基酸依赖背后的生物学原理,以及利用癌细胞的这一“软肋”改善现有的癌症疗法的思路。
氨基酸消耗疗法的靶标
肿瘤细胞氨基酸代谢途径的改变往往由多种信号通路和转录因子共同驱动。目前,靶向氨基酸代谢的方法可从抑制氨基酸转运体、氨基酸生物合成以及氨基酸消耗等方面展开。这篇综述文章主要探讨了氨基酸消耗疗法的不同靶标及临床应用挑战。
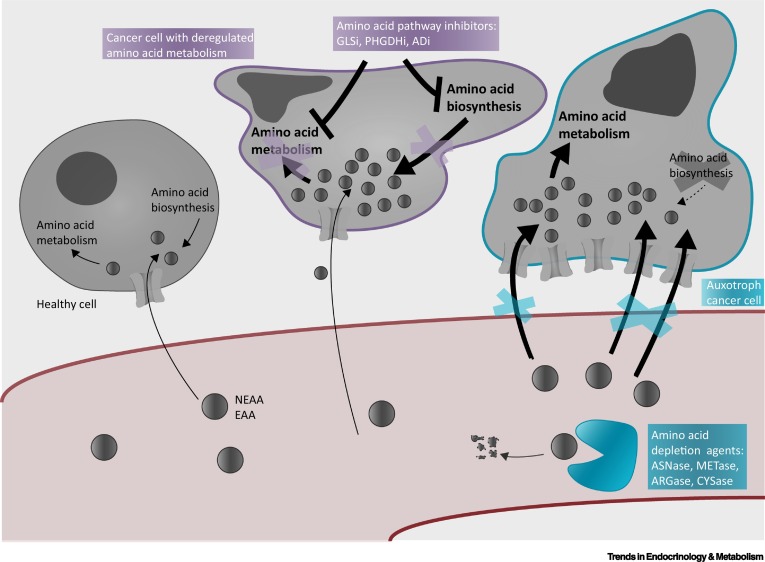
靶向氨基酸代谢不同策略的示意图
天冬酰胺
迄今为止,天冬酰胺(Asn)是氨基酸消耗疗法中最成功和考证最多的靶标,尤其是在小儿急性淋巴细胞白血病,天冬酰胺酶(ASNase)的引入大大提高了治愈率。不仅如此,2018年,发表在《Nature》和《Cell metabolism》的两项研究表明,Asn能够刺激谷氨酰胺的生物合成,高水平的Asn甚至能促进上皮-间充质转化,后者是驱动癌症转移的关键因素。
谷氨酰胺
谷氨酰胺(Gln)是机体内含量最多的游离氨基酸,可经谷氨酰胺酶(GLS)催化转化为谷氨酸,为肿瘤细胞能量代谢提供关键能源。研究表明,由c-Myc或KRAS驱动的肿瘤十分依赖于外源性Gln,GLS的药理抑制在三阴性乳腺癌(TNBC)、急性髓系白血病(AML)以及非小细胞肺癌中均展现了出色的成效。目前,已经有一款GLS抑制剂进入了针对血液瘤和实体瘤的2期临床阶段。
精氨酸
精氨酸(Arg)是氨基酸类化合物,可由谷氨酰胺(Gln)和脯氨酸(Pro)合成。在营养缺陷型肿瘤中,精氨酸的缺失诱导了肿瘤细胞的自噬和凋亡,而正常细胞却能够在这种状态下存活。通过施用人精氨酸酶(ARGase)或细菌精氨酸脱亚胺酶来促进Arg消耗,正在复发/难治性癌症的未成年患者带来抗癌曙光。
蛋氨酸
蛋氨酸(Met)是构成人体的必需氨基酸之一,也是人体内最重要的甲基供体,影响着生物合成与代谢。正因如此,这类物质是氨基酸消耗疗法的主要候选靶标,尤其是在表观遗传修饰突变驱动的肿瘤中。小鼠实验显示,限制Met摄入能够阻止三阴性乳腺癌、结直肠癌、肉瘤、神经胶质瘤等肿瘤的生长,并抑制癌细胞的转移,2002年《Nutrition and Cancer》发布的一项初步临床研究进一步证明了该方法的临床安全性。
丝氨酸
丝氨酸是一种依赖于食物摄入的非必需氨基酸,在脂肪和脂肪酸的新陈代谢及肌肉的生长中发挥着作用。肿瘤能够利用丝氨酸生物合成途径,通过控制相关酶的表达来减少对外源供应的依赖。临床前研究表明,限制丝氨酸和甘氨酸摄入能够显着抑制肠道癌和淋巴瘤小鼠中肿瘤细胞的增殖。
半胱氨酸
半胱氨酸是为数不多的含硫氨基酸之一,对氧化还原稳态至关重要。小鼠实验证明,Cys的耗竭能够减少前列腺癌、慢性淋巴细胞性白血病的癌细胞增殖,提高小鼠存活率。
影响氨基酸干预效果的因素
不同的干预策略
尽管消耗氨基酸是一种潜在的抗肿瘤策略,但是在某些情况下,增加特定氨基酸的丰度可能具有抗肿瘤作用。2020年《Nature Communications》的一篇文章指出,补充谷氨酰胺能够通过影响表观遗传重编程来阻断黑色素瘤的生长,2018年《Nature》的一篇文章则指出补充组氨酸提高了白血病异种移植模型对甲氨蝶呤的敏感性。
肿瘤的位置
氨基酸干预对肿瘤发展的影响,不仅与肿瘤的类型有关,还取决于包括肿瘤位置在内的外部因素。在原发或转移部位,肿瘤细胞的代谢和营养需求存在差异,例如当乳腺癌细胞转移到肺部时,会上调丝氨酸生物合成,以支持雷帕霉素复合物1(mTORC1)生长信号。

氨基酸干预的效果高度依赖于多种因素
免疫监视
T淋巴细胞是人体对抗癌细胞的“主力军”,然而不幸的是,癌细胞在“抢夺”氨基酸方面比T细胞更胜一筹,从而影响人体免疫监测效果。从这个角度而言,氨基酸消耗疗法会削弱免疫细胞的功能。不过,一些研究已经证实,某些氨基酸的消耗具有免疫刺激作用,能够进一步提高免疫细胞对肿瘤细胞的杀伤作用。
氨基酸消耗疗法的前景及挑战
在与不同的癌症疗法协同使用时,氨基酸消耗的策略能够进一步提高“搭档”的“威力”。当与化学疗法联用时,消耗氨基酸可诱导正常细胞进入细胞周期停滞阶段,使其免受化疗的伤害并加大对癌细胞的打击力度。另外,氨基酸消耗疗法或许有助于抵消药物耐药性的细胞内在机制,降低患者对化疗药物的依赖性。
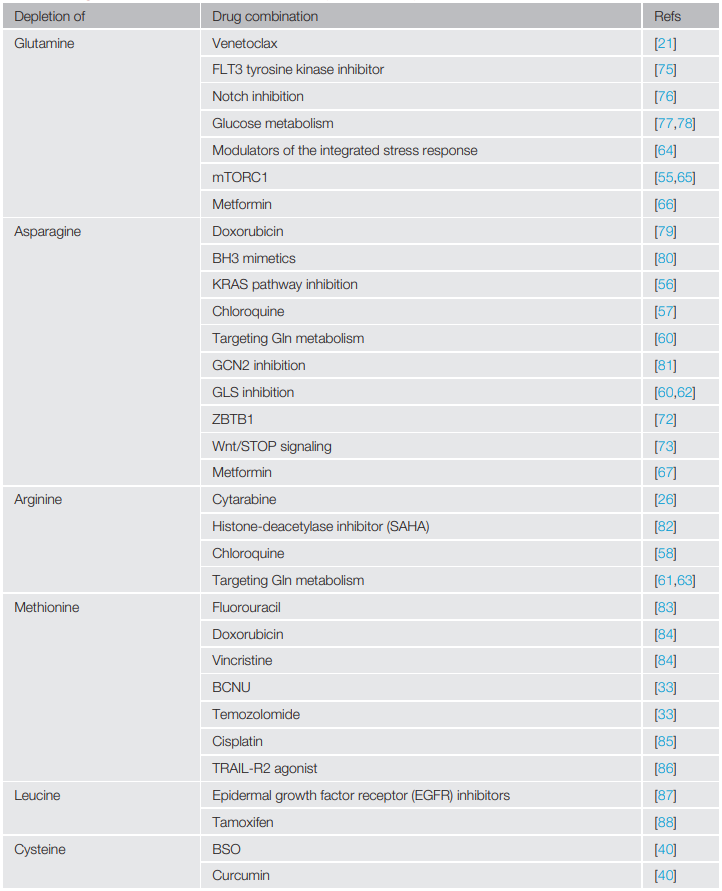
现有文献中关于氨基酸消耗疗法与化学疗法的药物组合
当然,氨基酸消耗的方法同样面临耐药性的问题。不够有效的氨基酸耗竭可能仅仅将肿瘤细胞维持在细胞静止状态,一旦终止治疗,肿瘤细胞可会卷土重来。另外,肿瘤微环境中的细胞也可能影响氨基酸的利用率。
相较于其他疗法,氨基酸消耗疗法更加安全,对正常细胞的伤害更小。在这一疗法广泛应用于临床之前,仍需探索不同癌细胞对氨基酸的代谢敏感性。同时,由于单一疗法带来的抗药性,未来氨基酸消耗疗法与靶向药物联用可能是一种潜在的抗癌策略。
原始出处:
Miriam Butler, et al. Amino Acid Depletion Therapies: Starving Cancer Cells to Death. Trends in Endocrinology& Metabolism, 2021.


