专家论坛|高志良:慢性乙型肝炎功能性治愈离完全治愈还有多远?
时间:2025-02-16 12:09:05 热度:37.1℃ 作者:网络
全球超过2.9亿人患有慢性乙型肝炎(CHB),每年有超过80万患者死于CHB相关并发症,世界卫生组织(WHO)提出“2030年全面消灭病毒性肝炎”的目标。血清HBsAg清除是目前临床普遍接受的抗病毒治疗终点,其中长期核苷(酸)类似物[NAs]治疗的累积HBsAg清除率仅为0~5%;有限疗程下的聚乙二醇干扰素(PEG-IFN)治疗的血清HBsAg清除率为3%~14%,致使针对CHB功能性治愈的研究受限。
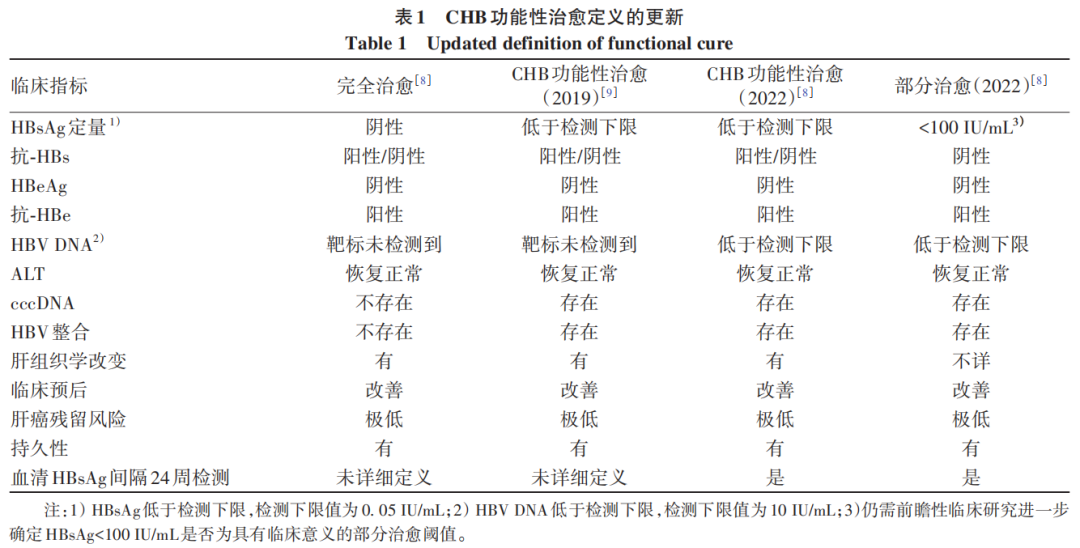
2019年我国推出《慢性乙型肝炎临床治愈(功能性治愈)专家共识》,明确将CHB功能性治愈定义为“持续病毒学应答且血清HBsAg阴转或伴有抗-HBs阳转、ALT正常、肝组织学病变轻微或无病变”。随着临床研究的进一步深入,CHB功能性治愈的概念逐渐趋于完善,有了更多细化的标准。研究发现,部分CHB患者虽然血清HBsAg阴转,但血清HBeAg仍为阳性,而停止抗病毒治疗时血清HBeAg阳性是血清HBsAg复阳的危险因素(OR=12.271)。在终止PEG-IFN治疗时,血清中抗-HBs抗体水平≥100 IU/L是血清HBsAg复阳的保护因素(OR=0.110),这与宿主针对HBV的免疫功能恢复密切相关;相反,对于那些在停止治疗时血清抗-HBs抗体水平低于10 IU/L且已实现HBsAg阴转的患者,血清HBsAg复阳率可达29.5%。除了血清HBsAg阴转时的HBeAg及抗-HBs状态是血清HBsAg复阳的危险因素外,停止抗病毒治疗后仅一次确认血清HBsAg阴转的患者其后续随访中血清HBsAg复阳率高于两次确认(至少间隔24周)HBsAg阴转的患者。美国肝病学会-欧洲肝病学会HBV-HDV治疗终点会议中,将CHB功能性治愈定义为:停止抗病毒治疗后24周持续的血清HBsAg阴转和HBV DNA低于定量检测下限(即HBV DNA<10 IU/mL),伴或不伴抗-HBs出现;同时需要满足血清HBeAg持续阴转、ALT复常,最终获得肝组织学改善并降低肝癌的发生风险,但肝脏中仍有cccDNA及整合HBV DNA。CHB完全治愈则是在CHB功能性治愈的基础上清除肝内的cccDNA及HBV DNA整合,但由于cccDNA及HBV DNA整合位于肝细胞核内,并且目前的NAs及PEG-IFN很难到达肝细胞核内直接作用于cccDNA及HBV DNA整合,CHB完全治愈被认为在临床实践中难以达到。部分治愈定义更新为如下:停止抗病毒治疗后血清HBsAg持续小于100 IU/mL,血清HBV DNA低于检测下限,至少维持24周,但血清HBsAg<100 IU/mL是否为具有临床意义的安全阈值仍需临床大数据进一步评判(表1)。
有文献报道,完全抑制HBV复制后进一步清除血清HBsAg,8年肝细胞癌(HCC)的累积发生率可下降至0.6%。中国慢性乙型肝炎临床治愈(珠峰)工程项目、OSST研究、NEW SWITCH研究的数据提示,NAs经治的优势患者的48周血清HBsAg清除率可达31.43%、22.2%和26.5%;其次,对CHB儿童、HBV感染孕妇产后等特殊人群亦有探索功能性治愈的相关研究,并取得一定疗效。例如,接受PEG-IFN-α-2b治疗的HBV感染孕妇,48周时的HBsAg清除率为51.06%。这些研究提示,在特殊人群中实现CHB功能性治愈亦具有较强的可行性。
既往关于血清HBsAg清除后肝内HBV标志物的研究多在HBV隐匿性感染合并HCC的患者中进行。然而,经过有限疗程抗病毒治疗达到血清HBsAg清除的患者,其肝内HBV标志物仍需进一步阐明。上述临床研究为探讨CHB功能性治愈的预测因素及探索肝内HBV标志物谱奠定了重要基础。本文对当前功能性治愈的血清学及肝组织学研究进展进行综述,并讨论了实现完全治愈面临的挑战和未来研究的方向。
1CHB功能性治愈的血清学标志物及其意义
1.1 血清HBsAg检测及其意义
HBsAg主要来自cccDNA和HBV DNA整合的转录合成,随着CHB疾病进程的变化,cccDNA和整合HBV DNA来源的HBsAg的占比会发生变化。HBV感染的最初阶段以含有cccDNA的肝细胞为主,含有HBV DNA整合的肝细胞只占很少数(每104~106个细胞中含有1个HBV DNA整合),随着宿主针对HBV免疫应答的激活,免疫反应倾向于靶向产生HBV聚合酶和HBeAg的肝细胞,这些HBV蛋白主要由cccDNA产生,而非整合形式的HBV DNA产生,因此宿主免疫主要靶向cccDNA转录活跃复制的肝细胞,这就导致含有cccDNA的感染肝细胞死亡,而含有HBV DNA整合的肝细胞出现选择性克隆扩增(图1)。同时,由于以微小染色体形式存在的cccDNA缺乏着丝粒,HBV感染的肝细胞可在有丝分裂过程中产生未受感染的子代细胞,导致残存感染肝细胞中cccDNA池被稀释,而整合在宿主基因组中的HBV DNA会随着有丝分裂传给子代肝细胞,从而导致HBV DNA整合得以保留。值得注意的是,子代肝细胞亦可发生新的感染,从而引发新的整合事件。这种清除、克隆扩增和再感染的循环会持续下去,导致血清病毒载量的波动,但HBsAg的波动幅度较小。这主要是因为HBV DNA整合来源的HBsAg占比会随着含有HBV DNA整合的肝细胞比例的增加而增加,特别是在HBeAg阴性的CHB患者中,HBV DNA整合成为HBsAg的主要来源。
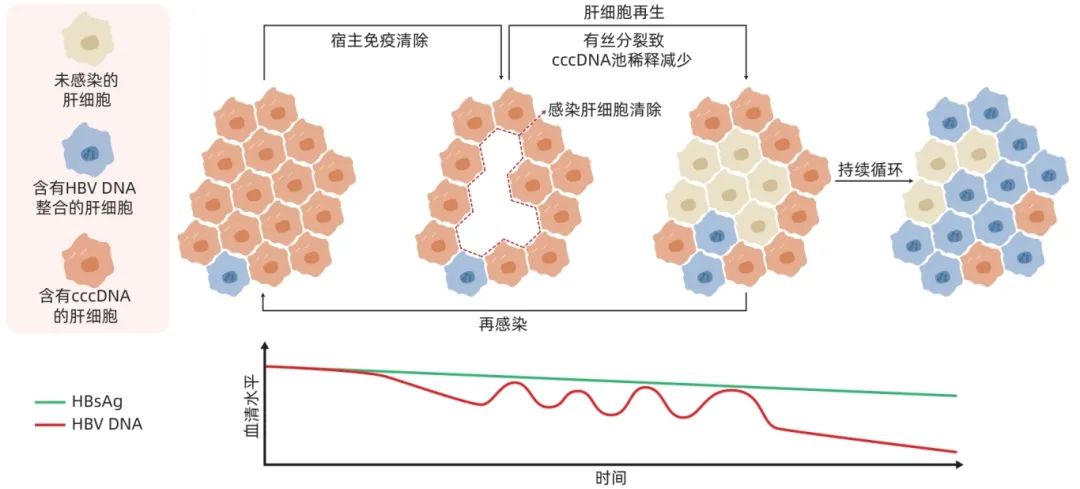
图1 慢性HBV感染过程cccDNA及HBV DNA整合变化情况
血清中的HBV颗粒主要包含Dane颗粒、小球形颗粒和管型颗粒,以上这些病毒颗粒中HBsAg的主要成分是小HBsAg,中HBsAg仅占10%左右。管型颗粒和Dane颗粒含有约25%的大HBsAg。无论是大HBsAg、中HBsAg及小HBsAg,其都含有“a”决定簇,血清HBsAg的检测试剂主要针对“a”决定簇设计。目前ARCHITECT Alinityi HBsAg检测(雅培实验室)和Elecsys HBsAg Ⅱ Quant检测(罗氏诊断)在临床上被广泛使用,两者的定量HBsAg结果均以IU/mL为单位。虽然Architect HBsAg和Elecsys HBsAg Ⅱ均以0.05 IU/mL为判定界值,但二者灵敏度并不相同。亦有研究提示,血清HBsAg<0.05 IU/mL并不能完全代表HBsAg清除。
近期,有学者在一项包含36例患者的回顾性临床研究中提出,虽然患者停止抗病毒治疗时血清HBsAg低于0.05 IU/mL,但仍有极低滴度的血清HBsAg(0.005 2~0.05 IU/mL),这部分极低滴度HBsAg阳性的人群中62.5%的患者在后续24周的随访中出现血清HBsAg复阳。有研究提示,在传统方法血清HBsAg检测为阴性但HBV DNA为阳性的200名献血员中使用高敏HBsAg检测,其中5%仍被判定为阳性。采用高敏HBsAg检测法(检测限为0.005 2 IU/mL)可使得隐匿性HBV感染者的检测率提高5%~7%。同时,高敏HBsAg检测法在急性HBV感染中可以更早地检测出血清HBsAg,这提示高敏HBsAg检测在后续判定CHB功能性治愈及明确HBV复发中可能起到重要作用。除了检测下限为0.005 2 IU/mL的高敏血清HBsAg检测,超高灵敏定量HBsAg检测试剂也被开发,其检测下限为0.000 5 IU/mL,较常规HBsAg检测试剂检测下限低100倍,除了检测血清游离HBsAg蛋白外,还能解离HBsAg-抗HBs免疫复合物,从而表现出更高的灵敏度;既往研究提示,在22例发生HBV再激活的患者中,有17例(77.3%)可以通过超高灵敏HBsAg检测确定基线血清HBsAg阳性。
目前,CHB功能性治愈治疗终点中普遍接受将HBsAg检测下限设置为0.05 IU/mL。针对临床治疗终点血清HBsAg检测是否应该使用更加灵敏的方法仍存在争议,未来需要进一步前瞻性多中心临床队列研究验证高敏HBsAg检测在功能性治愈终点中的评判效能。除了关注HBsAg检测的灵敏度,仍需关注停止抗病毒治疗后HBsAg低于检测下限的维持时间(≥24周)及患者既往是否使用IFN巩固治疗等。既往研究提示,宿主免疫的恢复(高水平抗-HBs)和12~24周的PEG-IFN巩固治疗与血清HBsAg持续阴转密切相关。另一方面,肝脏中微量转录活化的cccDNA可导致患者持续暴露于微量HBsAg,这部分患者仍有发生肝硬化、肝癌及HBV复发再激活的风险。同时,HBV DNA整合来源的HBsAg更易潴留于肝细胞内,未来需要进一步评估是否有必要将血清HBsAg与肝内HBsAg检测结合,以评判肝内HBsAg清除情况。
当HBsAg的“a”决定簇突变时会影响HBsAg的检测效能。如果AA141~145表位突变,则部分血清HBsAg检测试剂无法识别HBsAg,临床上会出现HBsAg检测结果为阴性,但血清和/或肝脏中仍存在HBV DNA。新的HBsAg定量测定已经纳入了一些经典的AA突变对检测结果的影响,如sK122I、sI126S和sG145R。不同的HBsAg检测试剂在灵敏度及检测HBsAg突变时仍存在一定差异。T123A突变在Architect测定中定量不足,而sP142L、sP142S和sG145K突变在Elecsys HBsAg Ⅱ Quant检测中的结果低于Architect,提示目前普遍使用的HBsAg检测试剂在检测HBsAg突变时存在一定差异。同时有研究报道,C、F和H基因型HBV的HBsAg蛋白中存在L110I突变,可损害HBsAg的抗原性,从而影响HBsAg的检测,致使部分试剂在C基因型中的定量结果比预期值低。除了HBsAg的突变影响检测以外,血清HBsAg-抗HBs循环免疫复合物的形成也是HBsAg检测为“阴性”的一个重要原因,但目前的Architect检测和Elecsys HBsAg Ⅱ Quant中均未加入上述“释放”HBsAg-抗HBs循环免疫复合物中微量HBsAg的步骤,未来可能需要进一步优化试剂并进行深入研究。
1.2 血清HBsAg成分
除了HBsAg总量的变化可以预测血清HBsAg清除外,血清HBsAg的成分变化亦与CHB功能性治愈密切相关。既往研究报道,血清HBsAg成分的比例在急性和慢性HBV感染的不同阶段中并不相同,高水平的中HBsAg与HBV感染的高复制状态密切相关。多项研究提出,基线、12周时大HBsAg和中HBsAg水平可以预测非活动性HBsAg携带者使用PEG-IFN治疗的血清HBsAg清除情况,并且预测值高于总HBsAg检测。在NAs治疗达HBsAg清除的患者中发现NAs治疗第6个月时中HBsAg检测不到,这种中HBsAg清除发生在总HBsAg清除前(12.8±8.7)个月,中HBsAg比例变化是NAs治疗后达HBsAg清除的早期预测因子。但HBsAg成分定量的大多数研究缺乏关于标准品使用的信息,因此很难获得可比较的结果。未来的HBsAg成分研究需要纳入对标准品的描述,进一步明确其临床预测价值。
1.3 血清HBV DNA检测下限
既往研究提示,采用普通方法检测HBV DNA结果为阴性(<500 IU/mL)的标本,使用高灵敏度的HBV DNA检测(检测下限为10 IU/mL,低于10 IU/mL为阴性),其中63.8%的标本被判断为阳性。以上结果提示,随着血清HBV DNA检测下限越来越低,基于既往试剂检测结果定义的CHB功能性治愈在使用更灵敏的检测方法时可能会被归为未治愈范畴。目前国际指南建议将CHB功能性治愈中的血清HBV DNA阴性设置为低于检测下限,即<10 IU/mL的水平。为了更好地定义CHB功能性治愈并排除间歇性HBV DNA检测阳性,建议至少间隔24周检测血清HBV DNA持续低于检测下限。目前,部分HBV DNA定量检测试剂灵敏度可达到5 IU/mL,未来是否需要更加灵敏的HBV DNA检测试剂来定义CHB功能性治愈需要进一步深入探索。
1.4 乙型肝炎核心相关抗原(HBcrAg)及前基因组RNA (pgRNA)
HBcrAg是一种新型血清标志物,由HBcAg、HBeAg和22 kD的前核蛋白(p22cr)组成。HBcrAg与传统预测指标HBsAg及ALT相比,其预测PEG-IFN诱导的HBsAg清除的价值主要在于其可反应cccDNA的转录复制情况。同时有研究指出,停止抗病毒治疗时血清HBcrAg<4 log10 U/mL可识别可能实现持久CHB功能性治愈的应答者。随着HBcrAg检测灵敏度的提高,HBcrAg有望成为CHB患者治疗监测和预后判断的重要血清学标志物之一。
在隐匿性HBV感染合并HCC患者的癌旁组织中亦能发现肝内cccDNA及pgRNA,提示即使在HBV DNA低于检测下限、甚至血清HBsAg转阴后肝内HBV RNA仍可存在。前期研究亦发现,部分血清HBsAg阴性的患者肝内HBV RNA及HBsAg阳性,但其血清HBV RNA低于检测下限,提示目前的血清HBV RNA检测灵敏度尚不能准确反映肝内cccDNA的转录复制状态,可能需要优化引物设计及提高灵敏度等,未来需大样本的前瞻性研究进一步阐明其临床诊断价值及意义。
2肝内HBV标志物
HBV为嗜肝病毒,肝内HBV标志物较血清HBV标志物更能反映CHB功能性治愈患者的复发风险及预后。HBV的复制模板为肝内cccDNA,但在HBV复制的过程中可产生副产物——双链线性HBV DNA,其可整合入宿主基因组中。HBV DNA整合可以导致插入突变、染色体不稳定等,同时HBV DNA整合可插入多种癌症通路相关宿主基因中,与HCC发生密切相关。值得注意的是,在患者达到功能性治愈血清HBsAg清除后,肝内的cccDNA、HBV RNA、HBV DNA整合及其嵌合转录本水平明显低于CHB未治愈患者,可能与血清HBsAg清除后患者的肝癌发生风险降低密切相关。同时,有31.9%的血清HBsAg清除患者肝内cccDNA低于检测下限,可以认为这些患者已接近彻底治愈,可能与PEG-IFN通过免疫调节作用介导HBV感染的肝细胞破坏及cccDNA池稀释相关。有研究报道,使用更加灵敏的数字液滴PCR方法检测cccDNA,发现CHB功能性治愈患者肝内cccDNA水平低于CHB患者50倍。然而,部分血清HBsAg清除的患者肝内仍可检测到HBV RNA,提示肝内仍有微量转录活化的HBV DNA整合和/或cccDNA。同时,部分血清HBsAg清除患者肝内的HBV RNA低于检测下限,肝组织测序亦未检测到HBV DNA整合来源的嵌合转录本,这预示着肝内HBV可处于转录静默状态。需要关注在CHB功能性治愈患者中有两种完全不同的肝内HBV转录模式,即持续微量转录活化及转录静默,二者后续的预后及复发风险是否会不同,需要未来进一步深入研究。
研究发现,尽管患者血清HBsAg<0.05 IU/mL,但25%的患者肝内仍可残存HBsAg,由此需考虑肝内HBsAg的来源并评估其与HBV复发的相关性。通过研究发现,这部分残余的HBsAg主要来自活化转录的HBV DNA整合,少部分来源于微量转录活化的cccDNA。这种微量活化转录的cccDNA与患者随访过程中HBV再激活密切相关,提示目前的CHB功能性治愈定义中的血清HBsAg<0.05 IU/mL并不能完全代表血清及肝内的HBsAg清除,需要关注血清-肝内HBsAg检测差异机制,这对临床决定停止抗病毒治疗时机有着重要意义。这种血清-肝内HBsAg差异机制可能由三种原因所致:(1)目前血清HBsAg检测试剂的灵敏度不够,既往报道如果使用检测下限为0.005 2 IU/mL的血清HBsAg检测试剂,90.9%的血清HBsAg复阳患者(24周随访)在停止PEG-IFN治疗时仍被判定为阳性(>0.005 2 IU/mL),提示部分血清HBsAg<0.05 IU/mL的患者停止PEG-IFN治疗时,其血清HBsAg并未完全清除,肝内可能仍有微量转录活化的cccDNA及HBV DNA整合。(2)血清及肝内存在不同类型的HBsAg:HBV DNA整合表达的HBsAg分泌效率显著低于cccDNA,可出现肝细胞内潴留,同时部分HBV突变同样会影响HBsAg分泌。(3)血清中存在HBsAg-抗HBs循环免疫复合物遮蔽了HBsAg检测位点:既往有研究在血清HBsAg阴性而HBeAg阳性的样本中发现其中70%的样本存在HBsAg-抗HBs循环免疫复合物,其为血清HBsAg检测结果为“阴性”的一个重要原因。以上结果提示,目前的血清HBsAg<0.05 IU/mL并不能完全反映血清HBsAg清除。同时有研究指出,在AAV-HBV小鼠模型中清除血液中的HBsAg并不能改善HBV特异性T淋巴细胞免疫,清除肝脏内的HBsAg才能打破HBV的免疫耐受,这提示需要同时关注血清和肝内HBsAg的检测。
3完全治愈面临的挑战
3.1 cccDNA的稳定持续存在
cccDNA以微小染色体的形式稳定存在于宿主细胞核内,是病毒的复制转录模板,其受到核膜的保护,难以被药物或免疫因子直接影响。一方面,早期的研究普遍认为cccDNA的半衰期非常长,临床研究模型推算发现NAs治疗后HBV cccDNA清除期约为14.5年,另有研究亦提示NAs治疗患者血清HBsAg清除的中位时间为52.2年,以上研究均提示患者可能需要长期口服NAs抗病毒治疗。另一方面,虽然以拉米夫定耐药位点作为特异性标记的研究发现cccDNA的半衰期约为6个月,但临床中约有20%的接受规范NAs治疗的患者其血清中仍存在低水平的HBV DNA,提示NAs竞争性抑制HBV DNA复制具有一定局限性,不能完全阻断cccDNA池的补充。现有的NAs及PEG-IFN都不能直接清除cccDNA,目前针对HBV的治疗手段仍具有一定局限性。虽然既往文献报道肝细胞有丝分裂可导致残存感染肝细胞中cccDNA池被稀释,然而,HBV cccDNA在少数非增殖人肝细胞中持续存在,这些残存的cccDNA是后期病毒学标志物再次反弹的重要原因。同时,低转录活性状态的cccDNA更难被抗病毒药物可及,治疗难度增加。因此,未来不仅需要研发阻断cccDNA池补充的抗病毒药物,也需要对直接靶向清除cccDNA进行药物研发。
3.2 宿主针对HBV清除的免疫无法恢复
慢性HBV感染可使宿主适应性免疫及天然免疫反应网络受损。HBV除了可引起宿主T淋巴细胞耗竭外还影响固有免疫反应,特别是树突状细胞和巨噬细胞的抗原呈递功能障碍,损害了固有免疫和适应性免疫的连接桥梁。既往研究发现,HBV抑制单核细胞向M1-MDM(M1-单核细胞来源的肝内巨噬细胞)分化,且增强了M2-MDM(M2-单核细胞来源的肝内巨噬细胞)的激活,从而增强肝脏免疫耐受状态;同时,HBV感染期间IL-10表达上调会损害淋巴细胞功能,亦影响HBV清除。在慢性HBV感染患者中亦发现NK细胞免疫耐受及HBV特异性CD4+和CD8+T淋巴细胞不能充分响应,同时HBsAg特异性B淋巴细胞存在成熟缺陷。以上均为慢性HBV感染持续存在的重要因素。
3.3 宿主遗传因素影响药物应答
不同CHB患者对抗病毒治疗的反应存在差异,影响治疗效果。目前有多项研究提示宿主遗传因素对CHB患者的抗病毒应答发挥重要作用。有研究发现,位于1号染色体的TP53BP2(rs7519753)与PEG-IFN治疗后CHB患者的HBsAg清除有关。SNP rs7519753的C等位基因利于TP53BP2在肝脏中的高表达,TP53BP2能够增强IFN-α的抗病毒作用。同时亦有学者发现,STAT4(rs7574865)突变体与PEG-IFN治疗患者的血清HBsAg清除之间存在显著相关性。在B基因型HBV感染患者中,rs7574865 TT患者中有7.7%的HBsAg清除,而NAs治疗的患者中rs7574865基因型与血清HBsAg清除无关。以上研究提示宿主的遗传因素在PEG-IFN治疗中发挥重要作用,未来可通过检测rs7519753和rs7574865的基因型来有效识别易于实现功能性治愈的CHB患者,实现个体化治疗,提高治疗成功率。
4针对cccDNA的抗病毒治疗
现有的NAs及PEG-IFN可以抑制病毒复制,但对于清除cccDNA并无有效作用。cccDNA可通过细胞内循环和细胞外循环两种途径进行补充。含有rcDNA的核衣壳可转运至细胞核以细胞内循环补充cccDNA池。同时,新合成的HBV DNA病毒颗粒亦可进入感染肝细胞内,脱去外膜的rcDNA进入细胞核内,形成cccDNA外循环补充。既往体内实验报道,cccDNA主要来自细胞内循环,特别是来自新合成的病毒核衣壳补充,以维持cccDNA池。衣壳组装调节剂或抑制剂可以通过阻断核衣壳形成从而抑制HBV复制,阻碍cccDNA内循环补充,如ABI-H0731和RO7049389可显著减少HBV DNA和HBV RNA。同时,针对HBV通过钠离子-牛磺胆酸共转运蛋白进入感染肝细胞的细胞外循环过程,Myrcludex-B可与病毒Pre-S1基序竞争钠离子-牛磺胆酸共转运蛋白结合,从而阻断HBV感染。除了阻断cccDNA的补充以外,最直接的抗cccDNA策略是特异性降解cccDNA。近期有研究报道,口服小分子cccDNA抑制剂ccc_R08可有效降低cccDNA水平,而对线粒体DNA无明显影响。目前,基于CRISPR/Cas9的基因组编辑技术不仅能破坏HBV cccDNA,还能切割整合的HBV DNA,但该技术有诱导宿主基因组不稳定和癌变的风险。除此以外,cccDNA的表观遗传修饰环节亦可调节沉默病毒基因转录,包括作用于cccDNA相关组蛋白的乙酰化和甲基化过程。除了上述非溶细胞效应相关的cccDNA清除外,亦可通过增强宿主免疫功能从而清除cccDNA,如Toll样受体激动剂和程序性死亡受体1阻断剂等。将阻断HBV复制过程的抗病毒药物与宿主免疫增强剂结合可增强抗病毒效应,是未来抗病毒治疗趋势。
5HBsAg<100 IU/mL是CHB功能性治愈的替代治疗结局吗?
相较于血清HBsAg清除的患者,在临床中有许多患者经过抗病毒治疗后HBsAg下降并维持在低水平,但目前国际上针对血清HBsAg<100 IU/mL的CHB患者继续抗病毒治疗追求血清HBsAg清除是否有更多临床获益存在争论。血清HBsAg<100 IU/mL的CHB患者发生肝硬化的累积风险为4.8%,发生HCC的累积风险为1.4%。有研究报道,血清HBsAg水平在100~999 IU/mL组的患者相较于血清HBsAg<100 IU/mL组患者,发生肝硬化及HCC的风险比分别为1.68和2.20;而在另一项针对HBeAg阴性患者的研究中,HBsAg水平在100~999 IU/mL组与HBsAg<100 IU/mL组之间的HCC发生率并无差异。针对HBsAg<100 IU/mL CHB患者的肝硬化及肝癌发生风险评估,未来需要前瞻性多中心研究进一步探索。前文已述HBV基因型、HBV DNA整合及HBsAg突变等可影响血清HBsAg分泌,笔者团队建议在分析血清HBsAg水平与HCC的风险时,需要纳入上述因素对HBsAg分泌能力的影响,从而更加清晰地明确血清HBsAg水平分层与HCC发生风险的关系。
血清HBsAg<100 IU/mL但HBV DNA>104拷贝/mL的患者HCC发生风险较HBsAg<100 IU/mL且HBV DNA<104拷贝/mL患者增加1.42倍,二者肝硬化发生风险无统计学意义,提示HBV DNA水平与低HBsAg水平人群发生HCC密切相关。有研究提示,虽然患者经抗病毒治疗后血清HBsAg水平下降,但是中HBsAg水平的增加与HBV驱动的HCC密切相关,因此不建议仅关注血清HBsAg总量的变化,需要考虑HBsAg成分的变化,未来HBsAg成分检测的临床价值值得进一步研究。综上所述,血清HBsAg<100 IU/mL的患者仍有发生肝癌及肝硬化的风险,需要结合HBV DNA载量、是否合并肝硬化及HBsAg组成成分的变化等进行判断,同时需要考虑HBeAg、HBV基因型对于肝硬化及HCC发生的影响。
一方面,有研究报道较低的血清HBsAg水平与停止NAs治疗后血清HBsAg清除相关,特别是在血清HBsAg<100 IU/mL和/或HBcrAg低于检测下限的非亚裔患者中,同时HBV基因型亦会影响其血清HBsAg清除率。值得注意的是停止NAs治疗的相关研究异质性较大,荟萃分析提示停止NAs治疗的患者中发生严重肝炎发作或肝功能失代偿的患者比例约为1.21%,肝炎发作相关死亡或肝移植患者的比例约为0.37%。未来针对NAs停药安全性仍需进行多中心的前瞻性研究,并有充足的随访时间和明确的研究结局定义。另一方面,血清HBsAg<100 IU/mL的患者接受PEG-IFN治疗后的HBsAg清除率可达81.1%,提示低血清HBsAg水平患者容易获得HBsAg清除。对于血清HBsAg<100 IU/mL的患者接受NAs或PEG-IFN治疗后的临床获益情况,未来需要在前瞻性临床研究中进一步探索,明确抗病毒治疗后和未抗病毒治疗组血清HBsAg<100 IU/mL的患者肝癌及肝硬化等发生率有无差异,以揭示此类患者经过抗病毒治疗后是否有临床获益。
6展望
CHB功能性治愈仍然是目前的理想治疗终点,随着研究的不断深入,CHB功能性治愈患者部分可能已经达到cccDNA低于检测下限,但由于cccDNA和HBV DNA整合位于细胞核内很难清除,目前的抗病毒治疗方案仍较难达到CHB完全治愈。
目前,针对cccDNA及HBV DNA整合的新药研发仍在进行中,siRNA和反义RNA可以通过结合cccDNA与HBV DNA整合来源的靶mRNA,靶向HBV RNA转录后调控,从而沉默其表达。同时,基因编辑技术针对清除cccDNA及整合HBV DNA亦有一定前景。随着更高灵敏的CHB功能性治愈血清学标志物的开发及更加有效的抗病毒治疗策略的产生,相信,对于CHB可以无限趋近于完全治愈。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCp50103



