【醉仁心胸】术中FiO2与肺切除术后氧合功能障碍的关系:一项倾向性评分加权分析
时间:2025-01-30 12:10:03 热度:37.1℃ 作者:网络

接受肺切除手术的患者约5%在术后一个月内死于肺部并发症[1],然而,关于肺切除术中肺保护性通气的研究相对较少。术中高FiO2可能与不良的肺部及肺外结局有关,然而为了避免术中低氧血症的发生肺切除术中FiO2接近100%的情况依然很常见[2]。该研究采用回顾性队列研究,着重探讨术中FiO2对肺切除术后肺功能的潜在影响,比较了术中FiO2较高与较低患者组术后氧合受损的发生情况,为优化肺保护通气策略提供依据。
该研究于2025年1月发表于Journal of Clinical Anesthesia。
摘要
研究目的:
该研究旨在评估在肺切除术患者,术中FiO2较高是否与术后术后氧合障碍的增加相关。术后氧合障碍是肺损伤或功能障碍的临床表现。
研究设计:
回顾性队列研究。
研究地点:
美国两家大型学术型医院。
研究人群:
2936名术中氧合良好的肺切除患者(术中SpO2中位数≥95%)。
测量指标:
通过倾向评分加权调整了75个围手术期变量,比较了术中FiO2较高(≥0.8)与较低(<0.8)组患者的术后氧合受损情况。术后氧合受损的主要结局定义为术后七天内出现以下任意一项:(1)SpO2<92%;(2)估算PaO2/FiO2 < 300 mmHg;(3)需要高强度氧疗(机械通气或FiO2>50%或高流量氧疗)。
主要结局:
在2936名患者中,2171名(73.8%)患者接受的术中FiO2中位数≥0.8。术后氧合受损在FiO2较高组的1627(74.9%)名患者中发生,而在FiO2较低组的422(55.2%)名患者中发生。倾向评分加权分析显示,较高的术中FiO2与术后氧合受损风险增加84%相关(OR 1.84;95% CI 1.60-2.12;P < 0.001)。
结论:
尽管可能对肺功能造成不利影响,高FiO2在肺切除术中依然非常普遍。近四分之三的肺切除患者在氧合正常的情况下接受的术中FiO2中位数≥0.8。较高FiO2与术后氧合受损的风险增加相关,这一现象反映了肺损伤或功能障碍的临床表现。研究结果支持在术中使用较低的FiO2(<0.8)并在临床试验中进一步评估其效果。
1.引言
全球每年约有60万名患者接受肺切除手术。其中,约5%的患者在术后一个月内死于肺部并发症。然而,关于肺切除术中肺保护性通气的研究相对较少。FiO2作为肺保护性通气的组成部分,在胸外科麻醉中的关注较少。高FiO2的潜在不良影响包括炎症、氧化应激和氧气吸收性肺不张。在大规模研究中,已观察到高FiO2与不良肺部及肺外结局的关联,这为围手术期氧气毒性的临床影响提供了证据支持。
尽管高FiO2可能带来危害,且术中低氧血症的发生率较低(约5%), 在肺切除术中FiO2接近100%的情况依然很常见。全球范围内,肺切除术患者的术中FiO2中位数常常≥0.8,尽管其氧合正常。由于缺乏关于高氧在肺切除术中影响的研究数据,肺切除术期间仍在使用高FiO2。至今,对于术中高FiO2与术后肺部并发症之间是否存在因果关系仍存一定争议。证据表明,由于患者合并症负担较重以及接受较高FiO2的患者术前和术中的肺功能较差,临床上显著的围手术期氧气毒性问题已受到质疑。
该研究旨在为术中FiO2对肺切除患者术后肺损伤/功能障碍的潜在影响提供证据,特别是考虑到术中低氧血症可能是使用高氧的临床指征。该研究的假设是,在氧合良好且临床上不需要高氧浓度的肺切除患者中,较高FiO2与术后氧合受损的风险增加相关,这也是肺损伤或功能障碍的临床表现。
2.方法
2.1. 研究设计和数据集
该论文进行了一个预设的回顾性队列研究,使用了两个大型学术中心——麻省总医院和布里根妇女医院(位于美国波士顿)的肺切除病例注册数据。符合条件的患者为18岁及以上,接受了2016年1月1日至2018年12月31日之间的开放式或视频辅助肺手术(图1)。为了确保暴露于足够的单肺通气,该研究排除了手术少于1小时或手术室时间少于1.5小时的病例。为了最小化指征引起的混杂因素(即在低氧血症患者中使用较高FiO2),该研究排除了术中SpO2中位数低于95%的患者。队列包括了大量实施从低风险的楔形切除术到更高风险的肺叶切除术和肺切除术的ASA III级高危患者。
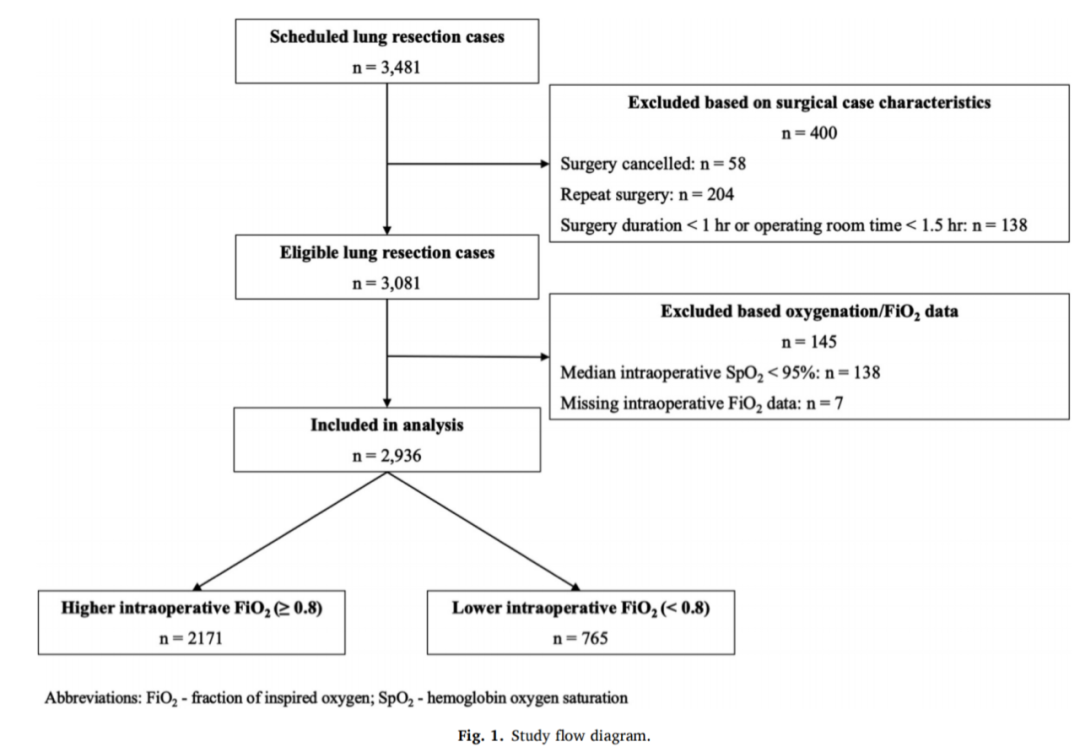
分析数据集提供了详细的术中生理学和麻醉护理数据。该研究遵循了STROBE指南,并获得了合作医院的人体研究委员会批准(协议2013P002600)。
2.2暴露
预设的主要暴露变量为术中FiO2中位数≥0.8(高FiO2组)与<0.8(低FiO2组)。该研究选择0.8作为界限值是基于以下原因:(1)FiO2≥0.8与术后呼吸并发症的风险增加相关;(2)在之前的前瞻性研究中,肺切除术中FiO2的中位数为0.8。
在分析前,两位麻醉专家(AN,MFVM)根据临床证据和经验,定义了一个因果推断框架——一组假设的暴露-结局因果关系,用于选择可能的混杂变量。术前变量包括人口统计学数据、合并症和药物使用情况。术中变量包括手术特点、麻醉和药物剂量、术中通气设置、呼吸力学和气体交换指标、血流动力学及其他生理数据。
2.3 结局
该研究之前描述的主要结局——术后氧合受损,定义为术后七天内至少出现以下情况之一:1)SpO2 < 92%;2)估算的PaO2/FiO2 < 300 mmHg。高强度氧疗包括机械通气和使用FiO2 ≥ 0.5或高氧流量的设备。该研究的主要结局聚焦于肺功能,区别于低氧血症,后者仅限于测量的血氧水平。
2.4 统计分析
该研究使用描述性统计对连续变量进行了均值和标准差或中位数和四分位数间距(IQR)总结,具体取决于数据分布。分类变量使用频数和百分比报告。为了确保组间可比性,该研究采用了倾向评分加权法进行因果推断分析。倾向评分及其相应的权重通过广义提升回归模型(Generalized Boosted Regression Modeling)在R的TWANG包中实现。该研究根据预设的因果推断框架为倾向评分模型确定了变量集。TWANG平衡表和对协变量在加权前后的相关性进行可视化检查,以评估研究组之间的平衡。在处理缺失数据时,采用单一插补方法。
在主要分析中,该研究将术中FiO2组作为暴露变量,术后氧合受损作为结局,采用广义线性混合效应模型(logit连接函数和随机截距,按倾向评分加权)。在二次分析中,该研究进一步探索了8个先验定义的术前和术中的变量,以识别与主要结局相关的因素。对于敏感性分析,该研究重复了主要分析:(1)次要结局使用术后中度或重度的氧合受损;(2)排除有呼吸系统合并症的患者(表1)。所有检验为双侧检验,显著性水平设为0.05。所有统计分析均在RStudio 2023.03.01版本中进行(美国波士顿)。

3.结果
3.1 研究人群
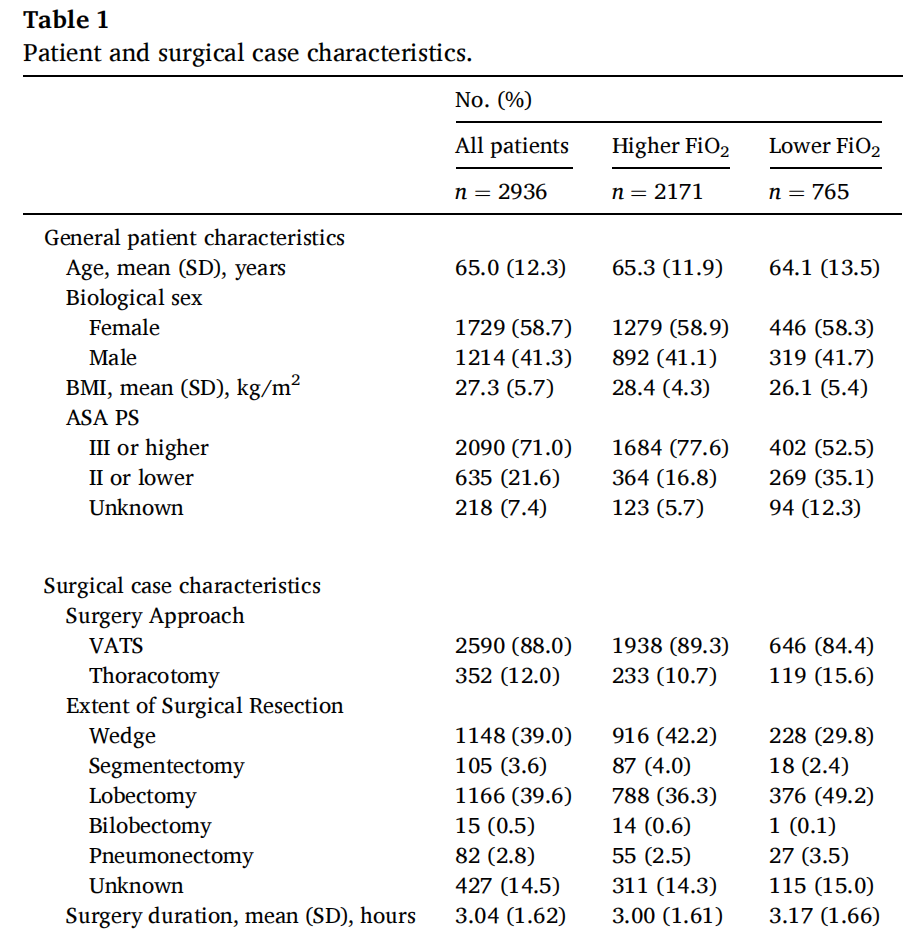
该研究共纳入2936名患者,术中SpO2中位数为95%或以上(图1)。患者的平均年龄为65.0(±12.3)岁,其中女性占1729(58.7%)。1341名患者(45.6%)的术中FiO2中位数大于等于0.95。其他机械通气设置符合肺保护通气策略,包括中等潮气量(5.4±1.1 mL/kg PBW)和PEEP(5.2±1.3 cm H2O)。这些设置导致ETCO2为39.5±4.6 mmHg,驱动压为16.6±4.8 cm H2O(表2)。
3.2 FiO2
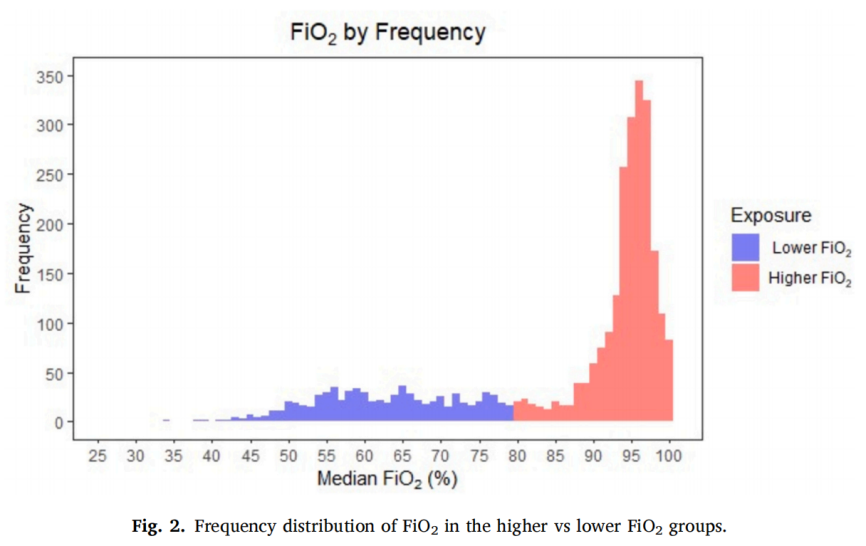
2171名患者(73.8%)接受了较高的术中氧气暴露(FiO2中位数≥0.8)。较高FiO2组的FiO2中位数为0.95(0.9–0.97),而较低FiO2组的FiO2中位数为0.63(0.56–0.71)(图2)。
3.3 主要结局
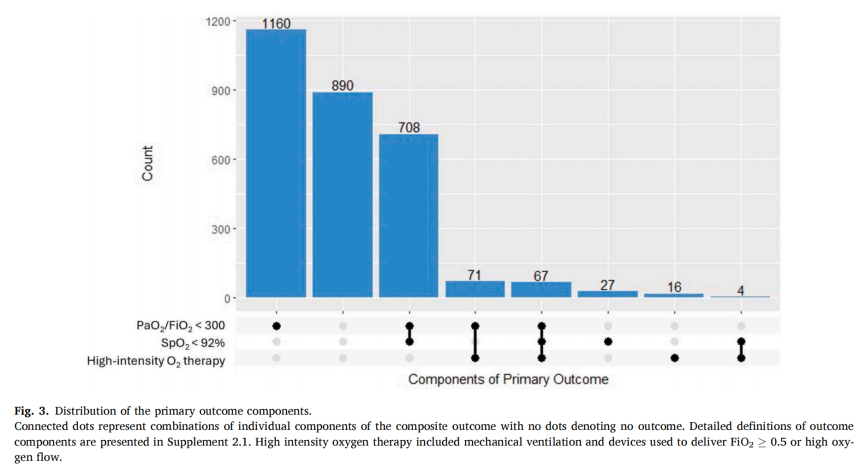
超过三分之二的患者在术后7天内出现氧合受损的主要结局(图3)(n = 2049,69.6%)。其中,四分之一的患者发生中度或重度氧合受损(n = 742,25.2%)。FiO2较高组中1627名患者(74.9%)出现氧合受损,而FiO2较低组中422名患者(55.2%)发生氧合受损。相比术后氧合正常的患者,出现氧合受损的患者其FiO2更有可能接近1,而术中SpO2接近100%的可能性较小。
3.4 术中FiO2较高和较低的患者特点
在进行倾向评分加权之前,较高与较低术中FiO2组之间存在显著差异。接受较高术中FiO2的患者的BMI值比低FiO2组高2.3 kg/m²(表1)。高FiO2组中有吸烟史、心力衰竭、高血压、糖尿病和慢性肾脏病的患者数大约是低FiO2组的两倍。相比之下,哮喘、COPD和阻塞性睡眠呼吸暂停在两组中的患病率相似。
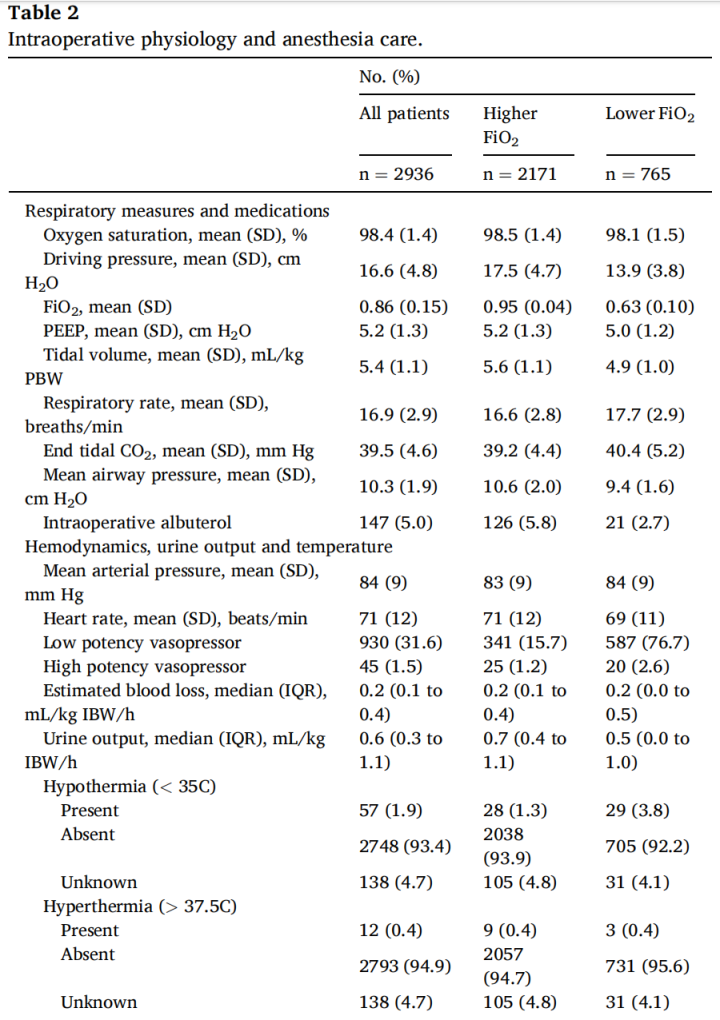
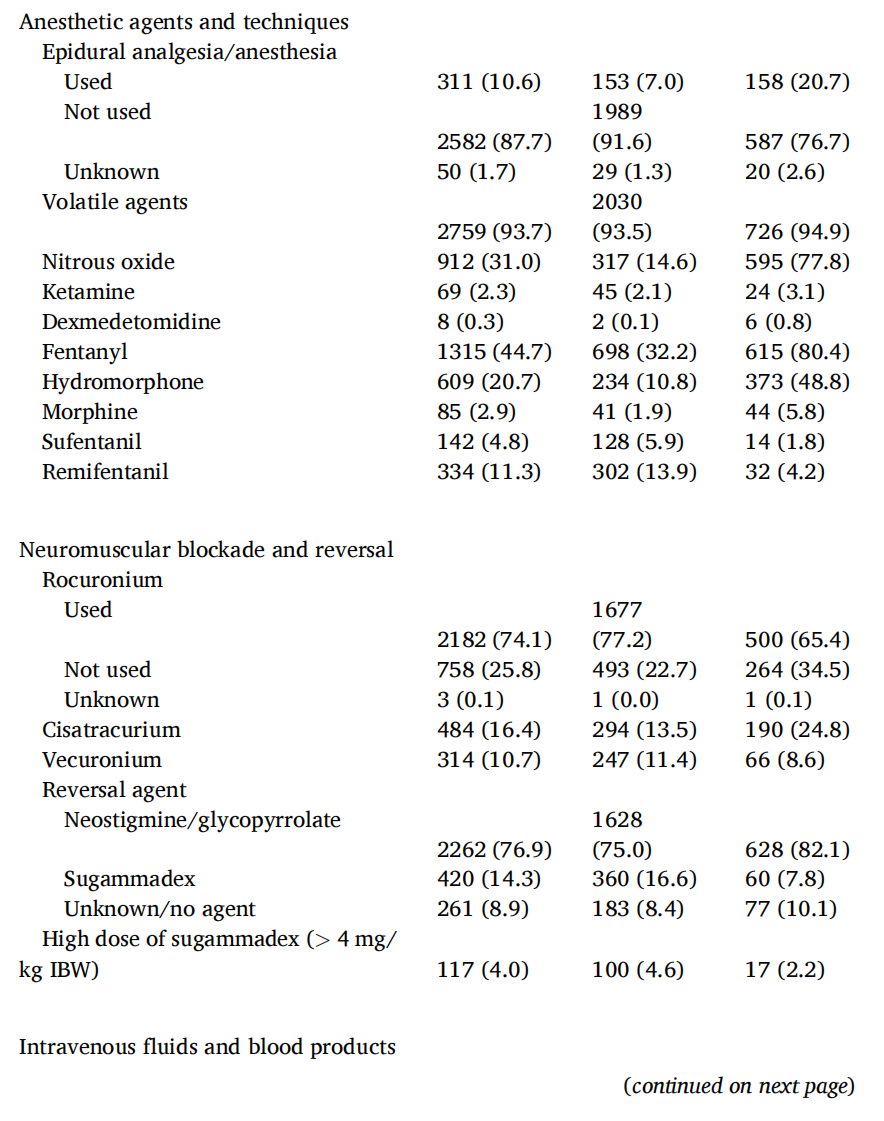
高FiO2组的术中SpO2中位数为99%,而低FiO2组为98%(表2)。在高FiO2组中,大部分患者(n = 1661,76.5%)的术中SpO2中位数在98%至100%之间。高FiO2组的患者具有更大的潮气量、更高的气道压力和更多的沙丁胺醇使用量(表2)。两组之间的PEEP、ETCO2和呼吸频率没有显著差异。
3.5 主要分析
基于75个变量的倾向评分加权方法有效地平衡了接受较高与较低术中FiO2的患者之间的特点。一个将麻醉师和外科医生作为随机效应的倾向评分加权模型显示,相比于低FiO2组的患者,暴露于较高术中FiO2的患者发生术后氧合受损的可能性增加84%(OR 1.84;95% CI 1.60–2.12;P < 0.001)。
3.6 二级和敏感性分析
在倾向评分加权二级分析中包括的8个先验指定变量中,6个变量与术后氧合受损结局显著相关(图4)。在一个敏感性分析中重现主要倾向评分加权模型,并使用中度或重度术后氧合受损作为二级结局,高术中FiO2仍然与术后氧合受损显著相关(OR 1.70;95% CI 1.45–2.00)。另一项敏感性分析排除了有呼吸系统合并症(COPD、哮喘、OSA)的患者,仍然显示较高的术中FiO2与术后氧合受损显著相关(OR 1.94;95% CI 1.60–2.36)。
4.讨论
在这项专门选择术中低氧血症发生风险小患者的大规模肺切除患者队列中,经过倾向评分加权分析发现:(1)患者的术中FiO2中位数较高,几乎一半的患者接受了术中氧气浓度中位数为95-100%的氧气治疗;(2)暴露于较高术中FiO2(中位数=0.95)的患者,在术后七天内发生氧合受损的可能性比接受较低术中FiO2(中位数=0.63)的患者增加了84%;(3)在排除了慢性肺病(如COPD和哮喘)患者的敏感性分析中,较高术中FiO2仍与术后氧合受损的可能性增加94%相关。
该研究是首项专门研究术中FiO2对肺切除患者术后肺功能/肺损伤影响的研究。在大多数患者的队列中,较高的FiO2反映了先前证明的可能是临床医生潜在的治疗实践模式,而非患者对高氧浓度的临床需求:为了最小化指征引起的混杂因素,该研究排除了术中持续低氧血症的患者(中位SpO2 < 95%)。此外,在敏感性分析中,进一步排除了有呼吸系统合并症的患者。
该研究的样本量约为3000名患者,在该患者群体中属于较大的样本量,这使该研究能够以较高的精确度估计效应大小(OR的95%置信区间:1.60至2.12)。与之前的肺切除研究中仅使用有限的术前和术中变量不同,该研究的分析包含了详细的病例特征、术中生理学和麻醉护理数据。更多的患者数量和变量使得倾向评分加权分析能够有效控制该人群中可能的混杂因素。通过强有力的混杂控制,进一步提高了该研究发现术后氧合受损风险增加的结论的可信度,表明这一风险增加并非是患者基线特征或术中护理中的混杂因素所致。
仅有一项先前的研究评估了术中FiO2对肺切除术后肺部结局的影响——这是一项小型(n = 197)的前瞻性研究,其中FiO2并非主要暴露变量,但较高的FiO2与术后肺部并发症的增加相关(OR 1.3,每0.1 FiO2)。这一结果与该研究样本量约15倍更大队列中的发现一致(OR 1.84,术中FiO2中位数为0.95 vs 0.63),并且该研究对潜在混杂因素进行了详尽的调整。
该研究的结果与之前在非心胸外科手术中的研究一致。一项在74,000名非心胸手术患者中的观察性研究发现,术中FiO2中位数为0.8的患者,与FiO2中位数为0.3的患者相比,术后肺部并发症的风险增加了两倍(OR 2.0)。高FiO2的负面影响依然存在。另一项在约350,000名非肺部/气道手术患者中的观察性研究表明,与FiO2曲线下25百分位的患者相比,FiO2曲线下75百分位的患者发生肺损伤的可能性增加了14% 。与该研究的发现相比,其效应较小可能是由于对超生理氧暴露的定义非常敏感——SpO2>92%。
来自亚洲、欧洲以及该研究在美国的研究结果表明,尽管术中低氧血症的预期发生率约为5%,肺切除患者仍然普遍暴露于可能有毒的FiO2浓度。该研究的结果提醒临床医生注意这种做法可能带来的危害,并建议在肺切除患者中加强FiO2的监测,因为这一群体特别容易发生术后肺部并发症。麻醉科医生可以通过限制高氧状态的长时间暴露,并通过肺复张操作和呼气末正压(PEEP)改善氧合,来预防肺部并发症。在大多数肺切除病例中,提高对氧气毒性的意识可能足以预防术中高氧引发的潜在系统性危害。
该研究的大型学术型医院持续使用高术中FiO2,这与意大利近期的国家指南以及早期的叙述性综述相对立,后者推荐使用最低可行FiO2。高FiO2的使用可能是由于缺乏高质量的证据来将FiO2列为导致肺损伤的独立因素,缺乏常规监测高氧血症的技术,以及对FiO2作为肺保护通气潜在组成部分的认识不足。事实上,一项最近的大型试验研究了胸外科手术中的肺保护通气策略,但未涉及FiO2。该研究结果表明,需要进行临床试验来比较高FiO2的潜在益处与危害,如预防低氧血症事件/器官缺血,或者由肺部和全身毒性介导的潜在危害。
4.1 限制
尽管该研究包含了许多术前和术中的变量,但数据收集的回顾性性质导致了固有的局限性和可能未被测量的偏倚。虽然该研究只纳入了在手术中总体氧合良好的患者,标准为术中SpO2中位数≥95%,但其中一些患者可能经历了暂时的低氧血症,而这些情况未被纳入分析。然而,考虑到肺切除术中预期约5%的低氧血症发生率以及术中氧气管理的任意性,该研究大多数患者可能暴露于未经临床验证的高氧状态。排除术中氧合不良(SpO2中位数较低)患者减少了因指征引起的混杂因素,但这也可能限制了该研究结果的适用性。
该研究结局关注的是客观记录的氧合和呼吸支持指标,但未包括如肺炎、呼吸衰竭或气胸等临床诊断,因为这些诊断在电子病历系统中难以大规模提取和验证。由于该研究依赖估算的FiO2而非直接测量,PaO2/FiO2计算的准确性有所下降。然而,尽管FiO2估算不完美引入了“杂音”,该研究的主要分析仍然识别出了具有临床意义的效应。此外,倾向评分加权分析可能未能完全平衡比较组之间的特征差异,如驱动压。然而,在该研究主要分析和包括了八个可能的术后氧合受损预测因子的二级模型中,高FiO2的效应值(OR 1.84与OR 1.93)是相似的(图4)。由于通气模式在电子病历中记录不一致,该研究未将其纳入分析,但其分析包括了多个能够表征呼吸变量(如峰值、平均值、驱动压、PEEP、潮气量等)的变量。
5.结论
接近四分之三的氧合正常的肺切除患者接受的术中FiO2中位数≥0.8。较高的FiO2与术后肺损伤(表现为氧合受损)风险增加相关。这一观察结果支持在术中使用较低的FiO2(<0.8),并应在临床试验中进一步评估其效果。
醉仁心胸 评述
这篇论文探讨了术中FiO2与肺切除术后肺损伤及功能障碍之间的关系。与之前的小型研究不同,该研究通过倾向评分加权分析控制了大量的混杂因素,进一步提高了结果的可信度,指出尽管高FiO2常见,但并没有充分的证据证明其在临床手术中的必要性。该研究纳入了近3000名患者,大样本量有助于准确估算FiO2对术后氧合的影响,采用倾向评分加权方法,有效减少了因患者基础条件不同而导致的偏倚,提高了分析的可靠性。该研究提出,高FiO2与术后氧合受损之间有显著相关性,建议临床在氧合良好的患者中尽量避免过高的FiO2,为肺切除术中的氧气管理提供了新的视角,并指出未来的研究应进一步探索应用高FiO2是否存在潜在益处以及如何平衡FiO2的使用,以促进肺切除患者的术后恢复。
原始文献
Choi A, Deng H, Fuller M, Sparling JL, Zhu M, Udelsman B, Frendl G, Vidal Melo MF, Nagrebetsky A. Intraoperative FiO2 and risk of impaired postoperative oxygenation in lung rep: A propensity score-weighted analysis. J Clin Anesth. 2025 Jan 3;101:111739. doi: 10.1016/j.jclinane.2024.111739.
参考文献
[1]Marseu K, Slinger P. Peri-operative pulmonary dysfunction and protection. Anaesthesia. 2016 Jan;71 Suppl 1:46-50. doi: 10.1111/anae.13311.
[2]Suzuki S, Mihara Y, Hikasa Y, Okahara S, Ishihara T, Shintani A, Morimatsu H, Sato A, Kusume S, Hidaka H, Yatsuzuka H, Okawa M, Takatori M, Saeki S, Samuta T, Tokioka H, Kurasako T, Maeda M, Takeuchi M, Hirasaki A, Kitaura M, Kajiki H, Kobayashi O, Katayama H, Nakatsuka H, Mizobuchi S, Sugimoto S, Yokoyama M, Kusudo K, Shiraishi K, Iwaki T, Komatsu T, Hirai Y, Sato T, Kimura M, Yasukawa T, Kimura M, Taniguchi M, Shimoda Y, Kobayashi Y, Tsukioki M, Manabe N, Ando E, Kosaka M, Tsukiji T, Tokura C, Asao Y, Sugiyama M, Seto K; Okayama Research Investigation Organizing Network (ORION) investigators. Current Ventilator and Oxygen Management during General Anesthesia: A Multicenter, Cross-pal Observational Study. Anesthesiology. 2018 Jul;129(1):67-76. doi: 10.1097/ALN.0000000000002181.


