【综述】含凝血酶原1型结构域的蛋白质1在颅内动脉瘤发生及破裂中的作用研究进展
时间:2025-01-29 12:09:14 热度:37.1℃ 作者:网络
摘要:颅内动脉瘤破裂是造成蛛网膜下腔出血的首要病因,具有高病死率、高致残率的特点。电子显微镜下,颅内动脉瘤内膜表面内皮细胞的连接处可见小孔和扩大的间隙。黏着斑是连接细胞外的复杂大分子复合物结构,其作用为维持脑血管的完整性,含凝血酶原1型结构域的蛋白质1(THSD1)和踝蛋白相互作用可将内皮细胞拴系至下层基底膜上,组装形成黏着斑并促进其成熟,以维持血管内膜完整。THSD1可通过细胞内吞途径及小干扰核糖核酸调节自身数量及功能,THSD1突变后其翻译蛋白THSD1功能异常,易于发生颅内动脉瘤。该文从THSD1基因的定位与功能、颅内动脉瘤发生的病理机制、THSD1与动脉瘤发生的关系及THDSI功能的调节等方面进行综述,以期为颅内动脉瘤的治疗提供新的思路和靶点。
含凝血酶原1型结构域的蛋白质1(thrombospondin type 1 domain containing protein 1,THSD1)基因编码的THSD1蛋白,不仅可调节新生的黏着斑组装,影响内皮细胞与细胞外基质的附着,还可与多种蛋白结合形成复合物,参与维持血管完整性的关键过程,在细胞生物学领域引起了广泛关注。然而,当该基因发生突变时,可能导致罕见的遗传病,引起免疫性胎儿水肿、胎内死亡或浆膜腔积液。体外研究显示,THSD1突变后食管上皮细胞THSD1表达下降,易于发生食管鳞状细胞癌。进一步的研究显示,THSD1表达与胃癌发生风险呈负相关,是抑制胃癌发生的保护性蛋白。研究表明,THSD1突变可能与颅内动脉瘤(intracranial aneurysms,IA)的发生有关;且有研究在斑马鱼和小鼠中进行THSD1基因敲除,结果显示,斑马鱼和小鼠的THSD1功能丧失可分别导致斑马鱼过早死亡和小鼠蛛网膜下腔出血。因此,对THSD1基因的研究有助于深入了解IA发病机制,对进一步提出预防和治疗IA策略具有重要意义。作者从THSD1基因的定位与功能、IA发生的病理机制、THSD1与IA发生的关系及THSD1功能的调节等方面进行综述,以期为IA的治疗提供新的思路和靶点。
1 THSD1基因的定位与功能
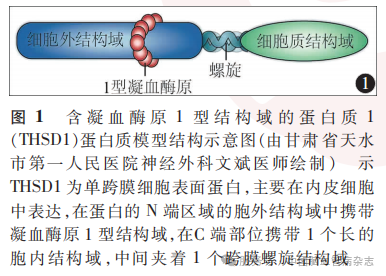
THSD1(OMIM616821;位置:13q14.3)编码的THSD1蛋白,参与补体途径和细胞外基质-蛋白黏附,在血管生成和血管完整性维护中发挥作用。THSD1是一种单跨膜蛋白,主要在内皮细胞中表达,其为一种细胞表面蛋白,在蛋白的N端区域的胞外结构域中携带凝血酶原1型结构域,在C端部位携带1个长的胞内结构域,中间夹着1个跨膜螺旋结构域(图1),在功能上与局灶黏附激酶(focal adhesion kinase,FAK)信号传导和细胞黏附相关。使用人脑原代脑微血管内皮细胞的相互免疫沉淀,验证了THSD1和踝蛋白有相互作用。蛋白质-蛋白质相互作用数据库中未检索到与THSD1相互作用的进一步候选者。
2 IA发生的病理机制
2.1 IA发生的微观结构基础
人类正常颅内动脉由内膜、中膜和外膜组成,内膜层较薄仅占血管壁总厚度的17%,中膜占52%,外膜占31%。内膜为血管壁最内层,与血流直接接触,由内皮细胞单层和内皮下细胞外基质组成;内弹力层是将内膜与内膜下分开的内皮下结缔组织,糖蛋白、蛋白多糖和弹性蛋白可以沉积到内弹力层的细胞外基质中,颅内动脉中不存在将动脉内膜与外膜分开的外弹力层,使颅内动脉更容易受到血流动力学影响。与相同直径的颅外动脉相比,颅内动脉的中膜较薄,中膜平滑肌细胞以环绕管腔的方式排列组成肌性环,平滑肌细胞间存在不连续裂隙,但是血管分叉处无平滑肌环状结构。“中缝”是动脉分叉处2个平滑肌层之间的生理连接处,其中主要含有提供力量和稳定性的肌腱样胶原蛋白,中缝处连接薄弱是动脉瘤发生的结构基础之一。外膜是血管壁最外层,是由Ⅰ型胶原纤维、弹性蛋白、神经和成纤维细胞组成的复杂网络。研究显示,95%以上的IA发生在颅内Willis环的分叉处及附近血管,血管分叉处血流具有高剪应力的特点,因此血流冲击可能导致IA形成。Meng等在6只雌犬的颈总动脉上创建了带有新分叉点的颈动脉分叉模型,结果显示,分叉处冲击点附近的血流加速,形成了一个复杂的血流动力学环境,即高壁面剪应力和正剪应力梯度。与血管内壁分叉尖端血流冲击区的修复性重塑反应不同,分叉尖端血流冲击区附近的血流加速的重塑包括破坏性事件,如出现浅“沟”、内弹力层破坏、血管壁向外扩张,提示IA并非起源于血管内分叉处尖端,而是起源于分叉近端区域。
2.2 IA发生的微观病理机制
Meng等通过构建雌犬的颈总动脉分叉动脉瘤模型显示,建模后2个月时动脉血管分叉旁血流加速区域的血管壁上出现一条浅“沟”,中膜和内膜的整体厚度减小,中膜平滑肌细胞减少;仔细观察浅“沟”可发现其内弹力层缺失,上覆内皮细胞缺失,基质胶原凸出于血管腔内;在内膜未消失区域,内膜细胞层状叠加,考虑与内膜破坏后修复有关;免疫染色显示,纤连蛋白在分叉冲击区的表达与未受干扰的动脉壁相似,而分叉旁血流加速区纤连蛋白减少。光镜下IA顶端内弹力层消失,采用电镜对人类IA颈部观察显示,其内弹力层发生破裂、碎片化或消失,提示内弹力层破坏是IA的病理学标志,其特征还包括管腔表面不规则、平滑肌内膜增生、细胞凋亡和炎症细胞浸润。当内弹力层解体时,培养基中的平滑肌细胞可以迁移至内膜层并增殖,导致肌内膜增生,多项研究在人类IA样本中观察到这种平滑肌细胞迁移现象,表现为内膜增厚,可能为动脉瘤发生内膜破坏后代偿性修复反应。
3 THSD1与IA发生的关系
3.1 黏着斑与脑血管内皮细胞的完整性
在多数IA患者(34/36,94%)中,IA内膜或内膜下可检测到红细胞,这种现象可能是由IA内膜结构完整性被破坏引起,内膜结构完整包括黏连、紧密连接和间隙连接稳定。黏着斑是连接细胞外的复杂大分子复合物结构,可以维持脑血管的完整性。整合素是参与黏着斑的主要蛋白质,以双向方式传递信号,当纤维连接蛋白等细胞外基质蛋白与其受体整合素结合时,外入信号可通过整合素非常规传递,并最终导致整合素构象变化及激活。黏着斑在新生黏连形成过程中呈现由不成熟状态转变为成熟状态的动态结构,在细胞的腹侧和外周区域,细胞外基质-THSD1-整合素相互作用形成圆形成熟的黏连,具有特征性的扁平拉长结构(厚约50nm,宽300~500nm,长1000 ~ 5000nm)。整合素活化是黏着斑形成的第一步,整合素有三种不同的构象:弯曲封闭型、扩展封闭型和扩展开放型。细胞外基质配体首先与位于整合素α和β头部结构域之间裂隙处的整合素跨膜受体结合,从而使整合素聚集、构象变化并直接激活整合素;整合素活化后,黏着斑依次招募三层蛋白。第一层为结构层,包含踝蛋白、整合素相互作用蛋白、纽蛋白、整合素连接激酶;第二层为信号层,包含FAK、酪氨酸蛋白激酶和桩蛋白;第三层为肌动蛋白交联层,包含α肌动蛋白、血管扩张刺激磷蛋白、细丝蛋白和细胞骨架相关蛋白。整合素激活后发生构象变化,细胞内连接蛋白如踝蛋白和整合素相互作用蛋白进一步连接到肌动蛋白细胞骨架,并将化学和机械信号转导至细胞中。研究表明,整合素αv和β8失活可导致斑马鱼颅内出血,Liu等设计了整合素αv ATG吗啉来阻断整合素αv翻译,每只注射1ng/μl的整合素αv ATG吗啉可导致17.7%(113只)的斑马鱼胚胎在受精后36h发生颅内血管出血,使用4ng/μl的itgb8e2i2吗啉敲除整合素β8基因会导致25.6%(472只)斑马鱼胚胎在受精后36h发生颅内血管出血。
踝蛋白作为一种主要的整合素激活剂,对整合素由内而外的激活至关重要,因此被称为黏着斑的核心蛋白。踝蛋白可将与细胞外基质结合的整合素与肌动蛋白连接起来,其与THSD1相互结合可将内皮细胞拴系至下层基底膜上。踝蛋白的缺失也会引起斑马鱼胚胎的颅内血管出血,Wu等以表型踝蛋白1 fl02k系斑马鱼(5377例)为实验品系,设计了一种针对斑马鱼踝蛋白159-UTR基因的反义吗啉基,其可导致踝蛋白基因突变,用心肌细胞特异性表达肌球蛋白轻链启动子调控绿色荧光蛋白,标记心内膜细胞和心肌细胞来检测踝蛋白缺失对于斑马鱼胚胎期心脏的影响,称为tln1MO系,结果显示,与非tln1MO系斑马鱼胚胎心脏相比较,受精后36h,荧光显微镜下观察到tln1MO系10例斑马鱼胚胎心内膜与各自的基底膜相连,但这些内膜细胞层之间的距离增加,受精52h后tln1MO系斑马鱼胚胎心内膜破裂,血细胞渗入中膜,电镜下可以看到F肌动蛋白网络稀疏,说明踝蛋白在保持斑马鱼胚胎血管内膜细胞之间的黏附完整性及细胞间距离中发挥作用,参与维持斑马鱼胚胎血管内膜完整。
FAK是一种主激酶,由整合素介导的细胞黏附激活,通过其N端与血管内皮生长因子受体相互作用,血管内皮生长因子激活血管内皮生长因子受体诱导FAK磷酸化,促进血管生成。研究表明,小鼠血管内皮细胞中FAK失活会导致脑出血,Tie2Cre系条件性FAK敲除小鼠胚胎存活率(胚胎形成至出生时的存活率)为3%(5/161),在FAK敲除后中位数第13.5天时可以观察到小鼠胚胎内多发出血灶。综上,黏着斑的组装和稳定需要FAK、踝蛋白、纽蛋白以及整合素相互连接激活,形成稳定型黏着斑后,其内含的整合素与细胞外基质的整合素受体结合,从而实现细胞间稳定黏附。
与Sry相关的高迁移率基团框17(sry-related high-mobility group box 17, SOX17)可作为转录因子调节大量下游靶标,包括血管内皮钙黏蛋白,血管内皮钙黏蛋白在细胞-细胞界面呈线性排列。电子扫描显微镜下观察到,敲除SOX17基因后的16周龄小鼠,其颅内动脉内皮细胞连接受到破坏,内皮细胞交界处的血管内皮钙黏蛋白染色较对照组(未敲除SOX17基因)减少且连接断开;敲除SOX17基因会加重人类颅内微血管内皮细胞因血管紧张素诱导的细胞凋亡和自噬。与对照组相比,SOX17基因缺陷小鼠动脉的血管平滑肌细胞覆盖率较低,通过置入背侧皮下部位的渗透微型泵,以1.44mg/(kg·min)的速度注入血管紧张素Ⅱ,持续4周诱导升高血压后小鼠的头部MR血管成像(MRA)可观察到IA形成。SOX17调节的血管内皮钙黏蛋白可能是独立于黏着斑之外的细胞间黏附方式;细胞间黏附功能受损后,在实验动物中能够观察到血管自发出血及发生IA。
3.2 THSD1参与黏着斑的组装
THSD1是一种新发现的参与黏着斑组装的蛋白,既往研究已经鉴定出多种蛋白质(如FAK、踝蛋白、整合素、纽蛋白)参与成熟黏着斑形成,但其形成新生黏附的程度尚不清楚,尤其是在表达THSD1的内皮细胞中。单跨膜蛋白THSD1定位于新生黏连和细胞膜内,在人脐静脉内皮细胞中采用靶向小干扰核糖核酸(small interfering ribonucleic acid, siRNA)抑制THSD1表达,采用抗THSD1蛋白C末端特异性抗体、抗桩蛋白、抗磷酸化FAK和抗纽蛋白抗体对人脐静脉内皮细胞进行免疫荧光染色,结果显示,在THSD1siRNA处理的细胞中观察到细胞平均面积小于对照组(4000μm2比6000μm2,P<0.01),用抗桩蛋白免疫染色观察到THSD1 siRNA处理的细胞黏着斑数量少于对照组(平均值:50个/细胞比110个/细胞,P<0.01),采用抗磷酸化FAK免疫染色观察发现,THSD1 siRNA处理的细胞黏着斑数量少于对照组(平均值:40个/细胞比100个/细胞,P<0.01),采用抗纽蛋白抗体免疫染色观察,THSD1 siRNA处理的细胞黏着斑数量少于对照组(平均值:60个/细胞比120个/细胞,P<0.01)。在人脐静脉内皮细胞中敲除THSD1,与使用假病毒对照组相比,血管内皮钙黏蛋白与肌动蛋白细胞骨架的共定位减少约50%(P<0.05)。上述研究提示,THSD1蛋白缺失后人脐静脉内皮细胞平均面积减少,黏着斑数量降低,血管内皮钙黏蛋白与肌动蛋白细胞骨架的共定位减少,说明THSD1可能既参与了黏着斑机制的细胞黏附,也参与了血管内皮钙黏蛋白机制的细胞间黏附。
Rui等采用人胚胎肾细胞293T细胞并洗脱THSD1、踝蛋白后进行2轮免疫共沉淀实验,观察到THSD1可促进黏着斑处FAK-踝蛋白相互黏连并增加成熟黏着斑的数量,野生型THSD1黏着斑阳性数平均值达到70个/细胞,而空白对照及突变型THSD1(R460W、G00E、P639L、T653I、S775P)黏着斑阳性数平均值均小于60个/细胞;设定空白对照细胞间连接率为100%,野生型THSD1的细胞间连接率可达到140%,突变型THSD1(R460W、G00E、P639L、T653I、S775P)细胞间连接率均小于120%,提示THSD1可增强细胞间连接。研究显示,THSD1定位于点状外观的新生黏着斑,而不是呈现条纹状结构的成熟黏着斑,这表明THSD1基因可调节黏着斑组装,且主要在黏着斑组装的早期阶段发挥作用。Santiago-Sim等在体外细胞培养人脐静脉内皮细胞,敲除THSD1后,与未敲除THSD1的人脐静脉内皮细胞相比,人脐静脉内皮细胞与纤维黏连蛋白、胶原Ⅳ或层黏蛋白的黏附力不变,但与胶原Ⅰ的黏附力降低,表明THSD1突变可扰乱内皮细胞的Ⅰ型胶原蛋白介导的局灶黏附、细胞黏附,可能会导致IA。在黏着斑生成的早期阶段,THSD1可促进黏着斑处FAK-踝蛋白相互黏连并增加成熟黏着斑的数量,THSD1基因缺失或突变后黏着斑数量及细胞间连接下降,黏着斑的主要作用是维持脑血管内膜的完整性。因此THSD1突变可能是导致IA发生的原因之一。THSD1参与IA发生发展的微观结构示意图见图2。

4 THSD1功能的调节
4.1 网格蛋白介导的内吞途径对THSD1的调节
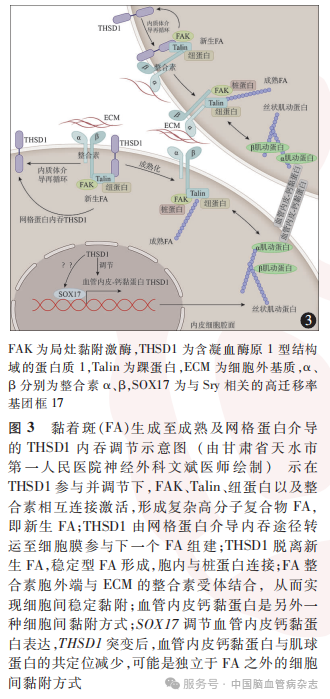
目前对黏着斑组装如何受到调节的研究较少,THSD1位于新生而非成熟的黏着斑,可同时定位于细胞质内不同阶段的内涵体;内涵体介导的THSD1的重新分布可能在黏着斑新生至成熟的歧化过程中发挥作用。Rui等观察表达THSD1-GFP的海拉细胞,成熟黏着斑平均数量约70个/细胞,用0.4mol/L高渗蔗糖处理表达THSD1-GFP的海拉细胞显示,成熟黏着斑平均数量减少(40个/细胞;P<0.05);设定空白对照细胞间连接率为100%,表达THSD1-GFP的海拉细胞的细胞间连接率达150%,400 mmol/L高渗蔗糖处理后细胞间连接率降低(120%;P<0.05),提示高渗蔗糖通过抑制内吞作用减少了THSD1诱导的黏着斑数量和细胞附着数量;观察表达THSD1-GFP的海拉细胞,成熟黏着斑平均数量为70个/细胞,用0.1 mmol/L的单丹酰尸胺处理表达THSD1-GFP的海拉细胞显示,成熟黏着斑平均数量降低(45个/细胞;P<0.05);设定空白对照细胞间连接率为100%,表达THSD1-GFP的海拉细胞细胞间连接率可达150%,单丹酰尸胺处理后细胞间连接率降低为120%(P<0.05),提示单丹酰尸胺可能通过抑制网格蛋白介导的内吞作用减少了THSD1诱导的黏着斑数量和细胞附着数量;用5μg/ml的菲律宾菌素处理表达THSD1-GFP的海拉细胞显示,成熟黏着斑平均值约为70个/细胞;细胞间连接率设定空白对照为100%,表达THSD1-GFP的海拉细胞细胞间连接率可达150%,菲律宾菌素处理后细胞细胞间连接率为150%,表达与THSD1-GFP组比较差异无统计学意义(P>0.05),提示微囊介导的内吞途径对THSD1再分布调控可能无影响。黏着斑生成至成熟及网格蛋白介导的THSD1内吞调节示意图见图3。内吞途径也可负向调节新生黏着斑,内吞作用的另一个途径为将目标蛋白送至溶酶体降解,细胞内可溶性整合素可被泛素化,并被转导至溶酶体降解。Rui等检测到了THSD1与溶酶体标志物溶酶体关联膜蛋白1的强共定位,THSD1是在溶酶体膜上作为传导信息的分子存在还是被吞进溶酶体进一步降解,机制尚不明确。Xu等认为,各种应激条件(如饥饿)都会诱导自噬,在自噬过程中,胞吞小体(双膜细胞器)可吞噬内含物并将其转化为脂肪,自噬有助于黏着斑的降解。黏着斑如何被内吞并进一步降解,尚未见研究报道,需要进一步研究。上述THSD1网格蛋白内吞调节途径的研究结果提示,THSD1及相关蛋白调节黏着斑稳定,稳定的黏着斑有助于血管内膜内弹力层稳定,THSD1相关配体及调节蛋白可能是预防IA发生的靶点。
4.2 调节THSD1的其他方式
用靶向siRNA(HSS148179)转染人脐静脉内皮细胞抑制THSD1表达后,与对照组相比,细胞面积平均值减小(4000 um2比6000 um2,P<0.01);抗桩蛋白抗体染色后观察黏着斑数量显示,抑制THSD1组内皮细胞黏着斑平均个数少于对照组(50个/细胞比110个/细胞,P<0.01),与野生型THSD1基因转染纠正人脐静脉内皮细胞THSD1表达组黏着斑平均个数相近(P>0.05);抗磷酸化FAK染色后观察黏着斑数量,结果显示,抑制THSD1表达组的内皮细胞黏着斑平均个数少于对照组(40个/细胞比95个/细胞,P<0.01),而野生型THSD1基因转染纠正后内皮细胞THSD1表达组黏着斑平均个数为105个/细胞;抗纽蛋白抗体染色后观察黏着斑数量显示,抑制THSD1组内皮细胞黏着斑平均个数为40个/细胞,对照组为115个/细胞,而野生型THSD1基因转染纠正人脐静脉内皮细胞THSD1表达组黏着斑平均个数为125个/细胞,组间比较差异均有统计学意义(均P<0.01);在靶向siRNA处理的人脐静脉内皮细胞中观察到细胞面积变小,形状改变和黏着斑数量减少,说明THSD1突变与黏着斑形成和细胞附着能力受损可能有关。Chistiakov等研究显示,微小核糖核酸(micro ribonucleic acid,miRNA)通过调节血管内皮细胞的功能,如增殖、迁移、凋亡和细胞外基质蛋白的合成及分泌,在血管疾病中发挥着关键作用。该研究通过结扎兔子双侧颈内动脉构建的基底动脉血流增加模型中发现,基底动脉直段内膜有31个RNA表达有差异(19个增加,12个减少),在基底动脉分叉处内膜有180个RNA表达有差异(54个增加,126个减少)。Jin等通过基因芯片技术分析血清中miRNA,结果显示,86个miRNA的表达在脑血管造影未见IA患者(6例)和脑血管造影发现IA患者(18例)之间存在明显差异,在设定差异表达的miRNA筛选条件为组间差异的绝对值≥2,P<0.05时,与脑血管造影未见IA者(6例)相比,IA存在子囊组患者(6例)有68个miRNA上调,无下调。IA无子囊组(6例)有4个miRNA上调,9个miRNA下调;IA破裂伴蛛网膜下腔出血组(6例)有2个miRNA上调,13个miRNA下调,提示miRNA可能参与了IA基本生理和病理过程的调控,并可能是IA破裂的警示信号。是否存在调节THSD1稳定性和功能的小非编码RNA需要进一步研究。
5 THSD1与人类IA
有研究对38例非芬兰裔欧洲西北人群IA患者进行外显子组测序,结果显示,有6例患者存在THSD1变异,Santiago-Sim等对一欧美家庭的35位成员使用全基因组全外显子组测序分析,结果显示,9例患有IA家庭成员(3例罹患破裂IA伴蛛网膜下腔出血,6例为未破裂的IA)的THSD1中均有一个无义突变:R450X,定位于染色体的13q14.3位置,而13名未患IA家庭成员未检测到该突变。一项研究纳入的507例无亲属关系的IA患者中,有8例IA患者(包括5例未破IA和3例破裂IA伴蛛网膜下腔出血患者)通过靶向THSD1测序发现了突变,其中2例患者突变位于编码THSD1信号肽部分的基因序列中(L5F),6例聚集在编码THSD1细胞内区域部分的基因序列中(R460W、E466G、G600E、P639L、T653I和S775P各发现1例),相对于外显子组整合数据库(the exome aggregation consortium, ExAC)中89040条染色体,这些THSD1突变和(或)罕见变异在纳入研究的IA患者中出现频率较高(P<0.01),提示IA可能是THSD1常染色体显性遗传疾病。
综上所述,作者探讨了THSD1基因的定位及其翻译后THSD1蛋白的功能,其可促进黏着斑生成及成熟,踝蛋白和THSD1相互作用可将内皮细胞拴系至下层基底膜,维持血管内皮完整。此外,THSD1突变后其翻译蛋白THSD1功能异常,易于发生IA,为IA的治疗提供了新的思路与方向,THSD1调节途径及其配体可能是一个新的治疗IA的靶点。然而,目前对于THSD1基因的研究尚处于初始阶段,仍存在许多未知领域需要进一步探索,如THSD1是否也是SOX17的下游靶蛋白。未来可对THSD1的功能与调控机制深入研究,以期为相关疾病的预防与治疗提供更为有效的策略与方法。


