综述|缺血性卒中再灌注治疗后癫痫的研究进展
时间:2025-01-19 12:14:08 热度:37.1℃ 作者:网络
摘 要 目前国际上尚无关于缺血性卒中患者再灌注治疗后癫痫诊断和治疗的统一指南与共识,本文从定义、机制等方面对其进行综述。缺血性卒中再灌注治疗后癫痫定义为接受了静脉溶栓和(或)机械取栓等血管内治疗的脑梗死患者,无其他明确原因或卒中前癫痫病史,脑梗死7 d后出现2次或以上痫性发作,或脑梗死30 d后出现1次或以上痫性发作。静脉溶栓后癫痫的发病率约为6.4%~20.6%,动脉机械取栓后癫痫的发病率约为5%。再灌注治疗卒中后癫痫的病理生理学机制可能与局部高灌注、溶栓药物本身致痫性及出血转化相关。较高的卒中严重程度、大脑皮质病灶、大脑中动脉供血区梗死及卒中后早发性发作可能是再灌注治疗卒中后癫痫的预测因素。左乙拉西坦及拉莫三嗪可能是缺血性卒中再灌注治疗后癫痫的有效药物,溶栓后持续痫性发作可能增加患者的死亡风险。
关键词 缺血性卒中;再灌注;急性症状性痫性发作;癫痫;静脉溶栓;机械取栓
脑卒中是中老年人群中的高发生率、高致残率和高致死率疾病,超急性期再灌注治疗缺血性卒中是目前唯一明确有效的治疗方案,2023年美国神经病学会推荐结合颅脑核磁及CT灌注成像辅助判断不同患者的缺血半暗带情况及卒中进程,进行合理的静脉溶栓超时间窗治疗[1]。随着卒中中心建立、绿通优化、影像可及,越来越多患者在脑梗死超急性期获得再灌注治疗,及时逆转了缺血半暗带的病理变化,保留神经功能。卒中后的再灌注治疗逆转了脑梗死的病理生理改变,所导致的癫痫形成机制不同于未经干预的缺血性卒中后癫痫的形成,该方向的探索很可能为癫痫形成机制研究提供新的角度。国内外神经病学专家越来越关注再灌注治疗卒中后癫痫,本文将从再灌注治疗卒中后癫痫的定义、流行病学特征、机制、危险因素和预测模型、治疗、预后等方面对相关进展进行综述。
1 概述
再灌注治疗卒中后癫痫目前尚无明确定义,在此首先阐述卒中后早发性发作、迟发性发作和卒中后癫痫3个概念。
2010年国际抗癫痫联盟(International League Against Epilepsy, ILAE)提出关于急性症状性痫性发作(acute symptomatic seizure)的定义,也明确提出:卒中后7 d内的急性损伤后结构或代谢变化导致的1次或以上的痫性发作应归类于急性症状性痫性发作,即早发性发作(early seizure, ES),因为该时间段的痫性发作并不代表神经网络的改变[2]。卒中后迟发性发作(late seizure, LS)定义为卒中后7 d后的痫性发作。依据2014年ILAE癫痫的临床实用性定义,卒中7 d后出现两次或以上痫性发作,或卒中30 d后出现1次或以上的无诱因痫性发作,再次出现痫性发作的风险高于60%,可诊断为卒中后癫痫(post stroke epilepsy, PSE)[3]。
再灌注治疗卒中后癫痫的定义,理论上应套用以上概念,定义为:接受了静脉溶栓和/或机械取栓等血管内治疗的卒中患者,无其他明确原因或卒中前癫痫病史,卒中7 d后出现2次或以上痫性发作,或卒中30 d后出现1次或以上痫性发作[4]。
因再灌注治疗卒中后癫痫的定义尚未统一,目前已经报道的不同研究所纳入的卒中类型、随访时间、早发及迟发性发作的界定时间等不同,发病率也不尽相同。静脉溶栓后癫痫的发病率为6.4%~20.6%[4-9],略低于卒中癫痫的发病率(2%~20%)[9-13]。动脉机械取栓后癫痫的发病率约为5%[7],再灌注治疗后出现ES的发病率为1.5%~13.9%[4-5,7-8,14-28],LS发病率为1.5%~16.7%[4-5,8,14-18,21]。详见表1。
表1 再灌注治疗卒中后癫痫的文献及发病率Tab.1 Summary of studies reporting the incidence of post-stroke seizures after reperfusion therapies

注:所有数据均为值(百分比),除非有指定数据。1)该篇文章定义PSE为急性卒中后至少2周发生痫性发作;2)该文章中纳入的群体为由于大血管闭塞而导致缺血性卒中的连续成人,均进行血管造影术以选择进行机械血栓切除术,在血管造影上完全再通或技术上无法执行MT的患者不被排除在外。#包括单独静脉溶栓、单独动脉溶栓、静脉溶栓桥接动脉溶栓的患者。
续表1
在再灌注治疗后发生痫性发作的患者中,痫性事件至卒中时间的中位时间约为2 d[19],平均2.6 d[22]。超过3/4的痫性发作发生在3 d内[19],其中静脉溶栓、动脉溶栓或静脉溶栓桥接动脉溶栓治疗后出现的痫性发作约有一半在卒中后1 d内[15-16,21]。2019年的一项多中心前瞻性研究发现,在10074例接受静脉溶栓的患者中约1.5%在溶栓药物输注结束前出现痫性发作[29]。
2 缺血性卒中后再灌注后癫痫的形成机制
进行再灌注治疗后,血管壁缺血坏死、缺血半暗带灌注增加、核心梗死区域范围缩小,不同于经典卒中后的病理生理改变,令癫痫的形成机制更加复杂,但相关研究尚不多。卒中后早发性发作被认为与超急性期灌注异常、血脑屏障破坏、离子通道功能障碍等机制相关,迟发性发作可能与致痫灶的形成、慢性炎症、卒中共病等因素相关[30]。目前大部分卒中后癫痫的实验数据通过机械性大脑中动脉闭塞(mechanical middle cerebral artery occlusion, MCAO)和光血栓这两个模型获得[13]。
2.1 血管再通引起部分区域高灌注 微血管钳短暂闭塞猫的大脑中动脉1 h,建立了急性大脑中动脉闭塞后再灌注损伤的动物模型,即MCAO模型。该模型的FLAIR、弥散加权和灌注加权成像可观察到长达48 h的高灌注(包括某些未梗死的区域),引起迟发性细胞灌注损伤[31]。其他疾病状态引起的脑实质高灌注,也可引起急性症状性痫性发作,如高血压脑病[32]和颈动脉内膜切除术后[33]。再灌注治疗后出现急性症状性痫性发作,提示闭塞的颅内动脉再通相应区域皮质灌注有效改善,预后良好[34]。
2.2 组织型纤溶酶原激活剂(tissue plasminogen activator, tPA)的致痫性 临床研究发现急性心梗、无脑卒中的患者在输注tPA联合尿激酶后出现痫性发作,提示tPA本身可能可诱发痫性发作[35]。实验室研究也提示tPA本身的致痫性:
①痫性发作过程tPA含量升高。丝氨酸蛋白酶tPA是大鼠海马神经元活动诱导中受外界刺激后可迅速且短暂激活的基因之一,在痫性发作后1~4 h内可观察到整个大脑中的tPA mRNA水平显著升高[36]。痫性发作早期,在海马注射红藻氨酸的癫痫小鼠模型脑区观察到了丝氨酸蛋白酶抑制剂抗原和tPA抗原水平的增加[37]。
②tPA缺乏时痫性发作减少。注射丝氨酸蛋白酶抑制剂及敲除tPA基因,红藻氨酸诱导的癫痫小鼠模型的癫痫活动显著减少;敲除tPA基因的癫痫小鼠模型,红藻氨酸诱导癫痫活动也显著减少[37]。通过注射不同浓度的米特腊唑诱发癫痫,tPA缺陷小鼠的癫痫发生率显著低于野生型小鼠[38]。
③tPA过表达时痫性发作阈值降低。神经元中选择性过度表达tPA小鼠植入颅内电极,构建电点燃模型,电诱发癫痫的阈值更低,更容易发生癫痫[5]。
④tPA的毒性及神经损伤作用。tPA还具有直接的兴奋神经毒性,且能通过γ-氨基丁酸介导中间抑制神经元的丢失[39]。
2.3 出血转化增加痫性发作的风险 出血转化是再灌注治疗的常见并发症之一,静脉溶栓后出血转化率达6.45%~31.77%,血管内治疗7.60%~49.55%[40]。出血转化增加ES和LS的风险[26]。接受急性血管内治疗的卒中患者中出血转化者的2年内痫性发作风险为未出血者的5倍[41],血管内干预治疗有增加出血转化的趋势[42]。接受任何动脉内治疗的患者比接受任何静脉溶栓的患者更有可能出现痫性发作,考虑到静脉溶栓的药物本身致痫性的可能,提示出血转化可能与缺血性卒中再灌注治疗后癫痫密切相关[18]。既往研究发现出血本身易诱发痫性发作,相关机制除上文提到的卒中后癫痫的共同机制外,还包括机械压迫、血代谢物的皮质刺激等[43]。
3 再灌注治疗后痫性发作的临床特征
3.1 临床特点 卒中若干临床因素可能与缺血性卒中后出现癫痫相关,国际上曾提出SeLECT评分来预测迟发性发作及卒中后癫痫[44-45],其字母分别代表严重程度、是否为大动脉粥样硬化型脑梗死、是否出现ES、是否有皮质受累、是否为大脑中动脉供血区,缺血性卒中再灌注治疗后癫痫也发现了类似的危险因素[9,16,19,26,29]。有研究发现溶栓后有无痫性发作患者的代表严重程度的美国国立卫生研究院卒中量表(National Institutes of Health stroke scale, NIHSS)评分无统计学差异[15],可能是由于该研究仅纳入进行溶栓治疗的患者。也有研究发现大脑皮质受累不会增加机械取栓后ES风险,可能的原因是大多数接受机械取栓的患者都有皮质受累[22]。在溶栓患者中痫性发作者的房颤病史比未发作更常见,但该研究未在结果中提及具体的卒中分型[15]。更年轻的年龄[4,16]还是高龄[26]会增加ES及PSE的风险,目前尚有争议。动脉溶栓、机械取栓结束后血管成功再通的时间都与ES、PSE的风险相关[7,23]。建议接诊后立即评估急性缺血性卒中的介入指征,同时对患者的内部环境快速综合管理[4]。
3.2 痫性发作类型 溶栓患者与未溶栓患者的卒中后痫性发作类型相似[46],详见表2。静脉溶栓治疗后,6.25%患者出现2种以上的发作[4]。在一项病例对照研究的28例卒中后痫性发作患者中,有5例患者表现为癫痫持续状态,其中静脉溶栓后癫痫持续状态的出现比例高达25%(即3/12)[46]。在临床工作中,由于卒中患者缺乏神经电生理评估,卒中后痫性发作的频率可能被低估[47]。2022年的一项研究发现,在神经重症监护室的80例意识障碍的脑梗死患者中,38.75%(即31/80)出现非惊厥性癫痫持续状态[48]。同年的另一项研究发现,在急性卒中7 d内进行长程脑电监测且病程中进行正规抗痫性发作药物治疗的患者中,22.8%(即11/39)的患者被记录到出现临床下发作[49]。一项前瞻性研究发现,在住院期间有3.0%(即3/101)的静脉溶栓后痫性发作患者出现非惊厥性癫痫持续状态,有5.9%(即6/101)的静脉溶栓后痫性发作患者有临床下发作[21],但该研究未能对所有入组患者进行脑电监测。因此,建议对急性卒中患者,尤其是出现意识改变的患者早期进行长程脑电监测以提高癫痫的诊出率。
表2 不同再灌注方式的痫性发作类型分布Tab.2 Composition of patients with poststroke seizures after different reperfusion therapies
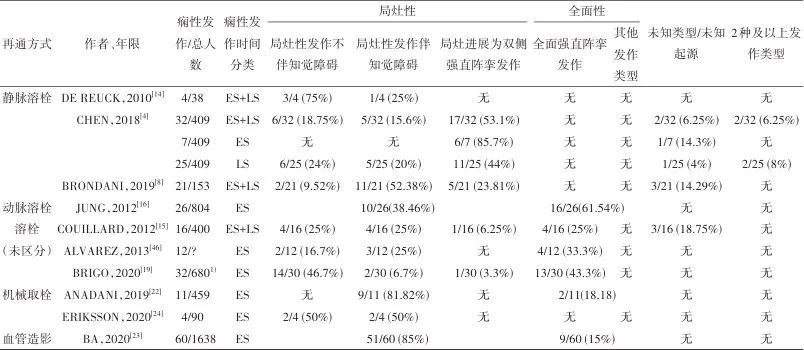
注:1)其中2人未取得可用数据,故该文中可获得痫性发作类型的人数为30人。
3.3 脑电图 近期几项研究发现的卒中后癫痫的脑电图最常见的异常(约40%)有散发性放电和全面性节律性δ活动[50],卒中后癫痫的独立预测因子包括首次脑电图的背景活动不对称及发作间期癫痫样活动[51]及卒中后7 d内发现的癫痫样异常[52]。而2021年的一项多中心研究对临床变量和卒中位置进行校正后认为,卒中发病7 d内的脑电图异常结果可能无法预测再灌注治疗卒中后癫痫[7]。急性期脑电图异常可能与卒中前2 d较差的神经系统状况相关,急性期健康大脑半球脑电图无异常可能预测卒中后90 d的良好功能预后[50]。
3.4 影像学 在卒中后癫痫的临床诊疗及随访中,推荐完善颅脑CT灌注成像[53],通过阿尔伯塔脑卒中计划早期诊断评分(Alberta stroke program early CT, ASPECT)协助评估脑缺血程度及皮质受累情况[54-55],低ASPECT评分与机械取栓后早发性发作独立相关[22]。由于再灌注治疗后发生出血转化的患者与痫性发作的风险升高密切相关,推测出血转化可能作为再灌注治疗后痫性发作的影像学生物标志物[41]。急性卒中后24 h在CT上未发现脑梗死的情况时,PSE的风险降低[9]。
3.5 血液生物标志物 2019年的一项研究发现,机械取栓后癫痫的患者在病程中出现血液中微管相关蛋白Tau(microtubule-associated protein Tau)、神经丝轻链(neurofilament light chain, NFL)、胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)、S100钙结合蛋白(recombinant S100 calcium binding protein B, S100B)、神经元特异性烯醇化酶(neuron-specific enolase, NSE)升高,经ROC曲线分析后均表现出良好的特异性及灵敏性,其中Tau蛋白在48 h出现明显增多,而3个月内NFL、GFAP、S100B及NSE增多可能均与PSE风险增加相关[24],这些生物标志物的预测价值需要更多的临床研究验证。
3.6 再灌注治疗对卒中后痫性发作及癫痫的影响 有研究认为是否再灌注治疗后ES发生率没有明显差异[19-20]。2021年一项配对病例对照研究发现,接受再灌注治疗的患者ES的发生率明显较低,但当排除卒中后、再灌注治疗前发生的痫性发作后,两组患者ES率无显著差异[27]。目前也未发现再灌注治疗与脑电图改变的明确关系[50]。不同再灌注治疗对于卒中后痫性发作及癫痫的影响均有争议,详见表3,仍需要更多的高质量前瞻性研究来探究其相关性。
表3 再灌注治疗与癫痫及痫性发作的相关性Tab.3 Association of different reperfusion therapies with post-stroke seizure and epilepsy
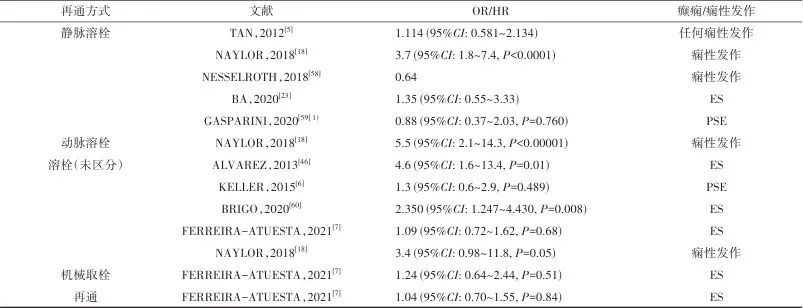
注:1)该研究为meta分析,共纳入4项研究。
4 治疗与预后
目前尚无再灌注治疗卒中后癫痫的治疗方面的临床研究。溶栓后使用ASMs的患者较抗板及抗凝治疗的患者少[14]。在2012年的一个溶栓队列中,约75%的患者使用苯妥英钠,12.5%使用苯二氮䓬类药物[15]。而2019年及2020年的两项机械取栓相关研究中,大部分患者使用左乙拉西坦及拉莫三嗪治疗早发性发作[22,26]。需要注意,持续ASMs与癫痫患者动脉粥样硬化的加速[56]及颈总动脉内膜中膜增厚显著相关,目前发现单药ASMs使用在5年内有潜在的新发卒中风险。如何平衡ASMs的抗癫痫治疗效果及卒中风险的不良反应目前仍是个问题。
在静脉溶栓后出现痫性发作及癫痫的患者自理能力较差[5,46],痫性发作能独立预测溶栓患者短期及长期不良预后[8,17,22],但在消除混杂因素后,静脉溶栓后痫性发作并不提示较差的功能结局[21,29]。再灌注治疗后的痫性发作及癫痫并不增加死亡风险[5,26,29],但2019年的一项研究认为机械取栓后ES与90 d的死亡率相关[22],如溶栓后出现持续痫性发作则住院期间死亡风险更高[15]。
5 结论
经血管内治疗、血管复通后的癫痫及痫性发作不同于未经干预的卒中后癫痫。静脉溶栓后癫痫与已有报道的卒中后癫痫发病率基本相当,动脉溶栓后癫痫则相对较少。目前的研究暂不能得出再灌注治疗与卒中后癫痫相关的结论,但NIHSS评分高及大动脉粥样硬化型脑梗死仍是卒中后癫痫的危险因素。目前的研究未明确脑电图在卒中后癫痫中的实际预测作用,也未得出抗癫痫药物的最优选择。在未来的临床工作中,建议对内环境进行及时管理以预防癫痫。血管内治疗后的卒中后癫痫是一个值得关注的切入点,需要更多高质量的研究。
参考文献:
1. GROTTA J C. Intravenous thrombolysis for acute ischemic stroke[J]. Continuum (Minneap Minn), 2023, 29(2): 425-442.
2. BEGHI E, CARPIO A, FORSGREN L, et al. Recommendation for a definition of acute symptomatic seizure[J]. Epilepsia, 2010, 51(4): 671-675.
3. FISHER R S, ACEVEDO C, ARZIMANOGLOU A, et al. ILAE official report: A practical clinical definition of epilepsy[J]. Epilepsia, 2014, 55(4): 475-482.
4. CHEN Z, CHURILOV L, CHEN Z, et al. Association between implementation of a code stroke system and poststroke epilepsy[J]. Neurology, 2018, 90(13): e1126-e1133.
5. TAN M L, NG A, PANDHER P S, et al. Tissue plasminogen activator does not alter development of acquired epilepsy[J]. Epilepsia, 2012, 53(11): 1998-2004.
6. KELLER L, HOBOHM C, ZEYNALOVA S, et al. Does treatment with t-PA increase the risk of developing epilepsy after stroke?[J]. J Neurol, 2015, 262(10): 2364-2372.
7. FERREIRA-ATUESTA C, DOHLER N, ERDELYI-CANAVESE B, et al. Seizures after ischemic stroke: A matched multicenter study[J]. Ann Neurol, 2021, 90(5): 808-820.
8. BRONDANI R, DE ALMEIDA A G, CHERUBINI P A, et al. Risk factors for epilepsy after thrombolysis for ischemic stroke: A cohort study[J]. Front Neurol, 2019, 10: 1256.
9. ERIKSSON H, NORDANSTIG A, RENTZOS A, et al. Risk of poststroke epilepsy after reperfusion therapies: A national cohort study[J]. Eur J Neurol, 2023, 30(5): 1303-1311.
10. BURNEO J G, FANG J, SAPOSNIK G, et al. Impact of seizures on morbidity and mortality after stroke: A Canadian multi-centre cohort study[J]. Eur J Neurol, 2010, 17(1): 52-58.
11. HUANG C W, SAPOSNIK G, FANG J, et al. Influence of seizures on stroke outcomes: A large multicenter study[J]. Neurology, 2014, 82(9): 768-776.
12. GRAHAM N S, CRICHTON S, KOUTROUMANIDIS M, et al. Incidence and associations of poststroke epilepsy: The prospective south London stroke register[J]. Stroke, 2013, 44(3): 605-611.
13. FERLAZZO E, GASPARINI S, BEGHI E, et al. Epilepsy in cerebrovascular diseases: Review of experimental and clinical data with meta-analysis of risk factors[J]. Epilepsia, 2016, 57(8): 1205-1214.
14. DE REUCK J, VAN MAELE G. Acute ischemic stroke treatment and the occurrence of seizures[J]. Clin Neurol Neurosurg, 2010, 112(4): 328-331.
15. COUILLARD P, ALMEKHLAFI M A, IRVINE A, et al. Subacute seizure incidence in thrombolysis-treated ischemic stroke patients[J]. Neurocrit Care, 2012, 16(2): 241-245.
16. JUNG S, SCHINDLER K, FINDLING O, et al. Adverse effect of early epileptic seizures in patients receiving endovascular therapy for acute stroke[J]. Stroke, 2012, 43(6): 1584-1590.
17. GENSICKE H, SEIFFGE D J, POLASEK A E, et al. Long-term outcome in stroke patients treated with IV thrombolysis[J]. Neurology, 2013, 80(10): 919-925.
18. NAYLOR J, THEVATHASAN A, CHURILOV L, et al. Association between different acute stroke therapies and development of post stroke seizures[J]. BMC Neurol, 2018, 18(1): 61.
19. BRIGO F, SCHNEIDER M, WAGENPFEIL G, et al. Early poststroke seizures following thrombolysis and/or thrombectomy for acute stroke: Clinical and stroke characteristics[J]. Epilepsy Behav, 2020, 104(Pt B): 106353.
20. BELCASTRO V, BRIGO F, FERLAZZO E, et al. Incidence of early poststroke seizures during reperfusion therapies in patients with acute ischemic stroke: An observational prospective study[J]. Epilepsy Behav, 2020, 104(Pt B): 106476.
21. BENTES C, MARTINS H, PERALTA A R, et al. Epileptic manifestations in stroke patients treated with intravenous alteplase[J]. Eur J Neurol, 2017, 24(6): 755-761.
22. ANADANI M, LEKOUBOU A, ALMALLOUHI E, et al. Incidence, predictors, and outcome of early seizures after mechanical thrombectomy[J]. J Neurol Sci, 2019, 396: 235-239.
23. BA K, CASOLLA B, CAPARROS F, et al. Early epileptic seizures in ischaemic stroke treated by mechanical thrombectomy: Influence of rt-PA[J]. J Neurol, 2020, 268(1): 305-311.
24. ERIKSSON H, LÖWHAGEN HENDÉN P, RENTZOS A, et al. Acute symptomatic seizures and epilepsy after mechanical thrombectomy[J]. Epilepsy Behav, 2020, 104(Pt B): 106520.
25. ZÖLLNER J P, MISSELWITZ B, MAUROSCHAT T, et al. Intravenous thrombolysis or mechanical thrombectomy do not increase risk of acute symptomatic seizures in patients with ischemic stroke[J]. Sci Rep, 2020, 10(1): 21083.
26. ALEMANY M, NUÑEZ A, FALIP M, et al. Acute symptomatic seizures and epilepsy after mechanical thrombectomy. A prospective long-term follow-up study[J]. Seizure, 2021, 89: 5-9.
27. MUSHANNEN T, ALEYADEH R, SIDDIQUI M, et al. Effect of reperfusion therapies on incidence of early post-stroke seizures[J]. Front Neurol, 2021, 12: 758181.
28. KOHLHASE K, TAKO L M, ZÖLLNER J P, et al. Mechanical thrombectomy does not increase the risk of acute symptomatic seizures in patients with an ischaemic stroke: A propensity score matching study[J]. J Neurol, 2022, 269(6): 3328-3336.
29. POLYMERIS A A, CURTZE S, ERDUR H, et al. Intravenous thrombolysis for suspected ischemic stroke with seizure at onset[J]. Ann Neurol, 2019, 86(5): 770-779.
30. FEYISSA A M, HASAN T F, MESCHIA J F. Stroke-related epilepsy[J]. Eur J Neurol, 2019, 26(1): 18-e13.
31. LEE S K, KIM D I, KIM S Y, et al. Reperfusion cellular injury in an animal model of transient ischemia[J]. AJNR Am J Neuroradiol, 2004, 25(8): 1342-1347.
32. SCHWARTZ R B. Hyperperfusion encephalopathies: Hypertensive encephalopathy and related conditions[J]. Neurologist, 2002, 8(1): 22-34.
33. KARAPANAYIOTIDES T, MEULI R, DEVUYST G, et al. Postcarotid endarterectomy hyperperfusion or reperfusion syndrome[J]. Stroke, 2005, 36(1): 21-26.
34. SEECK M, VULLIEMOZ S. Seizures during stroke thrombolysis heralding dramatic neurologic recovery[J]. Neurology, 2007, 69(4): 409-410.
35. CARAMELLI P, MUTARELLI E G, CARAMELLI B, et al. Neurological complications after thrombolytic treatment for acute myocardial infarction: Emphasis on unprecedented manifestations[J]. Acta Neurol Scand, 1992, 85(5): 331-333.
36. QIAN Z, GILBERT M E, COLICOS M A, et al. Tissue-plasminogen activator is induced as an immediate-early gene during seizure, kindling and long-term potentiation[J]. Nature, 1993, 361(6411): 453-457.
37. YEPES M, SANDKVIST M, COLEMAN T A, et al. Regulation of seizure spreading by neuroserpin and tissue-type plasminogen activator is plasminogen-independent[J]. J Clin Invest, 2002, 109(12): 1571-1578.
38. TSIRKA S E, GUALANDRIS A, AMARAL D G, et al. Excitotoxin-induced neuronal degeneration and seizure are mediated by tissue plasminogen activator[J]. Nature, 1995, 377(6547): 340-344.
39. BENTES C, BRIGO F, ZELANO J, et al. Reperfusion therapies and poststroke seizures[J]. Epilepsy Behav, 2020, 104(Pt B): 106524.
40. SUN J, LAM C, CHRISTIE L, et al. Risk factors of hemorrhagic transformation in acute ischaemic stroke: A systematic review and meta-analysis[J]. Front Neurol, 2023, 14: 1079205.
41. THEVATHASAN A, NAYLOR J, CHURILOV L, et al. Association between hemorrhagic transformation after endovascular therapy and poststroke seizures[J]. Epilepsia, 2017, 59(2): 403-409.
42. SUSSMAN E S, CONNOLLY J, E SANDER. Hemorrhagic transformation: A review of the rate of hemorrhage in the major clinical trials of acute ischemic stroke[J]. Front Neurol, 2013, 4: 69.
43. DEREX L, RHEIMS S, PETER-DEREX L. Seizures and epilepsy after intracerebral hemorrhage: An update[J]. J Neurol, 2021, 268(7): 2605-2615.
44. GALOVIC M, DOHLER N, ERDELYI-CANAVESE B, et al. Prediction of late seizures after ischaemic stroke with a novel prognostic model (the SeLECT score): A multivariable prediction model development and validation study[J]. Lancet Neurol, 2018, 17(2): 143-152.
45. SHEN L, YANG J, TANG Y. Predictive values of the SeLECT score and IL-1beta for post-stroke epilepsy[J]. Neuropsychiatr Dis Treat, 2021, 17: 2465-2472.
46. ALVAREZ V, ROSSETTI A O, PAPAVASILEIOU V, et al. Acute seizures in acute ischemic stroke: Does thrombolysis have a role to play?[J]. J Neurol, 2013, 260(1): 55-61.
47. BENTES C, MARTINS H, PERALTA A R, et al. Post-stroke seizures are clinically underestimated[J]. J Neurol, 2017, 264(9): 1978-1985.
48. ZHANG L, ZHENG W, CHEN F, et al. Associated factors and prognostic implications of non-convulsive status epilepticus in ischemic stroke patients with impaired consciousness[J]. Front Neurol, 2022, 12: 795076.
49. SANCHES P R, TABAEIZADEH M, MOURA L M V R, et al. Anti-seizure medication treatment and outcomes in acute ischemic stroke patients undergoing continuous EEG monitoring[J]. Neurol Sci, 2022, 43(9): 5441-5449.
50. LASEK-BAL A, DEWERENDA-SIKORA M, BINEK Ł, et al. Epileptiform activity in the acute phase of stroke predicts the outcomes in patients without seizures[J]. Front Neurol, 2023, 14: 1096876.
51. BENTES C, MARTINS H, PERALTA A R, et al. Early EEG predicts poststroke epilepsy[J]. Epilepsia Open, 2018, 3(2): 203-212.
52. PUNIA V, ELLISON L, BENA J, et al. Acute epileptiform abnormalities are the primary predictors of post-stroke epilepsy: A matched, case-control study[J]. Ann Clin Transl Neurol, 2022, 9(4): 558-563.
53. KOOME M, CHURILOV L, CHEN Z, et al. Computed tomography perfusion as a diagnostic tool for seizures after ischemic stroke[J]. Neuroradiology, 2016, 58(6): 577-584.
54. CHEN Z, CHURILOV L, KOOME M, et al. Post-stroke seizures is associated with low alberta stroke program early CT score[J]. Cerebrovasc Dis, 2017, 43(5-6): 259-265.
55. BARBER P A, DEMCHUK A M, ZHANG J, et al. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy. ASPECTS Study Group. Alberta Stroke Programme Early CT Score[J]. Lancet, 2000, 355(9216): 1670-1674.
56. TAN T Y, LU C H, CHUANG H Y, et al. Long-term antiepileptic drug therapy contributes to the acceleration of atherosclerosis[J]. Epilepsia, 2009, 50(6): 1579-1586.
57. CHUANG Y C, CHUANG H Y, LIN T K, et al. Effects of long-term antiepileptic drug monotherapy on vascular risk factors and atherosclerosis[J]. Epilepsia, 2012, 53(1): 120-128.
58. NESSELROTH D, GILAD R, NAMNEH M, et al. Estimation of seizures prevalence in ischemic strokes after thrombolytic therapy[J]. Seizure, 2018, 62: 91-94.
59. GASPARINI S, ASCOLI M, BRIGO F, et al. Younger age at stroke onset but not thrombolytic treatment predicts poststroke epilepsy: An updated meta-analysis[J]. Epilepsy Behav, 2020, 104(Pt B): 106540.
60. BRIGO F, SCHNEIDER M, WAGENPFEIL G, et al. Intravenous thrombolysis with tPA and cortical involvement increase the risk of early poststroke seizures: Results of a case-control study[J]. Epilepsy Behav, 2020, 104(Pt B): 106312.
【引用格式】柳越,陈树达,陈思卿,等. 缺血性卒中再灌注治疗后癫痫的研究进展[J]. 中国神经精神疾病杂志,2024,50(10):619-626.
【Cite this article】LIU Y,CHEN S D,CHEN S Q ,et al.Research progress on epilepsy after reperfusion therapy in ischemic stroke[J]. Chin J Nervous Mental Dis,2024,50(10):619-626.
DOI:10.3969/j.issn.1002-0152.2024.010.010


