电子科技大学张坤教授团队Biomaterials:纳米医学解锁射频动力学疗法用于肝细胞癌不完全射频消融后重塑免疫抑制微环境
时间:2025-01-16 12:09:36 热度:37.1℃ 作者:网络
【研究背景】
射频消融(RFA)是治疗肝细胞癌(HCC)的重要方法,但HCC不完全射频消融(iRFA)后残余肿瘤免疫抑制微环境增强,从而加速残留肿瘤细胞的扩增并诱导肿瘤快速复发和转移。纳米医学领的快速发展为肿瘤治疗提供新思路。近年来,基于活性氧(ROS)的动力学疗法,包括光动力疗法(PDT)、声动力疗法(SDT)、化疗动力疗法(CDT)、微波动力疗法(MWDT)等,已被开发用于减轻肿瘤免疫抑制并重振免疫监测。目前还没有关于射频场激发的射频动力疗法(RFDT)的报道。

针对以上问题,电子科技大学张坤教授/复旦大学附属华山医院丁红教授团队,设计、合成了一种经聚乙二醇修饰的铁基单原子纳米酶P@Fe SAZ,其能够在低温射频场(LIRF)的辐照下产生大量活性氧(ROS),解锁肿瘤的射频动力疗法(RFDT),该疗法通过重塑HCC在iRFA后残余肿瘤的免疫抑制微环境,激活免疫应答从而抑制残余肿瘤的复发和转移。相关工作以“Nanomedicine-unlocked radiofrequency dynamic therapy dampens incomplete radiofrequency ablation-arised immunosuppression to suppress cancer relapse”为题发表于Biomaterials杂志。
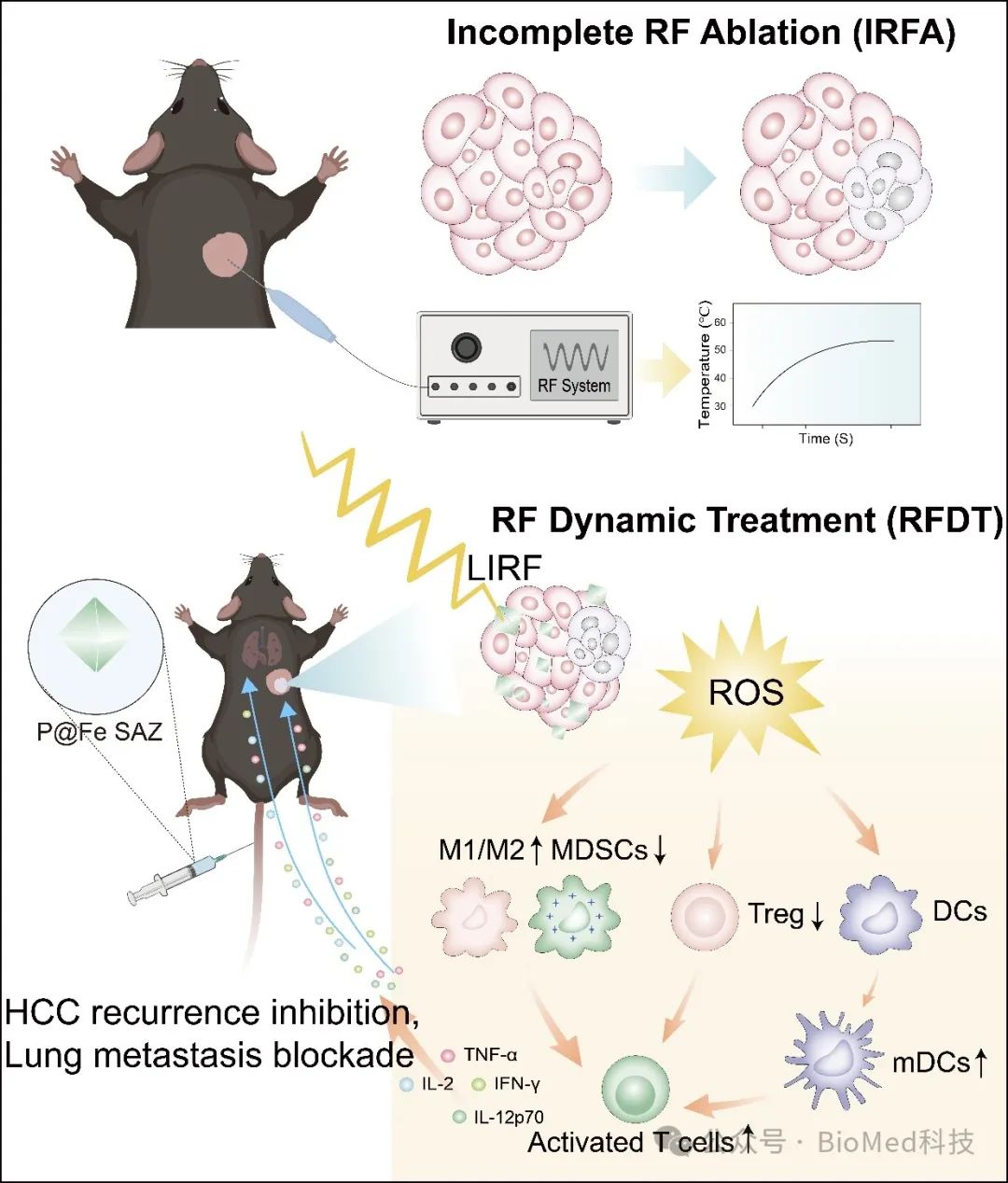
图1. RFDT减轻iRFA后残余肿瘤加重的免疫抑制微环境原理图及作用靶点
【文章要点】
如图2所示,在本工作中,作者首先成功制备出形貌规则的P@Fe SAZ。通过透射电镜、粒径仪和XPS等手段确定了P@Fe SAZ的形貌、尺寸和化学组成。
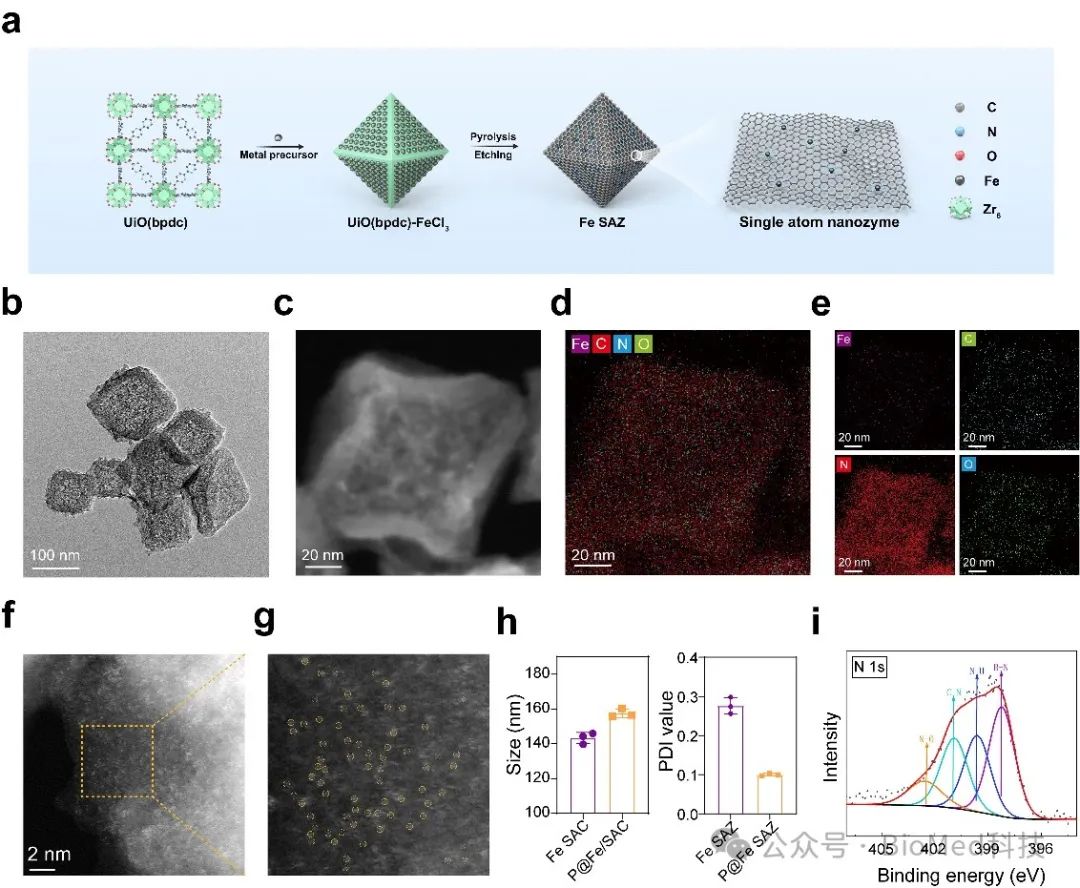
图2. P@Fe SAZ 的合成与表征
如图3所示,作者通过ESR 和紫外-可见光谱、荧光光谱等手段检测了P@Fe SAZ在LIRF辐照下产生ROS的能力,解锁了射频动力疗法(RFDT)。
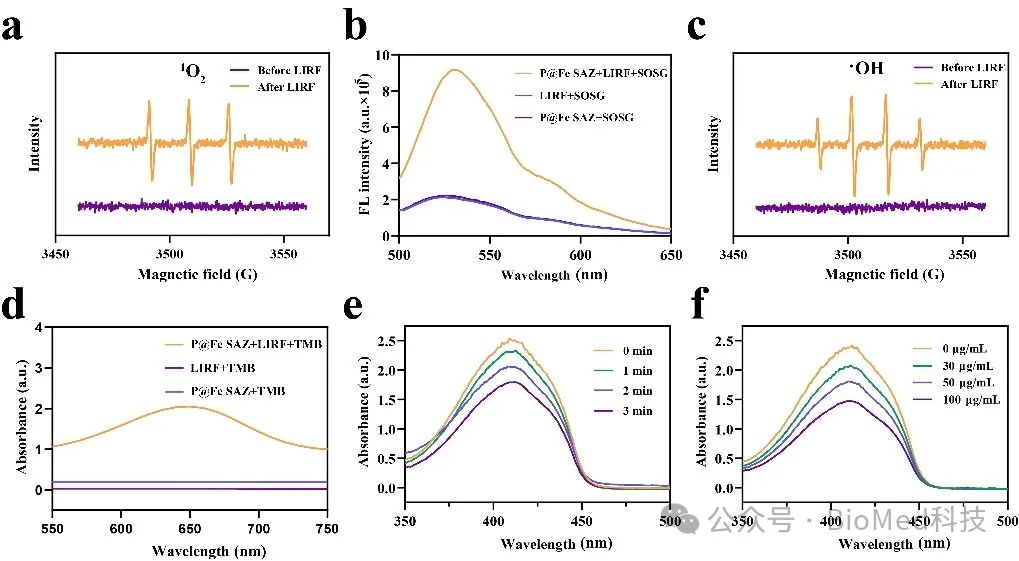
图3. 在 LIRF 照射下体外检测 P@Fe SAZ 的 ROS 产生
如图4所示,作者在体外细胞层面探索了P@Fe SAZ联合LIRF介导的RFDT对肝癌细胞的杀伤作用。
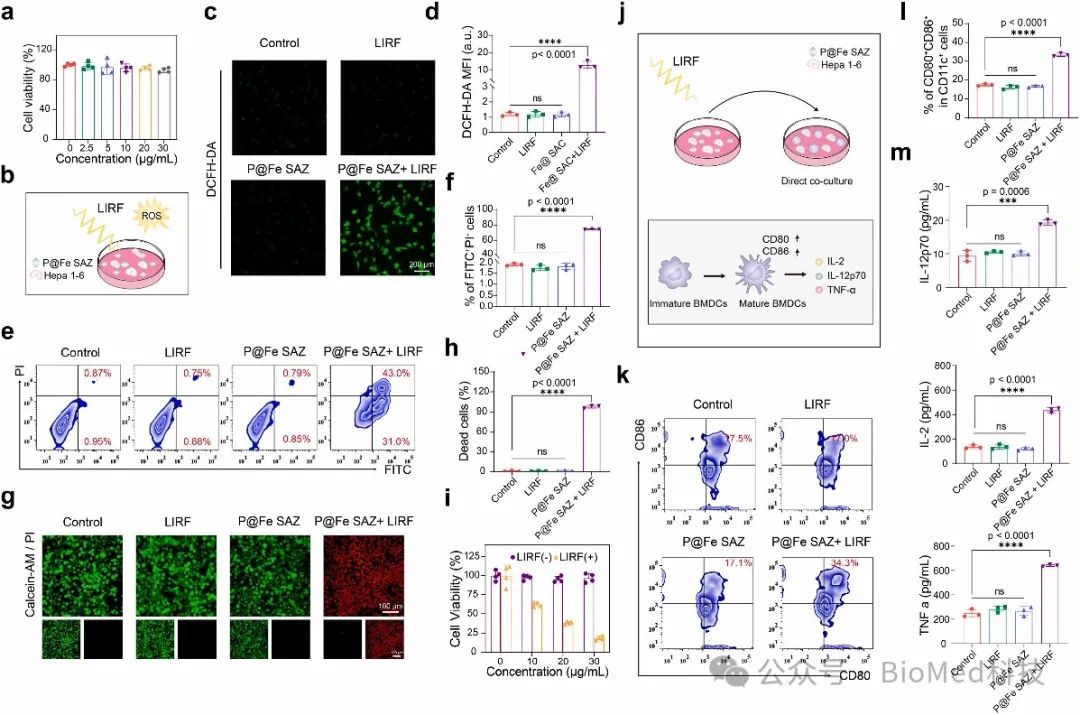
图4. 使用 P@Fe SAZ 对 RFDT 和激活的免疫反应进行体外评估
进一步,作者在动物层面评估了RFDT对iRFA后残余HCC抗复发的治疗效果(图5),RFDT极大地抑制了残余肿瘤的快速扩张。
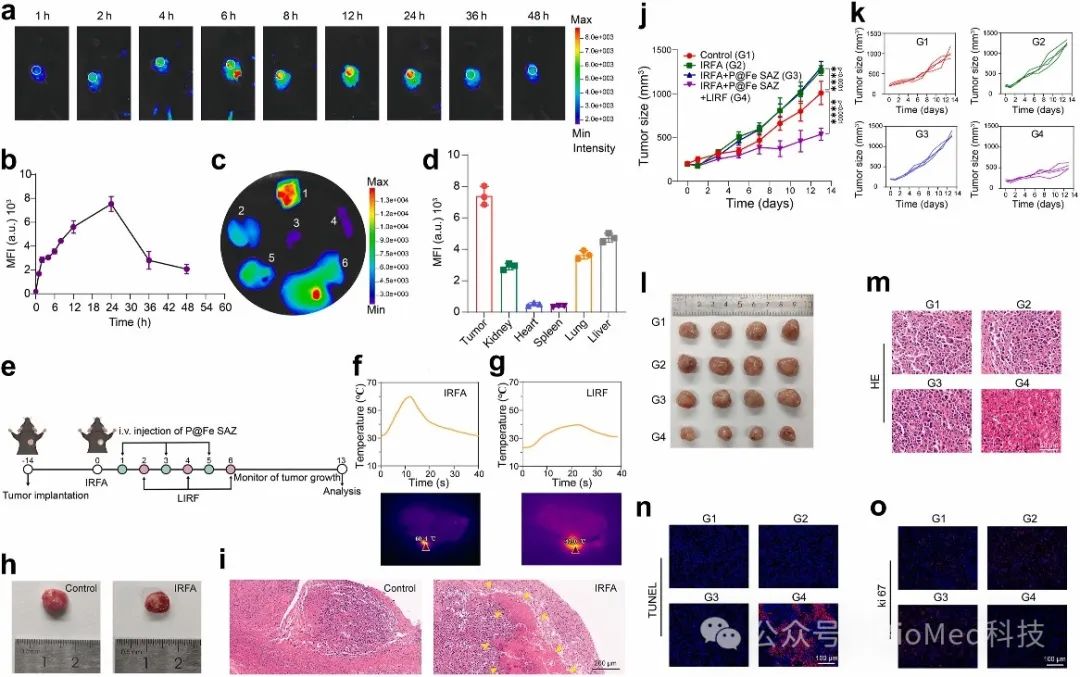
图5. 体内 RFDT 对抗 iRFA 后复发性 HCC
随后,作者对iRFA 后残余肿瘤的免疫抑制微环境进行了探索(图6)。RFDT重塑了免疫抑制剂微环境,促进肿瘤相关巨噬细胞 (TAM) 极化为M1型 TAM,下调髓源性抑制细胞 (MDSC) 和调节性 T 细胞 (Treg),促进刺激树突状细胞 (DC) 成熟,并促进效应 T 细胞的增殖和浸润。
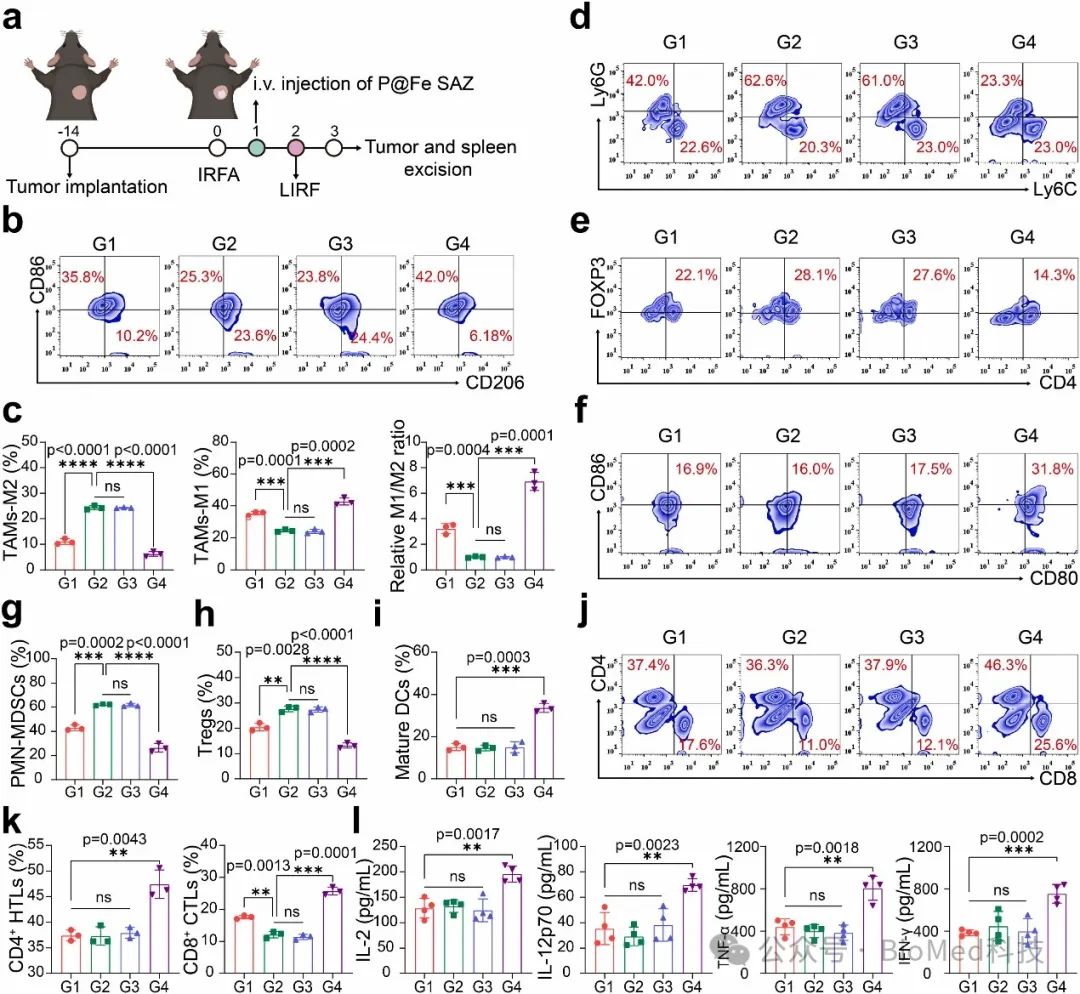
图6. RFDT 激活免疫反应和逆转 iRFA 诱导的免疫抑制微环境的机制
最后,作者进一步探讨了 RFDT 增强的免疫反应和 RFDT 缓解的免疫抑制是否能对 iRFA 后残留 HCC 的肺转移产生影响(图7)。结果发现,RFDT治疗策略产生了持久的抗肿瘤效果,抵抗 iRFA 后残留 HCC 的肺转移。
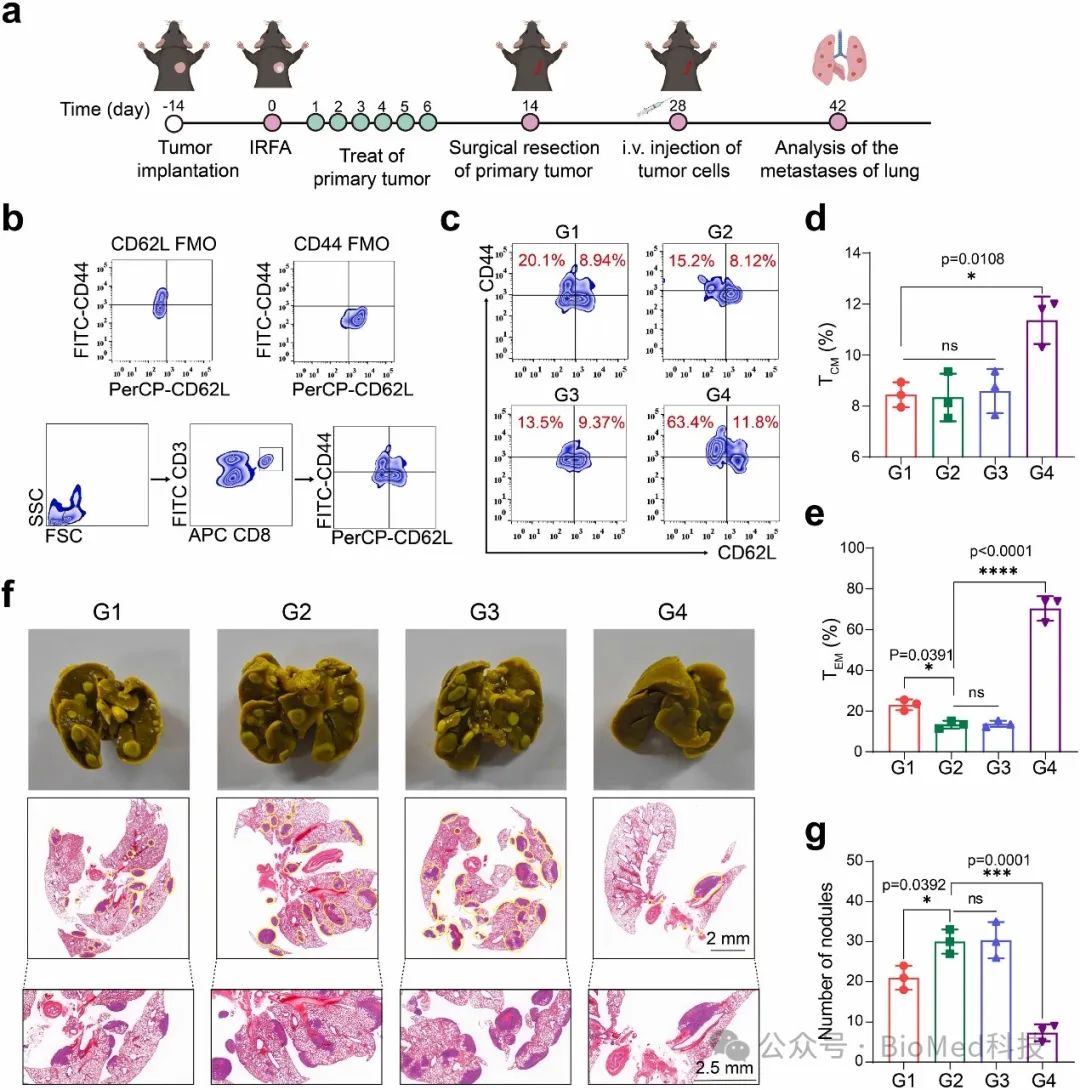
图7. RFDT 对 iRFA 后肺转移的有效性
【作者简介】
张坤,电子科技大学附属医院•四川省人民医院教授、博士生导师。获国家青年人才、四川省杰青、天府峨眉领军、上海市青年拔尖人才、重庆巴渝学者讲座教授、上海市人才发展资金等人才计划;曾获中国抗癌协会一等奖、教育部自然科学奖一等奖、华夏医学科技奖二等奖等奖励。担任中国抗癌协会合成生物医药专业委员会常务委员、中国生物医药技术协会基因编辑分会常务委员等,以及View-Medicine、Medical Materials Research等杂志的副主编。在Cell、Cancer Discov、Adv Mater、Nat Commun、Prog Mater Sci、STTT等杂志发表SCI论文130余篇。
原文链接:


