Cell:免疫逃逸克星来了:靶向m6A 结合蛋白 YTHDF2,促使CAR-T细胞重拾“战斗力”!
时间:2025-01-14 12:11:55 热度:37.1℃ 作者:网络
近年来,CAR-T细胞疗法在B细胞恶性肿瘤的治疗中展现出显著潜力。然而,长期随访的临床研究显示,在复发或难治性B细胞恶性肿瘤患者中,约50%的缓解患者会在治疗后一年内复发,而约20%的患者未能从治疗中获益。
研究发现,抗原逃逸和细胞持久性等问题限制了CAR-T疗法的疗效。因此,深入探索肿瘤免疫逃逸的机制,尤其是关键分子的作用,将有助于优化CAR-T疗法,提高其长期效果并延长患者的生存期。
2024年12月17日,洛杉矶癌症研究机构、希望之城(City of Hope)Jianjun Chen 等研究学者们在国际顶尖期刊 Cell 上发表了题为 YTHDF2 promotes ATP synthesis and immune evasion in B cell malignancies 的研究论文【1】。
研究表明,YTHDF2通过稳定m5C修饰的mRNA和不稳定m6A修饰的mRNA,在B细胞恶性肿瘤的发生、发展和免疫逃逸中发挥关键作用。
靶向YTHDF2的小分子药物CCI-38能够抑制B细胞恶性肿瘤,并增强CAR-T细胞疗法的效果。

主要研究内容和结果
🔷 YTHDF2在B细胞恶性肿瘤中的表达与功能:
研究发现,YTHDF2在B-ALL和B细胞淋巴瘤患者样本中显著高表达,其过表达可单独诱导正常前体B细胞转化为恶性B细胞,并在体内形成B-ALL。YTHDF2的高表达与患者较差的预后相关,提示其在B细胞恶性肿瘤的发生和发展中发挥重要作用。
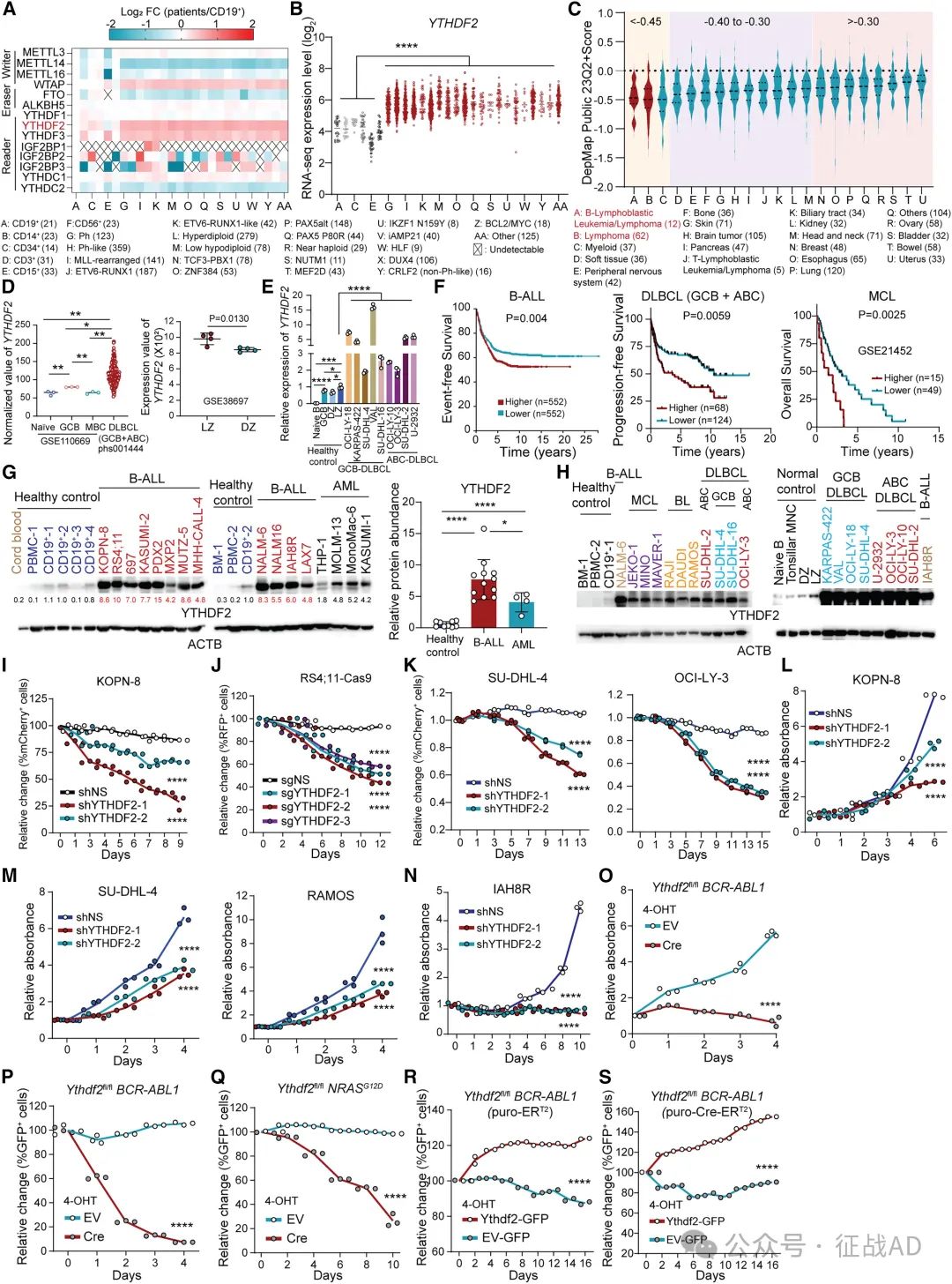
图1. YTHDF2 过度表达并在 B 细胞恶性肿瘤中起致癌作用
🔷 YTHDF2对ATP合成的调控:
YTHDF2通过稳定m5C修饰的ATP5PB、ATP5MG和ATP5MF mRNA,促进这些基因的表达,从而增强ATP合成。这一过程为恶性B细胞的快速增殖和能量需求提供了支持。研究还发现,YTHDF2的这一功能不依赖于其m6A读取器活性,表明其在调控mRNA稳定性方面具有多重机制。
🔷 YTHDF2在免疫逃逸中的作用:
作为m6A读取器,YTHDF2通过不稳定CD19和HLA-DMA/B mRNA,降低这些免疫相关分子的表达,促进B细胞恶性肿瘤的免疫逃逸。这一机制导致肿瘤细胞能够逃避免疫系统的识别和攻击,进而影响CAR-T细胞疗法等免疫治疗的效果。
🔷 YTHDF2抑制剂CCI-38的疗效:
研究筛选并验证了小分子药物CCI-38作为YTHDF2抑制剂的有效性。CCI-38能够抑制YTHDF2的活性,减少ATP合成,提高CD19和HLA-DMA/B的表达,从而增强CAR-T细胞对B细胞恶性肿瘤的杀伤效果。在动物模型中,CCI-38单独使用或与CAR-T细胞联合使用均显示出显著的抗肿瘤效果,为B细胞恶性肿瘤的治疗提供了新的策略。
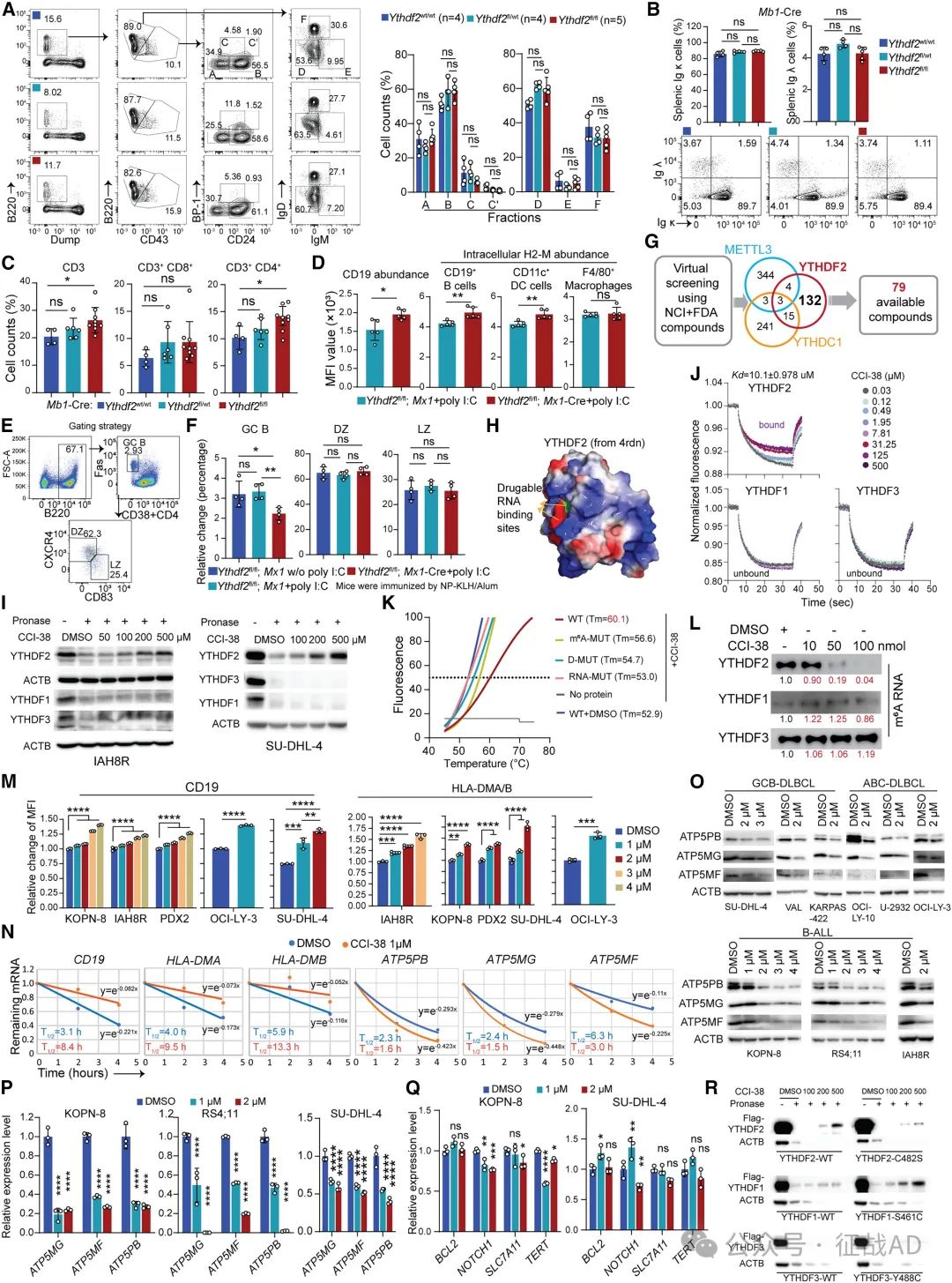
图2. CCI-38 被鉴定为有效的 YTHDF2 抑制剂
编者按:
临床意义和科研启示:
本研究揭示了YTHDF2在B细胞恶性肿瘤中的双重作用机制,为理解RNA修饰在肿瘤发生发展中的作用提供了新的视角。
提到YTHDF2,可能很多同仁并不熟悉;但实际上,
在肿瘤领域:YTHDF2 在多种癌症(包括肝癌、白血病、结直肠癌等)中被发现存在异常表达或功能失常;通过调控肿瘤相关基因的 mRNA 稳定性,可能影响肿瘤的生长、增殖和转移。
在免疫调控中:YTHDF2 可影响免疫细胞(如 T 细胞、树突状细胞等)的基因表达及分化,在炎症和自身免疫性疾病中也逐渐被研究。
更重要的是,YTHDF2作为m5C和m6A的双读取器,调控了与肿瘤能量代谢和免疫逃逸相关的mRNA稳定性,提示RNA修饰在肿瘤微环境调控中的复杂性和重要性。
识别 m6A 修饰
YTHDF2 具有一个 YTH 结构域,能够特异性地识别并结合到含有 m6A 修饰(N^6-甲基腺苷)的 mRNA 上。这种结合是其发挥后续调控功能的前提。
调控 mRNA 降解与稳定
YTHDF2 最早且最核心的功能是促进 m^6A 修饰 RNA 的降解。它可以与 mRNA 的 3’-UTR 或者 CDS 区段结合,通过与去腺苷化酶或其他 RNA 降解复合物相互作用,加速靶标 RNA 的降解,从而降低 mRNA 半衰期。
此外,本研究还发现了YTHDF2抑制剂CCI-38在B细胞恶性肿瘤治疗中的潜力,为开发新的抗肿瘤药物提供了方向。
Reference:
【1】Chen Z, et al. YTHDF2 promotes ATP synthesis and immune evasion in B cell malignancies. Cell. 2024 Dec 12:S0092-8674(24)01324-2. doi: 10.1016/j.cell.2024.11.007. Epub ahead of print. PMID: 39694037.
【2】Wang L, et al. YTHDF2 inhibition potentiates radiotherapy antitumor efficacy. Cancer Cell. 2023 Jul 10;41(7):1294-1308.e8. doi: 10.1016/j.ccell.2023.04.019. Epub 2023 May 25. PMID: 37236197; PMCID: PMC10524856.
【3】Hwang HJ, et al. YTHDF2 facilitates aggresome formation via UPF1 in an m6A-independent manner. Nat Commun. 2023 Oct 6;14(1):6248. doi: 10.1038/s41467-023-42015-w. PMID: 37803021; PMCID: PMC10558514.


