盘点:2024年FDA批准的50款创新药物
时间:2025-01-06 21:03:22 热度:37.1℃ 作者:网络
2024年美国FDA药品评价与研究中心(CDER)共批准了50款新药,其中包括34款新分子实体和16款生物大分子药物。新分子实体中,小分子居多,占比约达91%(31款),其余包括核酸与多肽类药物;生物制品中,81%为抗体类(10款单抗、3款双抗),其余为融合蛋白及A型肉毒毒素。相比2023年同期获批数量(53款),今年FDA批准新药数量有所下降。
统计在获批的新药中,化学小分子药物依旧是创新主力,以64%的占比遥遥领先,这些新药涵盖靶点LACTB、PBP、THR-β、Raf、PDE3/4、HIF等;其次是单克隆抗体,有13款(占比26%);蛋白类药物2款(占比4%);小核酸药物2款(占比4%);甲状旁腺激素类似物1款(占比2%)。
获批新药治疗的疾病多样,其中,治疗罕见疾病和癌症的新药总数名列前茅。在抗感染和中枢神经系统疾病领域也有多款新药获批。


1、获批的“first-in-class”疗法
总体而言,2024年CDER批准的新药数量与2023年相差不大,其中“first-in-class”(FIC)药物数量也基本持平。2023年CDER批准了20款FIC药物,占所批准新药数量的36%。而2024年CDER批准的新药中有22款为FIC药物,占比44%。在这些FIC药物中,小分子药物近乎占据了半壁江山(10款),而抗体药物则是另一支创新的主力军(单抗5款,双抗3款)。其中,8款药物为获得突破性疗法认定的“first-in-class”药物,它们不但具有独特的作用机制,而且与以往疗法相比,给患者带来了显著疗效改善。
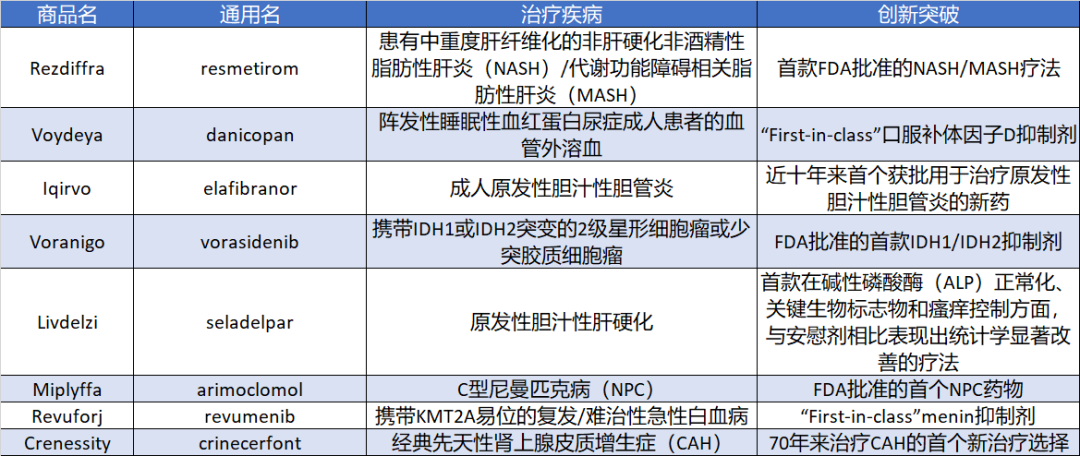
获得FDA突破性疗法认定的“first-in-class”小分子药物
例如:
-
Rezdiffra(resmetirom)
具有里程碑意义的首款NASH治疗药物Rezdiffra,来自首度有产品获批的Madrigal Pharmaceutical。
Rezdiffra是一款“first-in-class”的口服甲状腺激素受体(THR)-β选择性激动剂,THR-β在肝脏中高度表达,能够调节脂代谢,降低LDL-C、甘油三酯和致动脉粥样硬化性脂蛋白。
此外,THR-β还能通过促进脂肪酸的分解和刺激线粒体的生物发生来减少脂肪毒性并改善肝功能,从而减少肝脏脂肪。Rezdiffra用于治疗患有中重度肝纤维化(F2至F3期)的非肝硬化非酒精性脂肪性肝炎(NASH)患者,成为FDA批准的首款NASH疗法,具有里程碑意义。该疗法曾获美国FDA授予的突破性疗法认定,用于治疗NASH。
MASH有着十分庞大的患者群体和临床治疗需求,但由于发病机制复杂,药物研发难度大,始终未能有所突破。Resmetirom是一款甲状腺激素受体(THR)-β口服选择性激动剂,能够调节脂代谢,降低LDL-C、甘油三酯和致动脉粥样硬化性脂蛋白,还可以通过促进脂肪酸的分解和刺激线粒体的生物发生来减少脂肪毒性并改善肝功能,进而减少肝脏脂肪。该药是FDA批准的首款MASH新药。
-
Miplyffa(arimoclomol)
Miplyffa是一款口服、“first-in-class”的细胞热休克反应共诱导剂,开发用以治疗C型尼曼-匹克病。
Miplyffa是美国FDA批准的首个NPC药物,该疗法曾获FDA授予孤儿药资格、快速通道资格、突破性疗法认定以及罕见儿科疾病资格。
2、多肽和核酸类疗法
随着多肽和核酸类药物开发技术的日渐成熟,这类治疗模式在FDA批准的新药中占比近年来平均达到10%。2024年获批的核酸类药物包括首款端粒酶抑制剂Rytelo(imetelstat),长效甲状旁腺激素前药Yorvipath,以及治疗家族性乳糜微粒血症综合征(FCS)新药Tryngolza。

▲2024年获得FDA批准的多肽和核酸类疗法
其中,首款端粒酶抑制剂Rytelo(imetelstat),它通过靶向并与端粒酶的RNA模板结合,抑制端粒酶的活性。在今年6月获得FDA批准用于治疗骨髓增生异常综合征(MDS)成年患者。
多肽类药物面临的一个重要挑战是多肽在人体内容易被降解,难于维持其疗效。然而随着多肽修饰技术的进步,多肽类药物的半衰期越来越长,给患者带来了治疗负担更小的长效疗法。今年获批的Yorvipath是一款长效甲状旁腺激素前药,它将甲状旁腺激素前药与聚乙二醇载体连接,以控制激素在体内的释放。它在今年8月获得FDA批准,成为首款治疗成人甲状旁腺功能减退的药物。
3、细胞和基因疗法获批创历史新高
2024年,FDA批准了8款细胞和基因疗法,总数创历史新高。最近3年,批准了20款细胞和基因疗法,凸显了该治疗类型的迅猛发展。

▲2024年获批细胞和基因疗法列表
这些疗法不但代表着技术创新,也为多种类型疾病患者带来首款获批疗法,例如:
-
Amtagvi(lifileucel)
2024年2月16日,美国FDA加速批准Iovance Biotherapeutics的肿瘤浸润淋巴细胞(TIL)疗法Amtagvi(lifileucel),用于治疗晚期黑色素瘤。
Amtagvi是首款获批的TIL疗法,也是首款获批治疗实体瘤的T细胞疗法,是细胞疗法的又一里程碑。
-
Lenmeldy(atidarsagene autotemcel)
2024年3月18日,FDA批准由Orchard Therapeutics所开发的基因疗法Lenmeldy(atidarsagene autotemcel,arsa-cel)上市,用于治疗满足特定条件的的异染性脑白质营养不良(MLD)儿童患者。
Lenmeldy是FDA批准用以治疗这项罕见遗传疾病的首个基因疗法。
-
Tecelra(afamitresgene autoleucel)
2024年8月2日,FDA批准Adaptimune Therapeutics公司的工程化T细胞疗法Tecelra(afami-cel)上市,用以治疗既往接受过化疗的某些HLA类型的晚期MAGE-A4+滑膜肉瘤成人患者。
Tecelra为首款用于治疗实体瘤的工程化T细胞疗法(TCR-T),也是十多年来治疗滑膜肉瘤的首个有效疗法。
-
Kebilidi (eladocagene exuparvovec)
2024年12月13日,FDA加速批准PTC Therapeutics公司开发的基因疗法Kebilidi(eladocagene exuparvovec)上市,用于治疗芳香族L-氨基酸脱羧酶缺乏症(AADCD)的儿童和成人患者,无论他们的疾病严重程度为何。
Kebilidi是FDA批准的首个直接注射到大脑的基因疗法。
-
Ryoncil(remestemcel)
2024年12月18日,FDA批准Mesoblast公司开发的Ryoncil(remestemcel)上市,用于治疗2个月及以上儿童患者的类固醇难治性急性移植物抗宿主病(SR-aGVHD)。
FDA的新闻稿指出,Ryoncil是首个FDA批准的间充质基质细胞(MSC)疗法。
在获得新药批准的药企中,约有10家MNC上榜,其余多为Biotech公司。而获批产品超过一种的仅有2家,分别为礼来和Syndax Pharmaceuticals,均有两款新药得到了批准。
1.礼来
本年度,礼来获批的两款新药为治疗阿尔茨海默病的Kisunla,以及治疗中重度特应性皮炎的Ebglyss。
-
Kisunla(donanemab-azbt)
7月2日,美国FDA批准Kisunla(donanemab-azbt)用于治疗成人早期症状性阿尔茨海默病,包括轻度认知功能障碍患者和轻度痴呆阶段阿尔茨海默病且有确诊的淀粉样蛋白病理改变的患者。据悉,Kisunla是第一款且唯一一款针对淀粉样斑块用于阿尔茨海默病患者的疗法,这可以降低治疗成本并减少输液次数。
12月18日,礼来宣布,中国NMPA已批准记能达(Donanemab,多奈单抗注射液)用于治疗成人因阿尔茨海默病引起的轻度认知功能障碍和阿尔茨海默病轻度痴呆。
据公开信息,今年7月以来,该药物已先后在美国、阿联酋、日本、卡塔尔、英国等地获上市许可。
-
Ebglyss(lebrikizumab)
Ebglyss(lebrikizumab)是一款IL-13抑制剂,可选择性阻断IL-13介导的2型炎症通路信号传导,从而抑制AD的发生发展。9月13日,该产品获得FDA批准上市,用于治疗成人及12岁以上青少年中重度特应性皮炎患者。
Ebglyss由Almirall和礼来公司联合开发,Almirall拥有Ebglyss在欧洲开发和商业化治疗皮肤病(包括特应性皮炎)的权利。礼来拥有在欧洲以外全球其他地区的独家开发和商业化权利。Ebglyss于2023年获得欧盟委员会批准,并于2024年1月在日本获得批准。
目前,全球共5款生物制剂获批用于治疗中重度特应性皮炎,包括度Dupixent(赛诺菲/再生元)、Ebglyss、Adtralza(Leo Pharma)、Mitchga(中外制药/Galderma)和司普奇拜单抗(康诺亚)。
2.Syndax Pharmaceuticals
Syndax成立近20年,拥有两款获批产品,都是在2024年获得批准。两款药物分别是CSF-1R单抗axatilimab(Niktimvo),以及Menin抑制剂Revuforj (revumenib) 。
-
axatilimab(Niktimvo)
其实,Axatilimab并不是Syndax的原研,而是引进自UCB。
2016年7月,Syndax与UCB签署全球独占许可协议获得该药开发权利。2021年5月,axatilimab获得FDA授予的治疗慢性移植物抗宿主病(cGVHD)孤儿药资格认定。
cGVHD是源于供体的血细胞对接受移植患者组织产生的免疫反应,通常涉及多个器官系统,其中皮肤和黏膜最为常见,其特征是纤维化组织的形成。估计约有40%接受移植的患者会发展为cGVHD。
2021年9月,Syndax和Incyte签订了axatilimab的独家全球联合开发和联合商业化许可协议,syndax可获得总额高达4.5亿美元的各种里程碑。
今年8月14日,FDA批准该疗法上市,用于治疗cGVHD成人和体重40公斤以上的儿科患者。
-
Revuforj (revumenib)
11月15日,Syndax公司的Revuforj (revumenib) 获得FDA批准用于治疗患有伴赖氨酸甲基转移酶2A基因(KMT2A)易位的复发或难治性(R/R)急性白血病的成人和1岁及以上儿童患者。
Revuforj (revumenib) 是第一个获批上市的menin抑制剂。
目前,Syndax市值约为11亿美元。截至今年9月30日,Syndax账户上有现金和短期投资合计4亿美元左右。
与此同时,2024年获批的新药中有多款为潜在重磅疗法,包括35年来首款被批准用于治疗精神分裂症的抗精神病药物Cobenfy、Verona Pharm慢性阻塞性肺病新药Ohtuvayre、用于治疗传染性软疣的首个新型药物Zelsuvmi等。
-
Cobenfy(xanomeline and trospium chloride)
35年来第一款治疗精神分裂症的新疗法Cobenfy,其由xanomeline和trospium chloride两种有效成分构成,其靶向M1-和M4-选择性毒蕈碱受体,由BMS收购Karuna Therapeutics而得。该药物旨在激活大脑中的毒蕈碱型乙酰胆碱受体的同时,减少对外周毒蕈碱型乙酰胆碱受体的作用,为靶向胆碱能受体的首个抗精神病药物。
-
Ohtuvayre(ensifentrine)
Ohtuvayre是一款“first-in-class”磷酸二酯酶3和磷酸二酯酶4(PDE3和PDE4)选择性双重抑制剂,双重抑制机理使其能够凭借单个化合物同时实现支气管扩张和抗炎效应。
Ohtuvayre是20多年来首个可用于COPD维持治疗的具有新作用机制的吸入产品。
-
Zelsuvmi(berdazimer)
Zelsuvmi是一种一氧化氮释放剂,一氧化氮具有抗病毒特性,用于治疗成人和1岁及以上儿科患者的传染性上皮瘤。
Zelsuvmi为FDA批准用于治疗传染性软疣的首个新型药物。这款药物可在家庭或其他非临床环境中由患者、家长或看护人员使用,是治疗这种具有高度传染性的病毒性皮肤感染的首个局部使用处方药。
-
Bizengri(zenocutuzumab)
Bizengri是一种双特异性抗体,能结合表达在细胞(包括肿瘤细胞)表面的HER2和HER3的细胞外结构域,抑制HER2与HER3形成二聚体并阻止NRG1与HER3的结合。用于治疗携带NRG1基因融合(NRG1+)的晚期不可切除或转移性胰腺导管腺癌或非小细胞肺癌(NSCLC)成年患者。
2024年12月4日美国FDA批准该疗法上市。Bizengri是FDA批准的首款治疗NRG1+胰腺癌和NSCLC患者的靶向疗法。此外,美国FDA曾授予Bizengri突破性疗法认定。
题。
2024年12月18日,基于全球Ⅲ期研究eXalt3的出色表现,FDA批准由贝达药业及其子公司Xcovery研发的中国自主创新1类药物恩沙替尼(Ensartinib,国内商品名:贝美纳®,商品名:Ensacove®)上市,用于ALK阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的一线治疗。
ALK是NSCLC重要的致癌驱动因子之一,ALK融合蛋白基因在NSCLC患者中的阳性率为5%左右,且多见于年轻、不吸烟或轻度吸烟的肺腺癌患者。ALK抑制剂能够有效抑制ALK的活性,从而起到抑制肿瘤生长的作用。该药是贝达首个成功出海的产品,也是首个由中国药企主导在全球上市的小分子肺癌靶向创新药。
此前,2020年11月,贝达药业的盐酸恩沙替尼胶囊便在中国获批上市。恩沙替尼成为FDA批准的肺癌领域首个中国自主创新药物。
2024年3月13日,百济神州的替雷利珠单抗(Tevimbra)获FDA批准,用于治疗既往接受过系统化疗(不含PD-1/L1抑制剂)后不可切除或转移性ESCC的成人患者。这是第二款成功出海美国的国产PD-1,也是百济神州在美国获批的第二款药物。10月14日,该药在美国上市销售,其后续的商业化表现值得期待。
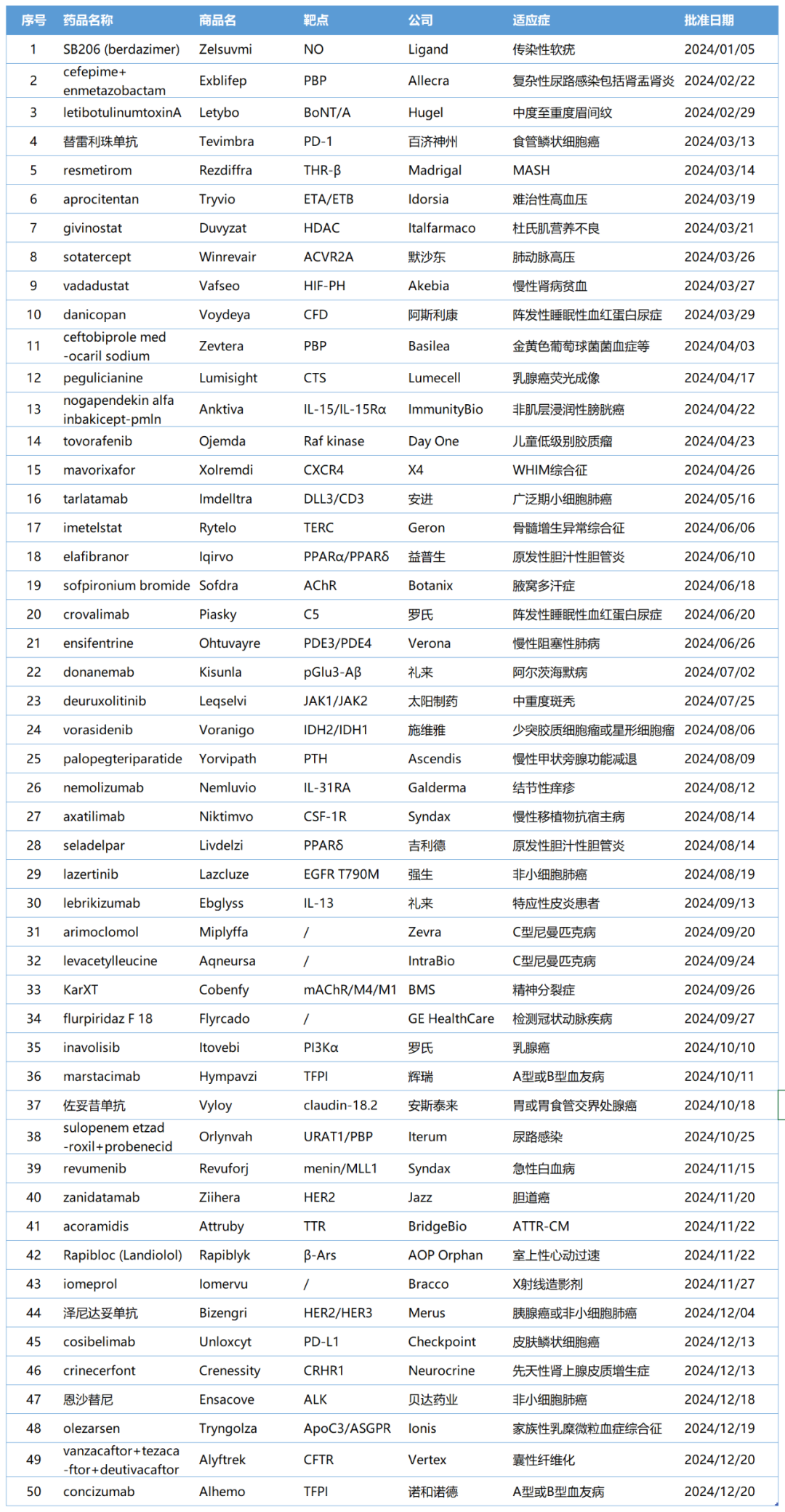
附表:2024年FDA批准的新药列表
资料来源:
医药魔方
梅斯医学


