NSR:同济大学高亚威/高绍荣/吴悠表明NEXT复合物的核心因子ZCCHC8在精子发生过程中调控LINE1的沉默
时间:2024-12-22 10:01:12 热度:37.1℃ 作者:网络
转座子元件(TE)的过度激活对雄性生殖构成重大威胁,尤其是在精子发生的微妙过程中。
2024年12月17日,同济大学高亚威、高绍荣及吴悠共同通讯在National Science Review在线发表题为“Core factor of NEXT complex, ZCCHC8, governs the silencing of LINE1 during spermatogenesis”的研究论文,该研究表明NEXT复合物的核心因子ZCCHC8在精子发生过程中调控LINE1的沉默。
该研究表明锌指蛋白ZCCHC8是参与RNA监视的核外泌体靶向(NEXT)复合物的关键组分,是精子发生过程中TE沉默所必需的。ZCCHC8的缺失导致减数分裂进程延迟和圆形精子细胞的产生减少。研究人员观察到ZCCHC8 靶向的年轻长散布核元件(LINE1、L1)亚家族在Zcchc8无效睾丸的精原干细胞(SSC)和厚层精母细胞(PS)中上调。进一步研究发现,Zcchc8 KO 小鼠的SSC中H3K9me3修饰减少,而PS中H3K4me3升高发生在年轻的L1上,尤其是L1Md_A,这可能有助于损害精子发生过程中从PS到RS的染色质凝聚。该研究强调了RNA监测介导的NEXT复合物在精子发生过程中染色质抑制的关键作用。

可转位元件(TE)构成哺乳动物基因组的重要部分,其中一些通过其复制机制对基因组完整性构成威胁,复制机制可以产生插入物,破坏相邻基因的表达。同时,TE可以显著影响基因转录和染色质状态。值得注意的是,在雄性小鼠生殖细胞中,过度的TE激活始终与减数分裂失败、无精子症和雄性不育有关。在精子发生过程中,TE的活性,如L1的活性,通过各种机制受到严格调节,包括从头DNA甲基化、抑制性组蛋白修饰,如H3K9me2/3,以及由PIWI蛋白及其相关piRNAs介导的转录后或转录沉默。然而,对TE转录后调控机制的全面理解仍然难以捉摸,这标志着进一步研究的一个关键领域。
ZCCHC8 是 NEXT 复合物的核心因子,也与影响染色质状态有关。NEXT 复合物能降解 LINE1转录本,从而影响早期胚胎发育过程中染色质的开放性 。最近,人们观察到NEXT复合物与m6A阅读器 YTHDC1 相互作用,有可能促进 PROMPTs、eRNAs 和 TE RNA 降解,还可能影响相邻基因的染色质可及性。在胚胎干细胞中,敲除ZCCHC8会导致TE RNA水平升高,这可能是由于 RNA 降解受损以及 ZCCHC8 与人类沉默中枢(HUSH)复合物相互作用所致。这种相互作用在TE位点得到维持,而TE位点又被 SETDB1 招募,从而支持了H3K9me3修饰的维持。因此,揭示 ZCCHC8 对染色质状态的影响。染色质状态的影响对于理解其在减数分裂中的调控机制至关重要。
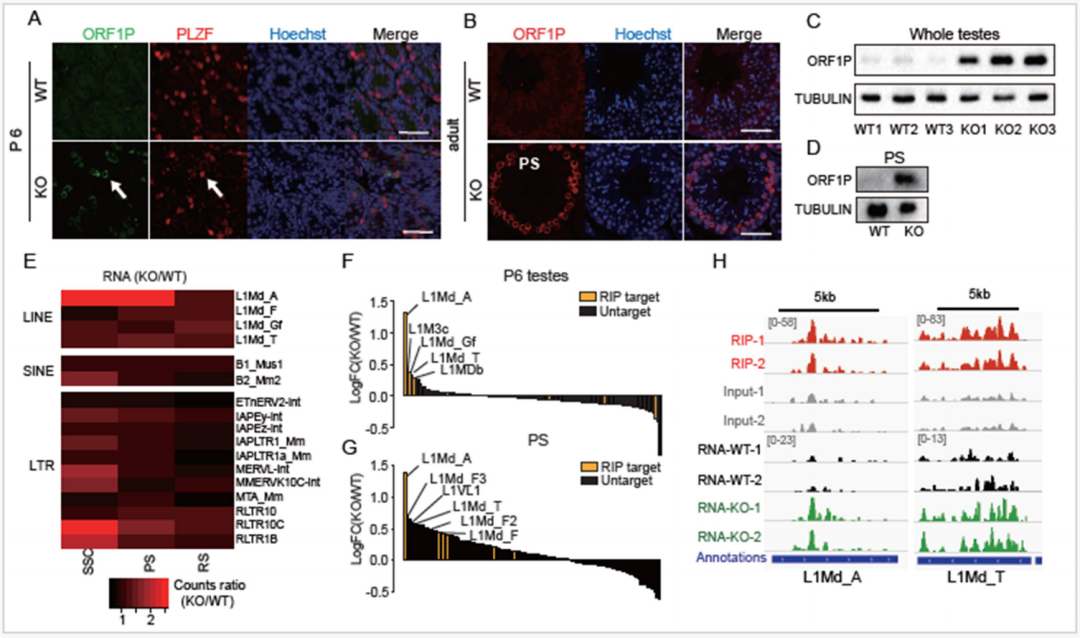
ZCCHC8靶向的年轻L1在KO小鼠的SSC和PS中被过度激活(图源自National Science Review )
该研究结果表明,ZCCHC8直接与反转录转座子转录本结合,特别是在精子发生过程中与年轻的L1元件结合。敲除ZCCHC8不仅上调了它们的RNA水平,还改变了特定区域的染色质状态,其特征是H3K9me3减少,H3K4me3增加。这些变化导致染色质去凝聚和从精母细胞向圆形精子细胞过渡的异常,最终导致异常配子发生。该研究提出NEXT复合物作为一个重要的核RNA衰变因子,在RNA和表观遗传水平上调控逆转录转座子,揭示了精子发生过程中逆转录转座子沉默的一种新机制。
参考消息:
https://academic.oup.com/nsr/advance-article/doi/10.1093/nsr/nwae407/7926976?searchresult=1


