【新药进展】Xalnesiran联合治疗II期结果发表NEJM:联用聚乙二醇干扰素α组的HBsAg清除率及血清学转换率均最高
时间:2024-12-18 12:00:38 热度:37.1℃ 作者:网络
编者按
Xalnesiran即RG6346,是Roche和Dicerna共同开发的一款siRNA药物,靶向HBV基因组的保守区域,可沉默多种HBV转录物;Ruzotolimod即RG7854,是Roche开发的一款TLR-7激动剂,当前两种药物均处于II期临床阶段。根据最近Roche更新的2024年第三季度药物研发管线信息,Roche已将所有进入临床试验I期和II期的在研乙肝新药剔除,包括Xalnesiran和Ruzotolimod。
一项II期Piranga研究探索了NA经治慢乙肝患者接受xalnesiran联合免疫调节剂ruzotolimod或PegIFNα治疗48周、随访48周的疗效和安全性,阶段性结果及随访期间的NA停药数据曾在AASLD2023、EASL2024和AASLD2024大会摘要中公布。
近日,侯金林教授团队在新英格兰医学杂志(The New England Journal of Medicine, NEJM)上发表了该项Piranga研究的完整结果,其中接受xalnesiran + PegIFNα + NA联合治疗组患者在治疗结束时的HBsAg清除率及HBsAg血清学转换率分别为30%和23%,治疗结束后随访24周分别为23%和20%,均优于其他组。肝霖君与您分享更多重要内容。

研究方法
Piranga研究是一项II期、多中心、随机对照、开放标签、自适应平台试验。NA经治≥ 12个月、筛查前维持HBV DNA < 20 IU/mL且ALT ≤ 1.5 × ULN 6个月以上的慢乙肝患者随机分为以下五组:
Group 1:xalnesiran 100mg + NA;
Group 2:xalnesiran 200mg + NA;
Group 3:xalnesiran 200mg + ruzotolimod 150mg + NA;
Group 4:xalnesiran 200mg + PegIFNα 180μg + NA;
Group 5:NA对照组
Xalnesiran Q4W,皮下注射;Ruzotolimod从第13-24周和第37-48周每隔一天口服一次;PegIFNα QW,皮下注射。治疗48周,停药随访48周。主要疗效终点为治疗结束后24周的HBsAg清除率(HBsAg < 0.05 IU/mL)。
所有患者维持NA治疗直到治疗结束时或停药随访期间达到NA停药标准。NA停药的患者若满足NA重启标准则重新启动NA治疗。
NA停药标准:ALT < 1.25 × 基线值,HBV DNA < 20 IU/mL,HBeAg阴性,HBsAg清除或HBsAg < 100 IU/mL且相比基线下降≥ 1 log10 IU/mL。
NA重新启动治疗标准:HBV DNA > 20,000 IU/mL;或HBV DNA > 2000 IU/mL 且ALT > 1.5 × ULN;或HBV DNA > 2000 IU/mL、ALT < 1.5 × ULN且7天内复查确认HBV DNA > 2000 IU/mL;或临床显著的肝功能减退迹象。
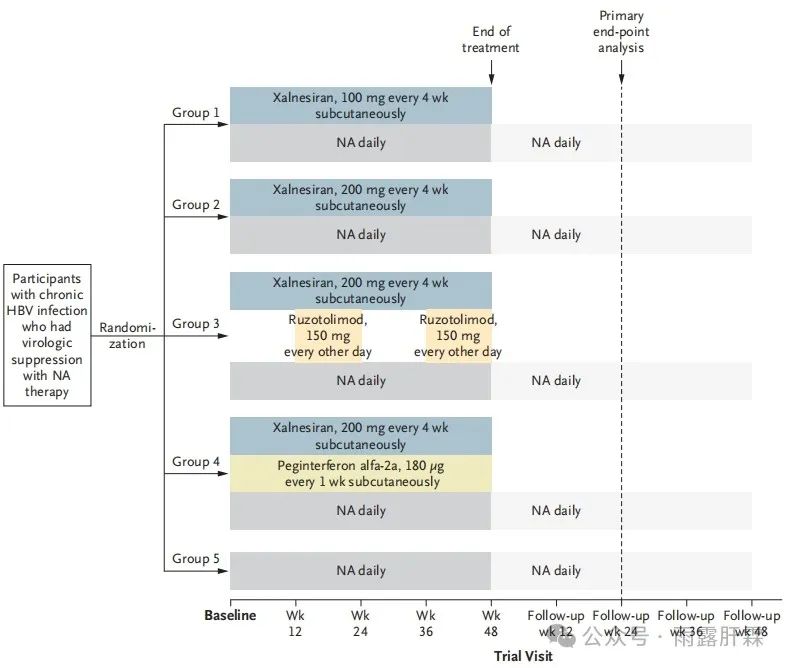
试验设计图
研究结果
01 患者特征
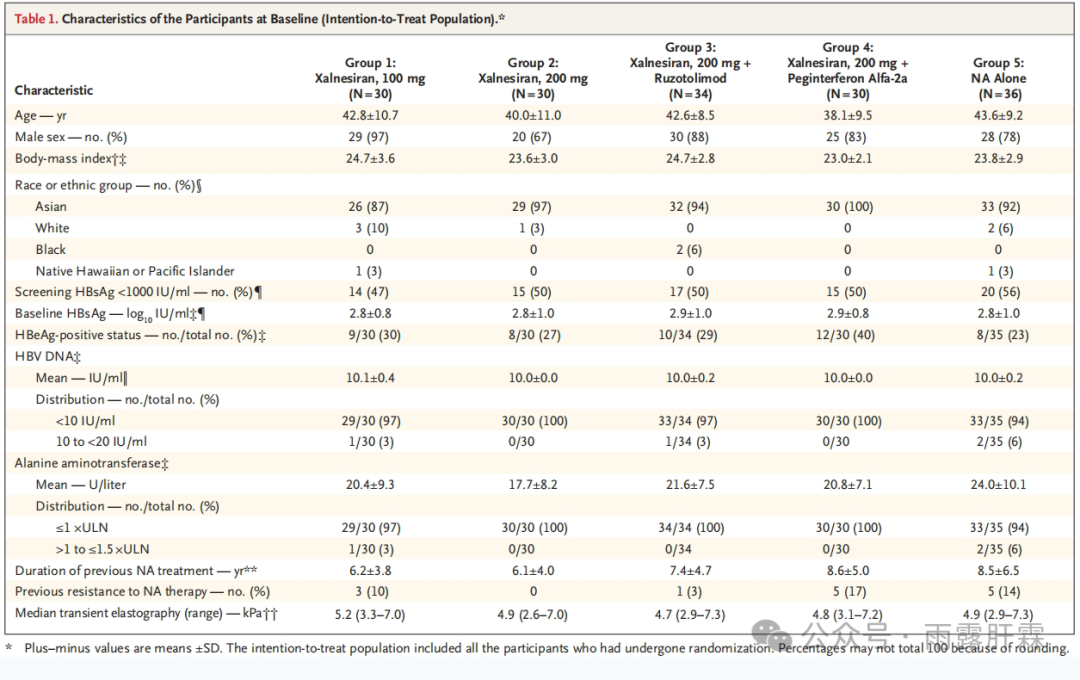
ITT人群共160例,其中xalnesiran治疗组(Group 1-4)124例,NA组(Group 5)36例;mITT人群共159例,Group 5中1例在治疗前终止研究的患者被排除在外。所有患者中94%为亚洲人,70%为HBeAg阴性(Group 5有1例患者缺少HBeAg状态数据),47%-56%的患者基线HBsAg < 1000 IU/mL,9%-17%的患者基线HBsAg < 100 IU/mL。
ITT人群的基线特征
02 疗效结果
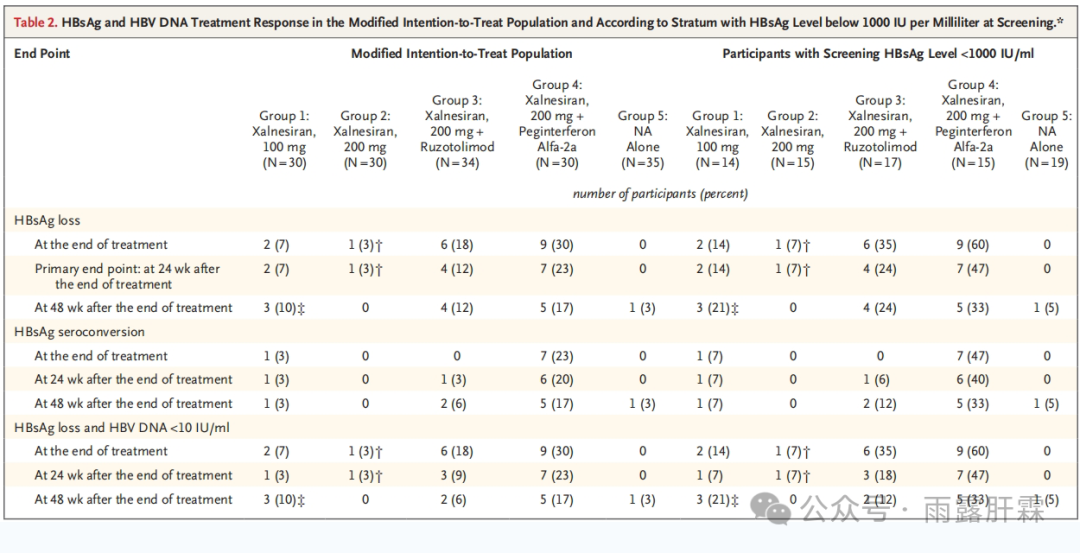
mITT人群中,Group 4达到主要终点的患者比例最高,为23%;Group 3为12%;Group 1、2和5分别为7%、3%和0%。Group 1-4相比Group 5的HBsAg清除率差分别为7%,4%,12%和24%。
在Group 4中观察到的HBsAg血清学转换率最高,治疗结束时、治疗结束后24周和治疗结束后48周分别为23%、20%和17%。其它组在各时间点的HBsAg血清学转换率均≤ 6%。
仅在筛查时HBsAg < 1000 IU/mL的患者中观察到HBsAg清除及血清学转换。在筛查时HBsAg < 1000 IU/mL的患者中,治疗结束后24周Group 4分别有47%和40%的患者实现HBsAg清除和HBsAg血清学转换;而Group 1-3的HBsAg清除率在7%-24%之间,HBsAg血清学转换率均≤ 7%。
大多数患者在整个研究期间HBV DNA < 10 IU/mL。治疗结束后24周,Group 4有23%的患者实现HBsAg清除且HBV DNA < 10 IU/mL,Group 1-3分别为3%、3%和9%,Group 5为0%。
mITT人群和筛查时HBsAg <1000 IU/mL人群中
HBsAg及HBV DNA应答情况
03 NA停药及重启治疗
Group 1-4的124例患者中共58例(47%)达到NA停药标准,40例(32%)停止NA治疗,24例(60%)直到研究结束维持NA停药。40例NA停药患者中同时达到HBsAg清除且HBV DNA<10 IU/mL的有5例(5/40,12.5%),其中Group 4有3例(38%),Group 3有2例(12%)。
04 ALT水平变化
治疗或随访期间共54%的患者出现ALT水平升高,6%出现3级或4级ALT水平升高。所有ALT水平升高与肝脏合成及排泄功能保留相关,与胆红素水平升高无关,均在无后遗症的情况下得到缓解。
05 安全性
共159例患者纳入安全性分析。Group 1-4中常见的不良事件包括ALT升高(43%-83%)、AST升高(20%-70%)、上呼吸道感染(12%-47%)和注射部位反应(7%-50%)。Group 3和4分别有47%和27%的患者出现流感样疾病。Group 1-5中分别有17%、10%、18%、50%和6%的患者发生3级或4级不良事件,最常见的3级或4级不良事件为ALT水平升高,其中Group 4发生率为13%(均为3级),其他组中发生率≤ 3%。
研究结论
NA经治获病毒学抑制的慢性HBV感染者接受xalnesiran联合免疫调节剂治疗可使相当比例的患者在治疗结束后24周实现HBsAg清除。
肝霖君有话说
乙肝新药xalnesiran联用免疫调节剂提升了慢乙肝患者实现HBsAg清除的概率,特别是xalnesiran联合PegIFNα在治疗结束及24周随访后的HBsAg清除率分别为30%和23%,均优于其他组别。值得注意的是, xalnesiran + PegIFNα组还大大提高了HBsAg血清学转换率及HBsAg清除且HBV DNA < 10 IU/mL的患者比例,这可能归因于PegIFNα对宿主免疫的有效激活且能维持停药后持久的免疫应答。靶向HBV生命周期的药物联合PegIFNα将有助于临床治愈的实现和停药后长期疗效的维持。但在NEJM发表该项令人鼓舞的研究结果后不久,罗氏在其最新研发管线中已放弃进入临床I期和II期的所有在研乙肝新药,但我们相信未来几年会有越来越多的好消息出现,乙肝治愈的脚步只会越来越快!
参考文献:
Hou JL, Zhang WH, Xie Q, et al. Xalnesiran with or without an Immunomodulator in Chronic Hepatitis B. N Engl J Med 2024;391:2098-2109.



