Nano Lett :基于细胞外囊泡的治疗策略为肺动脉高压带来新希望
时间:2024-12-15 18:00:53 热度:37.1℃ 作者:网络

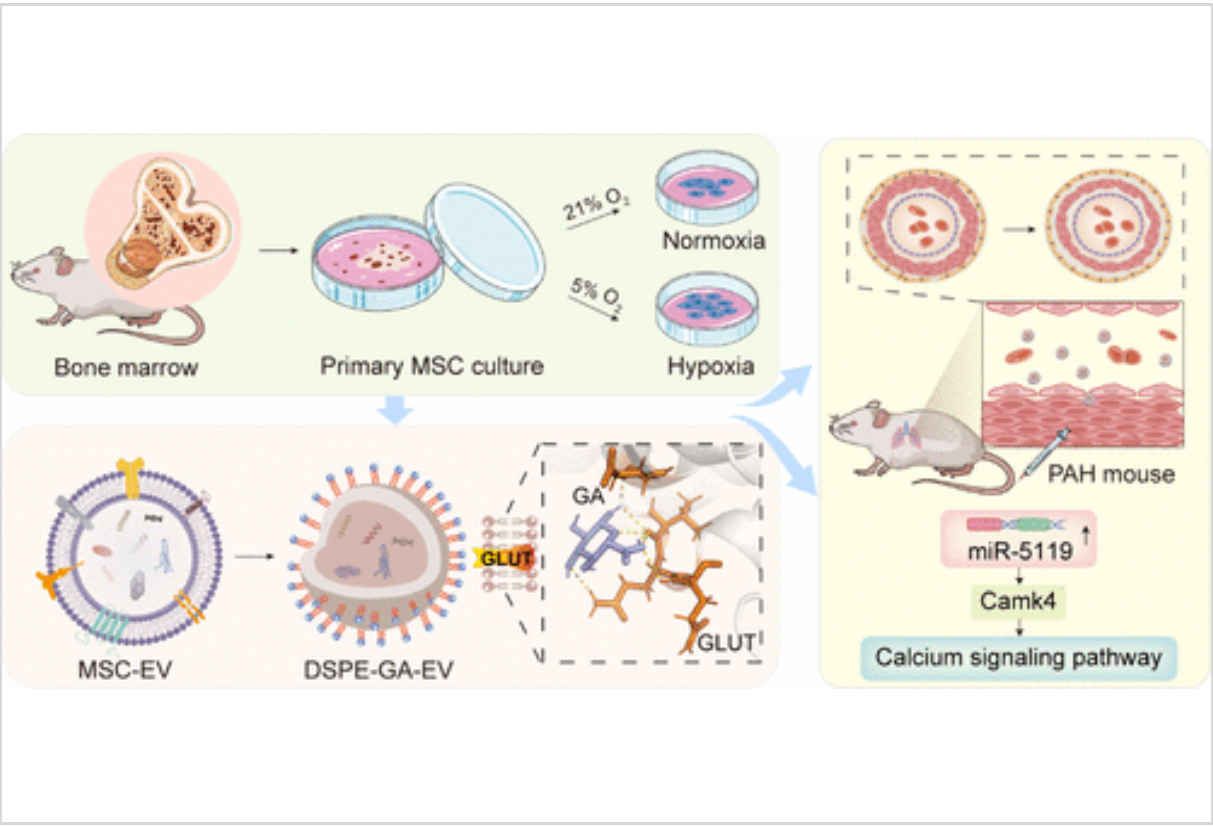
肺动脉高压(PAH)是一种以肺动脉压力升高和心血管功能障碍为特征的致命性疾病。尽管现有的药物治疗已在一定程度上缓解了症状,但仍难以从根本上逆转肺血管重塑等病理变化。近年来,细胞外囊泡(EVs)作为一种新兴的治疗工具,因其在细胞间通讯、靶向递送和抗炎作用等方面的潜力,引起了广泛关注。然而,如何精确地将EVs递送至靶向病灶,尤其是针对PAH的治疗,依然是科学研究中的一大挑战。
低氧诱导与葡萄糖醛酸修饰:提升治疗效果
最新的研究提出了一种创新的EVs递送策略,通过低氧诱导和葡萄糖醛酸(GA)修饰的间充质基质细胞来源的EVs(MSC-EVs)来增强其功能性和治疗靶向性。研究人员发现,低氧环境能够显著改变EVs的性质,并赋予其更强的治疗效果。在低氧诱导的条件下,间充质基质细胞(MSC)分泌的EVs(即Hypo-EVs)展示了比常氧条件下分泌的EVs(Norm-EVs)更为丰富的外泌体标志物,表现出更强的抗增殖效果,尤其对肺动脉平滑肌细胞(PASMCs)增殖的抑制作用更为显著。
GA修饰的EVs实现精准靶向
为了进一步提高EVs的靶向性,研究人员对低氧诱导的EVs进行了葡萄糖醛酸(GA)修饰。GA是一种在体内参与糖代谢的分子,其能够与过表达的葡萄糖转运蛋白1(GLUT1)特异性结合,GLUT1在PAH患者的PASMCs中显著上调。通过在EVs外膜上引入GA,研究团队成功实现了对过度表达GLUT1的PASMCs的精准靶向递送。这一策略不仅提高了EVs的靶向性,还有效增强了其治疗效果。
在体外实验中,GA修饰的EVs(GA-EVs)显著抑制了PASMCs的增殖,并减轻了血管重塑的程度。而在体内的动物模型中,GA-EVs也表现出了更为显著的疗效,能够有效改善PAH小鼠模型的肺动脉压力和心功能指标。研究人员认为,GA-EVs通过优化靶向递送,使得治疗剂量得以集中在病变区域,减少了药物在非靶组织的分布,从而提高了治疗的安全性和效果。
miR-5119:PAH治疗的新关键分子
除了GA修饰带来的靶向效果,研究还进一步探讨了GA-EVs在PAH治疗中的分子机制。研究发现,GA-EVs能够调节PAH相关的钙信号通路,其中miR-5119作为关键分子,参与了这一过程的调控。miR-5119在PAH小鼠模型中显示出下调趋势,而GA-EVs则能够通过恢复miR-5119的表达,调节细胞内钙离子的稳态,进而减轻肺动脉平滑肌细胞的异常增殖和血管重塑。研究人员认为,miR-5119的介导作用可能是GA-EVs疗效优越的关键因素之一。
展望未来:MSC-EVs为PAH治疗提供新希望
这项研究的成果为PAH的治疗提供了新的思路和策略。通过低氧诱导与GA修饰的MSC-EVs,不仅实现了对肺动脉平滑肌细胞的精准靶向递送,还显著提高了治疗效果,尤其是在血管重塑的干预方面。此外,miR-5119的发现为PAH的分子机制提供了新的视角,也为未来开发靶向PAH的治疗方法提供了重要依据。
尽管这项研究取得了显著进展,但如何将这一策略从实验室转化为临床应用,仍然面临许多挑战。未来的研究将需要进一步验证GA-EVs在不同PAH亚型中的疗效,并优化其生产和制备工艺,以确保在临床治疗中能够稳定、高效地使用。此外,如何克服免疫系统对外源EVs的识别和清除,也将是下一步研究的重要方向。
总体而言,MSC-EVs作为一种新型的治疗工具,展示了其在PAH治疗中的巨大潜力。随着更多基础研究的深入,基于细胞外囊泡的治疗方法有望为PAH患者带来更多的治疗选择和更长的生存期,也为其他难治性疾病的治疗开辟了新的道路。
结语
这项研究不仅为PAH治疗提供了突破性的创新策略,也为细胞外囊泡在疾病治疗中的应用提供了更多的可能性。随着技术的不断进步和临床试验的开展,基于MSC-EVs的治疗方法有望成为未来抗PAH治疗的重要组成部分,推动临床医学的发展,并为广大患者带来新的希望。
原始出处:
Zhu Q, Mao X, Zhu X, Xiao Y, Xu H, Su L, Liu X, Huang X, Wang L. Hypoxia-Induced and Glucuronic Acid-Modified Extracellular Vesicles from Mesenchymal Stromal Cells Treat Pulmonary Arterial Hypertension by Improving Vascular Remodeling. Nano Lett. 2024 Dec 11. doi: 10.1021/acs.nanolett.4c04638. Epub ahead of print. PMID: 39660764.


