Nature Genetics:破解免疫疗法耐药的关键:非小细胞肺癌中的微环境新发现
时间:2024-12-13 16:00:48 热度:37.1℃ 作者:网络
引言
近年来,癌症免疫治疗的兴起为多种恶性肿瘤的治疗带来了新的希望,其中免疫检查点抑制剂(Immune Checkpoint Blockade, ICB)显著改变了非小细胞肺癌(Non-Small-Cell Lung Cancer, NSCLC)的治疗格局。作为一种革命性疗法,ICB通过激活患者自身的免疫系统对抗肿瘤,不仅延长了患者的生存期,还实现了部分晚期患者的长期缓解。然而,尽管这项疗法备受瞩目,其效果却因人而异。临床数据显示,许多患者对ICB疗法的反应有限,甚至表现出完全的耐药性。这种差异引发了关于肿瘤微环境(Tumor Microenvironment, TME)和耐药机制的深入探索。
NSCLC作为全球癌症相关死亡的主要原因之一,其复杂的肿瘤微环境由多种免疫细胞、基质细胞和信号分子共同构成。在这一动态生态系统中,不仅包含调节免疫反应的T细胞,还涉及癌症相关成纤维细胞(Cancer-Associated Fibroblasts, CAFs)、巨噬细胞以及三级淋巴结构(Tertiary Lymphoid Structures, TLSs)等。研究发现,某些CAF亚型通过分泌特定蛋白质影响胶原纤维的沉积与排列,阻碍T细胞渗透,从而形成免疫抑制性屏障。同时,TLS的状态和成熟度也与治疗反应密切相关,这些结构在肿瘤免疫微环境中的形成与功能为治疗效果提供了关键线索。
12月10日Nature Genetics的研究报道“Multi-omic profiling highlights factors associated with resistance to immuno-chemotherapy in non-small-cell lung cancer”通过结合单细胞转录组测序(scRNA-seq)和空间转录组学等多组学技术,首次系统性揭示了NSCLC患者接受免疫化疗前后肿瘤微环境中细胞组成和空间分布的动态变化。研究团队不仅精确定义了与治疗结果相关的癌细胞状态,还描绘了CAF亚型在肿瘤边界的空间分布,并深入分析了TLS在不同患者中不同成熟阶段的作用。研究发现,某些CAF亚型和TLS状态能够显著预测患者对ICB疗法的反应,为未来个性化免疫治疗方案的制定提供了新思路。这一研究的突破性成果,不仅为揭示ICB疗法的耐药机制提供了全新视角,还为提高NSCLC患者的治疗效果指明了方向。

非小细胞肺癌(Non-Small-Cell Lung Cancer, NSCLC)是全球癌症相关死亡的主要原因之一。近年来,免疫检查点抑制剂(Immune Checkpoint Blockade, ICB)的出现为NSCLC患者带来了全新的治疗选择。这类药物通过阻断肿瘤逃逸机制,重新激活功能耗竭的T细胞,从而提高患者的生存率。然而,ICB疗法的疗效存在显著差异,统计显示,其联合化疗的平均反应率为32%(18%-63%)。这种差异揭示了肿瘤微环境(Tumor Microenvironment, TME)在治疗效果中的关键作用,并引发了对耐药机制的深入研究。
近年来,随着多组学技术的进步,研究人员能够以细胞层面的精度分析NSCLC的肿瘤微环境。单细胞RNA测序(scRNA-seq)和空间转录组学的联合应用,不仅揭示了TME内多种细胞的动态变化,还明确了这些变化如何直接影响患者对免疫疗法的反应。这些技术突破首次将肿瘤边界的物理屏障、免疫抑制微环境的形成机制与患者的治疗反应紧密联系,为精准治疗奠定了基础。
破解耐药之谜:肿瘤微环境中的关键角色
TME是肿瘤生长和免疫逃逸的核心舞台,涵盖多种免疫细胞、基质细胞和分泌因子。治疗前,耗竭的CD8+ T细胞失去活性,而癌症相关成纤维细胞(Cancer-Associated Fibroblasts, CAFs)通过分泌大量胶原蛋白形成物理屏障,阻止免疫细胞的渗透。治疗后的研究则进一步揭示了这些细胞在疗效差异中的深层作用。
多组学分析发现,ICB疗法前后的TME变化是决定治疗效果的关键因素。在治疗后,非应答患者的单核细胞和巨噬细胞比例显著增加,而应答患者的恶性上皮细胞几乎完全消除。这种差异不仅为未来抗肿瘤策略提供了明确方向,也提示了优化TME的可能路径。
此外,免疫抑制现象往往由细胞间复杂的交互作用驱动,包括CAFs在代谢调节中的作用、低氧条件下信号通路的激活以及免疫检查点通路的动态变化。理解这些机制是攻克免疫治疗耐药性的核心。
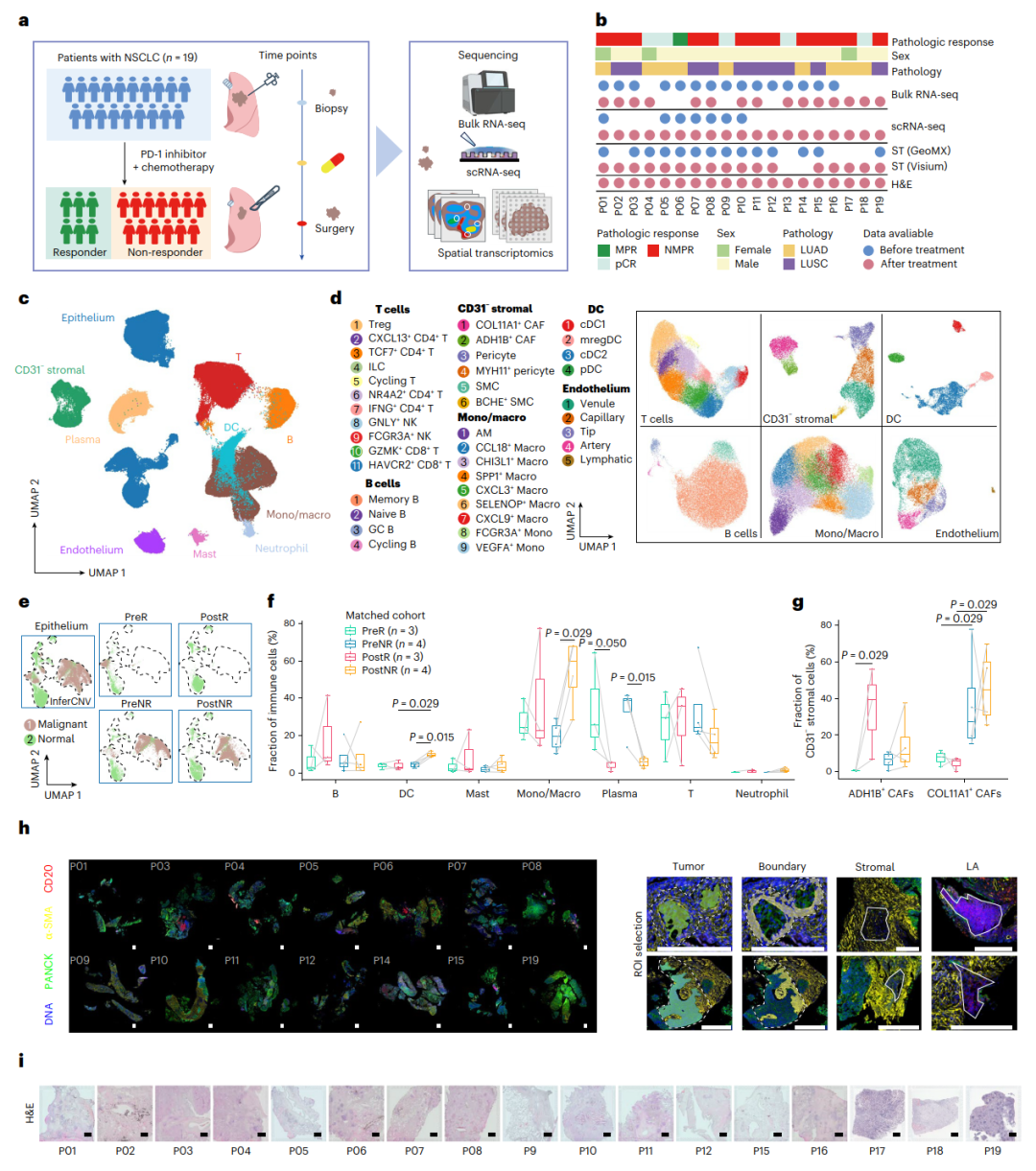
多层次分析全面展示了ICB-化疗前后NSCLC肿瘤微环境的动态变化及其与应答和非应答的关系(Credit: Nature Genetics)
研究设计的工作流程:图a概述了研究方法,包括如何利用单细胞RNA测序(scRNA-seq)和空间转录组学(ST)技术,系统分析NSCLC患者在接受免疫检查点抑制剂联合化疗前后的组织变化。
样本信息与数据情况:图b列出了参与研究的患者样本信息,并通过标记说明了每种分析方法的适用性。不同患者的组织样本用于特定的测序或空间分析。
细胞种类的分布:图c以UMAP图形式展现了232,080个细胞的主要细胞类型,包括免疫细胞、基质细胞和肿瘤细胞等,为NSCLC组织的细胞组成提供了全景式视图。
亚群细胞的解析:图d进一步细化了主要细胞类型的亚群分布,例如T细胞、B细胞、单核细胞/巨噬细胞等,分别以颜色编码显示不同亚型的分布模式。
上皮细胞状态分析:图e通过UMAP图区分了正常上皮细胞和恶性肿瘤细胞(分别用绿色和棕色表示),揭示了肿瘤微环境中细胞的病理学特征。
免疫细胞分布的动态变化:图f展示了免疫细胞亚型在三位应答者和四位非应答者中基线和治疗后的变化。结果通过箱线图呈现,显示了治疗后应答患者的CD8+ T细胞比例显著上升,而非应答者则未见类似改善。
基质细胞亚型的动态变化:图g以箱线图显示了基质细胞中成纤维细胞亚型的分布,强调了COL11A1+成纤维细胞在非应答患者中的富集现象及其在治疗后持续存在的趋势。
空间转录组学的区域选择:图h结合NanoString GeoMx DSP技术,分析了治疗前样本的不同区域,包括肿瘤核心、肿瘤边界和远离肿瘤的区域。这些空间区域的分析为理解肿瘤微环境提供了新的角度。
组织学染色与空间定位:图i展示了接受免疫治疗的患者样本的H&E染色和Visium平台下的空间转录组数据,这些组织图像和基因表达的结合,进一步揭示了肿瘤与周边微环境的复杂交互。
癌症相关成纤维细胞(CAFs):隐藏的屏障
CAFs是TME中的重要参与者,依据功能可以划分为多个亚型。其中,表达胶原XI型α1链(COL11A1)的CAFs(COL11A1+ CAFs)在非应答患者中显著富集(47% vs 21%,P = 0.029)。COL11A1+ CAFs通过与肿瘤细胞上的胶原受体DDR1相互作用,促进胶原纤维的排列,从而增强肿瘤边界的屏障功能。
免疫荧光实验进一步验证了COL11A1+ CAFs与DDR1+肿瘤细胞的高水平共定位(P < 0.01)。这一发现通过空间转录组学数据得到支持,显示DDR1-COL11A1轴在调控免疫抑制中起关键作用。此外,这些CAF在侵袭边界区域的高度聚集与免疫细胞渗透的显著减少密切相关。这些发现不仅揭示了CAF的核心功能,还提供了潜在的治疗靶点。
从基因表达的角度看,COL11A1+ CAFs富集了与缺氧反应和糖酵解相关的基因模块,如HIF1A和ENO1。高表达的HIF1A可能增强肿瘤适应缺氧环境的能力,同时削弱免疫细胞的活性。这些CAF的双重作用进一步巩固了其作为治疗干预焦点的潜力。
胶原纤维的秘密:肿瘤边界的免疫屏障
胶原纤维的沉积与排列是形成免疫屏障的重要机制之一。通过空间转录组学和免疫荧光实验,研究发现,非应答患者的肿瘤边界胶原纤维显著增多,同时T细胞的渗透能力显著降低。
特别是,COL11A1+ CAF通过胶原纤维的堆积,与肿瘤细胞形成了一个“物理屏障”,阻止了CD8+ T细胞的有效侵入。进一步的空间分析显示,这些CAF在肿瘤核心和侵袭边界区域富集程度显著高于基质区域,而在治疗后应答患者中,这些区域的免疫屏障有所减弱。利用纳米级显微成像技术,研究团队确认了胶原纤维排列与DDR1表达的直接关联,这一发现为改善T细胞渗透提供了新的视角。
三级淋巴结构(TLSs):免疫微环境的“指挥中心”
三级淋巴结构(Tertiary Lymphoid Structures, TLSs)在调节抗肿瘤免疫中发挥关键作用。研究显示,激活状态的TLSs(高IL7R表达)通过促进T细胞和B细胞的活化,显著改善患者的治疗预后(P = 0.029)。相比之下,非应答患者的TLSs表现出衰退特征,包括高水平的低氧应答基因(如HIF1A和ENO1)表达(非应答患者HIF1A表达水平较应答患者高2.3倍,P < 0.05)。
通过空间转录组学分析,研究进一步揭示了TLS分布与微环境状态的紧密关联。TLS在低氧区域的活化水平显著降低,而在氧供充分的侵袭边界区域,TLS表现出更高的成熟度。结合基因表达分析,这些发现不仅深化了我们对TLS功能的理解,还为未来靶向TLS的治疗策略提供了清晰方向。
从空间看微环境:细胞分布的关键线索
空间转录组学技术为精确描绘TME中细胞分布提供了强大工具。研究显示,肿瘤核心由恶性细胞主导,而侵袭边界是免疫细胞、CAFs和其他基质细胞的主要活动区域。治疗后,应答患者的CD8+ T细胞比例显著提高,而非应答患者的巨噬细胞比例则明显上升。
此外,TLS与其他免疫组分的空间关联为研究提供了新的线索。高密度TLS通常与CD8+ T细胞共定位,而在低氧区域,TLS的数量和活性显著下降。这种空间特征不仅为治疗耐药的解释提供了依据,也为优化免疫治疗策略提供了方向。
应对挑战:肿瘤微环境的“动态改造”
克服ICB疗法的耐药性是肿瘤免疫学的主要挑战之一。研究表明,TGFβ抑制剂可以通过减少COL11A1+ CAF活性,降低肿瘤边界的免疫屏障强度;同时,氧供改善疗法通过缓解低氧环境,增强TLS成熟度。此外,靶向特定基质组分的纳米药物在前期研究中显示出较高的潜力,可能成为未来重要的治疗方案。通过这些创新疗法的整合,研究人员不仅希望提高ICB疗法的有效性,还可能为未应答患者带来更高的缓解率。
综上,该研究为揭示ICB疗法在NSCLC治疗中的耐药机制提供了重要见解,同时为个性化治疗开发奠定了基础。未来,通过多组学技术的不断进步,有望进一步解码TME的复杂动态,为每位患者设计精准治疗方案。
参考文献
Yan, Y., Sun, D., Hu, J. et al. Multi-omic profiling highlights factors associated with resistance to immuno-chemotherapy in non-small-cell lung cancer. Nat Genet (2024). https://doi.org/10.1038/s41588-024-01998-y


