哈工程杨飘萍团队Nano Letters:双调制AIE-ESIPT光敏剂和UCNPs的共组装用于增强的NIR激发光动力治疗
时间:2024-12-13 16:00:44 热度:37.1℃ 作者:网络
光动力疗法(PDT)凭借其高选择性、低副作用、无创的治疗方式以及极低的耐药性,逐渐成为传统癌症治疗手段的一种极具潜力的替代方案。该疗法通过光激活光敏剂产生活性氧(ROS),从而引发癌细胞凋亡或坏死。此外,越来越多的研究表明,PDT能诱导免疫原性细胞死亡(ICD),从而激发针对肿瘤的免疫反应。因此,光敏剂的开发与研究迅速升温,成为研究热点。与无机光敏剂相比,有机光敏剂在生物相容性、结构可调性、成本效益以及更简化的批量合成工艺方面具有优势。然而,常见的有机光敏剂(如卟啉和氰基类化合物等),其分子结构中的通常具有扩展的π共轭结构,虽然它们在分散状态下具有高效的光发射和光敏活性,但在聚集时会不可避免的产生聚集荧光淬灭(ACQ)现象,导致荧光的消失和光敏活性的减弱。
聚集诱导发光(AIE)为克服有机光敏剂的局限性提供了一条极具前景的途径。由于独特的多转子扭曲结构,AIE光敏剂在分散状态下通过分子内运动等非辐射途径消耗激发态能量,因此不发光;当聚集时,这种能量耗散被有效抑制,从而表现出强烈的荧光发射以及优异的光敏活性。然而,目前大多数AIE光敏剂依赖可见光激发,由于可见光在生物体内穿透深度有限,这在一定程度上限制了其在临床上的应用。尽管已有若干近红外(NIR)激发的AIE光敏剂被开发,但由于可见光激发的AIE光敏剂在合成上的易得性和分子设计的独特性上仍具有优势,其研究仍是一个备受关注的方向。激发态分子内质子转移(ESIPT)是一种由分子内质子供体与受体间强氢键驱动的光化学现象。这一过程涉及激发态皮秒级的快速烯醇-酮转化,产生具有大斯托克斯位移特征的荧光发射,从而有效避免自吸收效应。结合ESIPT与AIE的协同效应,或将为设计高效光敏剂开辟新的可能性。
近期,哈尔滨工程大学杨飘萍团队开发了一系列具有双调制能力的AIE-ESIPT型有机光敏剂。通过引入可同时干扰吸电子能力和质子受体能力的氨基,或利用苯环作为π-桥构建D-π-A结构,实现了对AIE特性和ESIPT过程的精确调控。此外,采用一种基于两亲性聚合物的共组装策略,通过上转换纳米粒子(UCNPs)与光敏剂之间的Förster共振能量转移(FRET),实现了NIR激发的肿瘤光动力治疗(方案1)。光谱分析结合详细的理论计算表明,引入π-桥和氨基显著影响了分子激发态的构象变化以及ESIPT反应的能垒,这正是实现AIE特性与ESIPT发射双调制的关键因素。优化后的分子TPE-Ph-AQ显示出增强的AIEE特性和ESIPT发射以及最小化的单-三线态能隙(ΔEST)。利用FRET的高效能量传递,共组装的AIE PS@UCNPs纳米粒子在细胞和动物模型中均展现了优异的抗肿瘤效果。这项研究不仅提出了一种同时调控AIE特性与ESIPT过程的新策略,还为克服大多数有机光敏剂的激发波长限制提供了可靠的解决方案,为肿瘤光动力疗法的进一步发展提供了新思路。
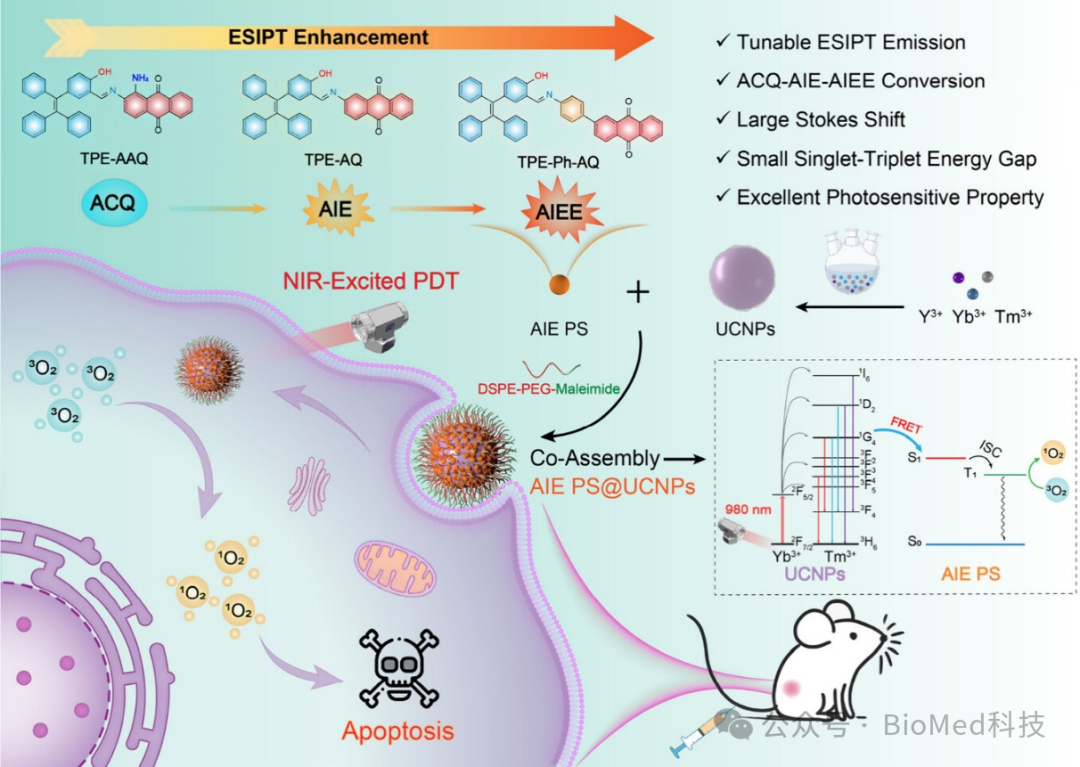
方案1 ESIPT和AIE双调制以及与UCNPs共同组装实现NIR激发PDT的示意图。
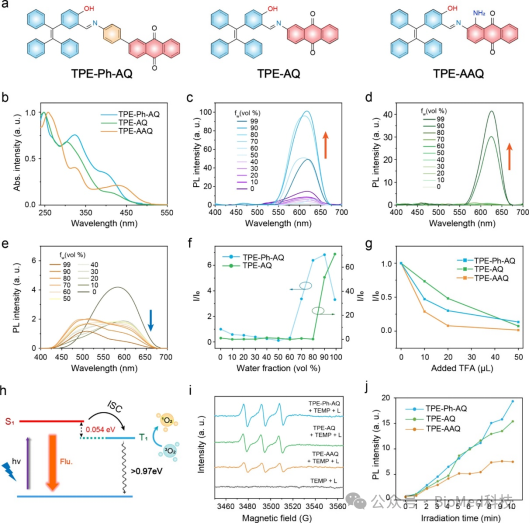
图1 (a) TPE-Ph-AQ、TPE-AQ和TPE-AAQ的分子结构。(b) TPE-Ph-AQ、TPE-AQ和TPE-AAQ在THF中的紫外−可见吸收光谱 (10−5 M)。(c-e) TPE-Ph-AQ、TPE-AQ和TPE-AAQ 在THF/水混合溶液中的荧光光谱 (10−5 M,365 nm激发)。(f) TPE-Ph-AQ和TPE-AQ的I/I0与水含量的关系图。(g) TPE-Ph-AQ、TPE-AQ和TPE-AAQ的I/I0与添加TFA量的关系图。(g) 1O2生成示意图。(i) TPE-Ph-AQ、TPE-AQ和TPE-AAQ的ESR光谱。(j) 用DCFH-DA作为指示剂定量检测TPE-Ph-AQ、TPE-AQ和TPE-AAQ产生的ROS。
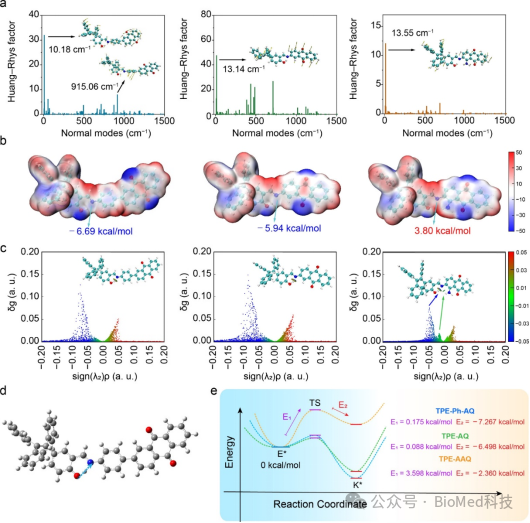
图2 (a) TPE-Ph-AQ、TPE-AQ和TPE-AAQ的Huang-Rhys因子和主要振动模式。(b) TPE-Ph-AQ、TPE-AQ和TPE-AAQ在基态结构中的分子表面静电势。(c) TPE-Ph-AQ、TPE-AQ和TPE-AAQ在S1态结构中的IGMH分析和等值面图。(d)TPE-Ph-AQ在ESIPT反应中的过渡态(TS)结构。(e) TPE-Ph-AQ、TPE-AQ和TPE-AAQ的ESIPT反应IRC曲线。
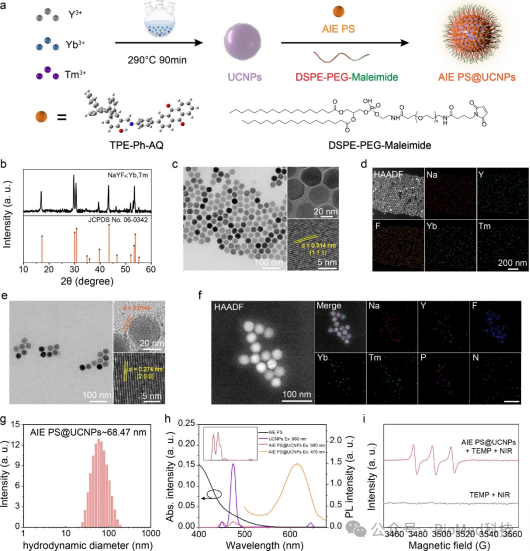
图3 (a)UCNPs和AIE PS@UCNPs的合成过程。(b) NaYF4:Yb,Tm的XRD谱图。(c) NaYF4:Yb,Tm的TEM和HRTEM图像。(d) NaYF4:Yb,Tm的HAADF-STEM和相应的元素分布。(e) AIE PS@UCNPs的TEM和HRTEM图像。(f) AIE PS@UCNPs的HAADF-STEM和相应的元素分布。(g) AIE PS@UCNPs的粒径分布。(h) AIE PS的归一化紫外−可见吸收光谱以及UCNPs(980 nm激发)和AIE PS@UCNPs(980 nm和476 nm激发)的归一化荧光光谱。(i) AIE PS@UCNPs的ESR光谱。
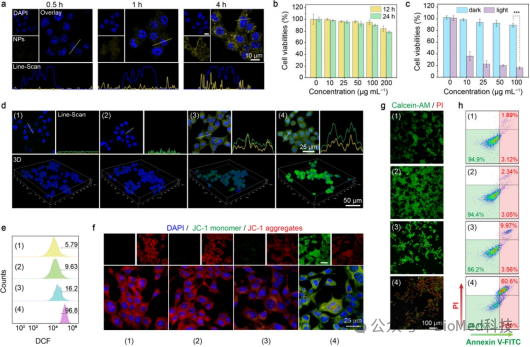
图4 体外抗肿瘤活性。(a)AIE PS@UCNPs培养不同时间的4T1细胞的CLSM图像。(b) L929细胞与不同浓度的AIE PS@UCNPs培养的细胞存活率。(c) 4T1细胞与不同浓度的AIE PS@UCNPs培养的光毒性评估。(d)细胞内ROS水平的CLSM图像以及AIE PS@UCNPs 和ROS的共定位分布。(e)流式细胞仪对ROS进行半定量分析。(f)不同处理后的JC-1染色图像。(g) 不同处理后的Calcein-AM/PI染色图像。(h) 不同处理后Annexin V-FITC/PI染色细胞的流式细胞术凋亡分析。
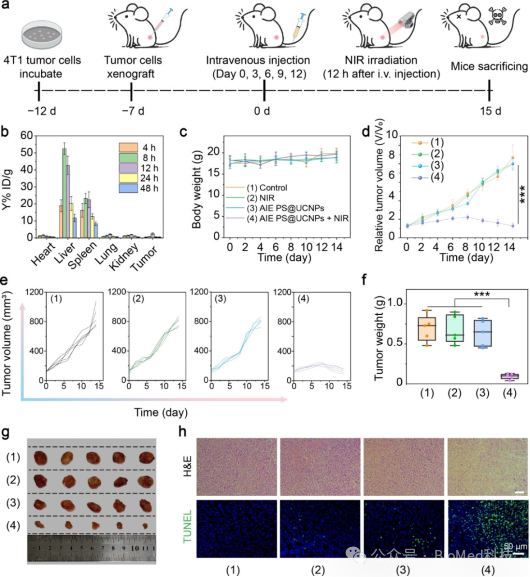
图5 体内抗肿瘤活性。(a) 在4T1荷瘤小鼠体内进行光动力治疗的过程示意图。(b) 静脉注射AIE PS@UCNPs后在主要器官和肿瘤中的生物分布。(c) 不同治疗组小鼠的体重变化。(d-f) 不同治疗组小鼠治疗14天后的肿瘤体积相对增长曲线、肿瘤体积变化和切除肿瘤重量。(g)不同治疗组切除肿瘤的照片。(h) 不同治疗组代表性小鼠肿瘤切片的H&E和TUNEL染色图像。
杨飘萍团队通过一种新颖的共组装策略,结合双调制AIE-ESIPT光敏剂与UCNPs,成功开发出NIR激发的光敏纳米粒子。研究表明,引入氨基或π-桥显著影响了分子的构象变化和能垒,这些因素与AIE特性和ESIPT过程密切相关。这项工作不仅提供了一种同时调控AIE特性和ESIPT过程的新方法,还提出了一种稳健的策略,有效解决了有机光敏剂激发波长受限的问题,从而进一步提升了AIE光敏剂在肿瘤治疗中的应用潜力。
相关工作以“Coassembly of Dual-Modulated AIE-ESIPT Photosensitizers and UCNPs for Enhanced NIR-Excited Photodynamic Therapy”为题发表在Nano Letters上。哈尔滨工程大学杨飘萍教授、冯莉莉副教授,解放军总医院许荣宸副主任医师为本文通讯作者。
原文链接:
https://pubs.acs.org/doi/10.1021/acs.nanolett.4c05497


