一文盘点|乳腺癌内分泌治疗的常用药和用药策略
时间:2024-12-13 09:00:19 热度:37.1℃ 作者:网络
内分泌治疗在乳腺癌的治疗中扮演着重要的角色,不仅能够有效降低早期乳腺癌的复发风险,还能显著延长转移性乳腺癌(MBC)的无进展生存期(PFS)。其治疗过程相对温和,对患者的生活质量影响较小。对于HR+晚期乳腺癌的治疗,国内外指南均指出:内分泌治疗是HR+晚期乳腺癌的治疗基石。即使存在内脏转移,以内分泌为基础或联合治疗依然是优选治疗方案。

中国抗癌协会乳腺癌诊治指南与规范 (2024简要版)
根据作用机制的不同,内分泌治疗药物可划分为五大类别:选择性雌激素受体调节剂(SERM)、卵巢功能抑制剂(OFS)、芳香化酶抑制剂(AI)、选择性雌激素受体下调剂(SERD)以及性激素类药物。以下是对这五种药物的详尽介绍,包括其作用机制、代表药物及临床应用阶段。
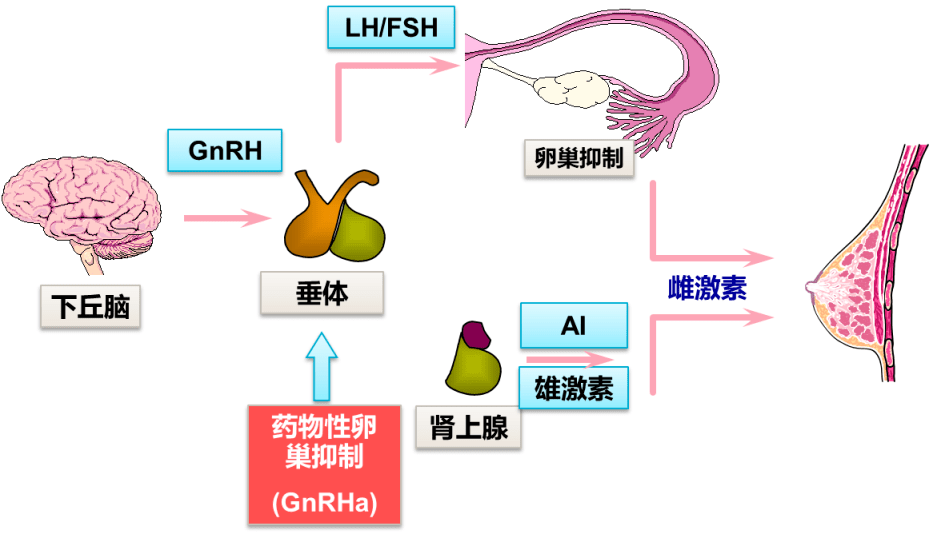
1.乳腺癌内分泌治疗常用药物
01 选择性雌激素受体调节剂(SERM)
代表药物:他莫昔芬(TAM)、托瑞米芬
作用机制:这些药物的结构与雌激素相似,能够与雌二醇在细胞内竞争雌激素受体,形成稳定的复合物并转运至核内,从而耗尽胞内雌激素受体,阻断雌二醇的体内吸收,抑制雌激素依赖性的乳腺癌生长。
临床应用:
他莫昔芬:自1978年获FDA批准以来,已广泛应用于各期乳腺癌的治疗,无论患者是否绝经。但需注意其可能导致的静脉血栓形成和子宫内膜癌风险,尤其是长期用药、绝经后状态及阴道不规则出血的患者。建议每12个月进行一次妇科检查,并根据危险因素调整监测频率。绝经后患者若子宫内膜增厚超过8mm,应考虑进行子宫内膜活检。
托瑞米芬:适用于早期和晚期雌激素阳性的乳腺癌患者,可作为他莫昔芬的替代品,尽管其导致子宫内膜病变的发生率较低,但仍需长期监测。
02 卵巢功能抑制剂(OFS)
代表药物:戈舍瑞林、亮丙瑞林
作用机制:作为合成的促黄体生成素释放激素类似物,OFS能够阻止垂体产生促卵泡激素和促黄体生成素,从而减少卵巢分泌雌激素。
临床应用:主要用于绝经前的乳腺癌患者,以确保年轻女性的雌激素水平被抑制至绝经状态。临床上常与SERM和AI类药物联合使用。
03 芳香化酶抑制剂(AI)
代表药物:阿那曲唑、来曲唑、依西美坦
作用机制:AI通过抑制芳香化酶的活性,阻断雌激素的合成,从而抑制乳癌细胞的生长。根据化学结构的不同,AI可分为甾体类和非甾体类,目前临床上常用的阿那曲唑和来曲唑属于非甾体类,依西美坦则属于甾体类,三者均属于第三代AI。
临床应用:主要用于绝经后的乳腺癌患者,安全性良好。但需注意长期服用可能导致骨质疏松和关节疼痛等不良反应。建议用药前后及用药期间常规进行骨密度监测,并根据T评分结果采取相应的治疗措施。
04 选择性雌激素受体下调剂(SERD)
代表药物:氟维司群
作用机制:氟维司群通过与雌激素受体结合,导致受体主要功能基团失活,并引起受体降解及信号通路的阻断,从而减少雌激素和孕激素受体在细胞水平的表达,阻止或延缓内分泌治疗的耐药。
临床应用:氟维司群是TAM或AI治疗失败后绝经后晚期乳腺癌的一线标准内分泌治疗药物。但因其生物利用度问题,需通过臀部肌注给药,可能导致注射部位反应。近年来,口服SERD抑制剂的研发取得了突破,其中Stemline Therapeutics的Orserdu成为首款获得FDA加速批准的口服SERD抑制剂。
05 性激素类药物
代表药物:甲地孕酮
作用机制:孕激素能够阻滞下丘脑促性腺激素释放素,从而减少促卵泡激素和促黄体生成素的水平,并诱导肝α-还原酶提升雄激素的降解速率,抑制雌激素的合成。
临床应用:主要用于晚期转移性乳腺癌的姑息治疗,特别是在上述四种作用机制的药物耐药后,可作为治疗方案的选择之一。
国内外指南均明确指出,对于激素受体阳性、无病间期较长、肿瘤进展缓慢、无症状或轻微症状内脏转移的晚期乳腺癌患者,应首选内分泌治疗而非化疗。
2.乳腺癌内分泌治疗药物的选择
在制定乳腺癌内分泌治疗方案时,医生需全面考量患者的个体化特征,包括绝经状态、疾病阶段与复发风险、个人偏好及药物耐受性,以精准匹配最适合的治疗策略。
01 核心考量因素:
1.绝经状态:
绝经前患者:可能受益于卵巢功能抑制(如使用促黄体生成素释放激素类似物)或选择性雌激素受体调节剂(如他莫昔芬)。
绝经后患者:更适宜采用芳香化酶抑制剂(AI,如来曲唑、阿那曲唑、依西美坦)或选择性雌激素受体下调剂(如氟维司群)。
2.疾病分期与复发风险:
早期乳腺癌:术后内分泌治疗以降低复发风险
晚期或转移性乳腺癌:内分泌治疗作为主要或联合治疗手段。
3.患者偏好与耐受性:
副作用差异:AI可能导致骨质疏松和关节疼痛,而他莫昔芬可能增加子宫内膜增厚和血栓风险。
个性化选择:基于患者偏好和耐受性调整治疗方案。
4.耐药性:
出现耐药时,需调整药物类别或采用其他治疗策略。
02 治疗策略细化:
1.绝经前患者:
初始治疗:
淋巴结阴性且低风险:他莫昔芬治疗5年。
淋巴结阳性(1-3个)或无其他危险因素,或淋巴结阴性但存在高危因素:推荐OFS+他莫昔芬或OFS+AI治疗5年。
淋巴结阳性≥4个:OFS+AI治疗5年,高危患者可加用CDK4/6抑制剂阿贝西利。
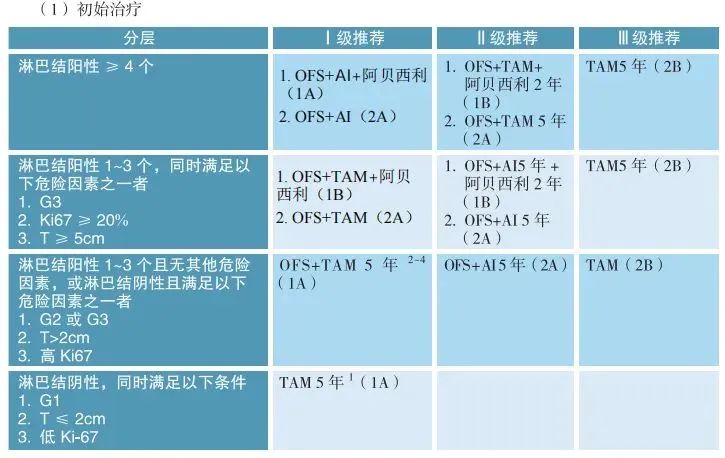
特定情境建议:
即将绝经患者:根据淋巴结状态和肿瘤分级,考虑卵巢切除术后使用AI或先TAM后AI治疗。
强化治疗:
满足特定条件(如淋巴结阳性、组织学三级等)且初始治疗耐受良好的患者,可考虑延长内分泌治疗。
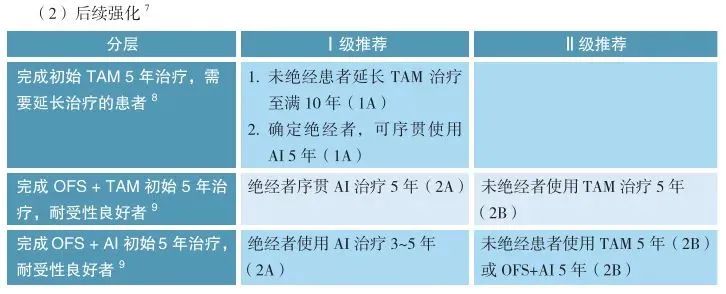
2.绝经后患者:
初始治疗:
推荐AI治疗5年,AI禁忌者可选他莫昔芬。
高危患者(如淋巴结阳性≥4个或存在其他高危因素):标准内分泌治疗联合阿贝西利。
他莫昔芬治疗中可换用AI。
低危患者AI治疗5年后可停药。
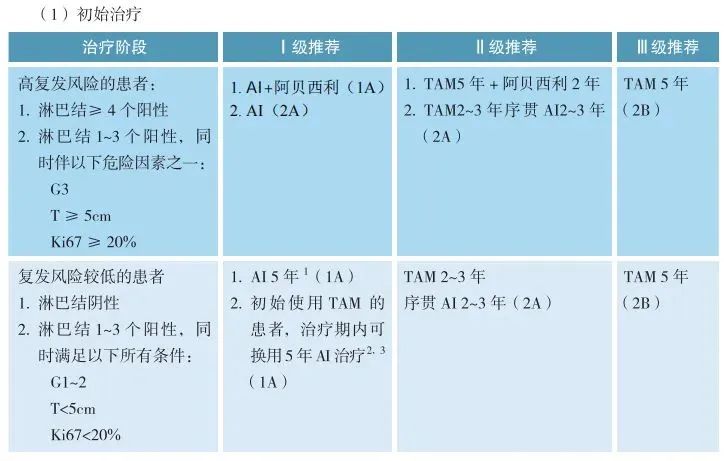
强化治疗:
满足特定条件(如淋巴结阳性、组织学三级、Ki67>30%等)且AI治疗耐受良好的患者,可考虑延长AI治疗或换用他莫昔芬。

总结
乳腺癌内分泌治疗方案的制定需基于患者全面的个体化评估,结合最新的临床指南和专家意见,以确保治疗的有效性和安全性。在实际操作中,医生应灵活调整治疗方案,以满足患者的具体需求和偏好。
参考文献:
[1]中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会 (CSCO) 乳腺癌诊疗指南 2024[M]. 北京: 人民卫生出版社, 2024.
[2]Postoperative Adjuvant Anastrozole for 10 or 5 Years in Patients With Hormone Receptor-Positive Breast Cancer: AERAS, a Randomized Multicenter Open-Label Phase III Trial.J Clin Oncol. 2023 Apr 20. IF: 50.717.
[3]张少华, 王晓稼, 江泽飞, 等. 乳腺癌内分泌治疗专家共识(2023 版)[J] . 中华医学杂志, 2023, 103(38): 2993-3001.
[4]国家肿瘤质控中心乳腺癌专家委员会, 中国抗癌协会肿瘤药物临床研究专业委员会. CDK4/6 抑制剂治疗激素受体阳性人表皮生长因子受体 2 阴性乳腺癌临床应用专家共识 (2023 版)[J]. 中华肿瘤杂志, 2023, 45(12):1003-1017.


