Nature Methods:多供体视角下的神经发育研究:脑类器官技术的革命性突破
时间:2024-12-13 06:03:51 热度:37.1℃ 作者:网络
引言
在大脑的微观世界中,隐藏着人类智慧、感知与情感的奥秘。然而,这一复杂结构的发育和功能如何受到遗传变异的影响,仍是研究人员长期探讨的谜题。随着多能干细胞(pluripotent stem cells, PSCs)技术的发展,脑类器官(cortical brain organoids, CBOs)成为研究人类神经发育的前沿工具,为揭示这些深奥问题提供了前所未有的机会。
脑类器官的独特优势在于其能模拟人类大脑皮质的三维发育过程,从放射状胶质细胞到兴奋性和抑制性神经元的转变,几乎涵盖了神经系统的关键阶段。然而,传统的研究模式常常局限于单一供体,无法充分展现遗传多样性对神经发育的深远影响。而多供体的研究模式不仅为大规模神经精神疾病建模提供了新路径,也为探索个体化医学的潜力铺平了道路。
12月9日Nature Methods的研究报道“Multiplexing cortical brain organoids for the longitudinal disp of developmental traits at single-cell resolution”,聚焦于两种创新性策略:嵌合类器官(mosaic organoids)和下游多重化(downstream multiplexing)。这两种方法突破了实验和分析的传统限制,使得研究人员能够在单细胞分辨率下同时观察多个遗传背景对神经发育的影响。结合高精度的计算工具,这些方法为解析细胞间的动态交互和遗传-环境协同效应提供了革命性手段。
神经系统的复杂性并不仅仅是遗传编码的结果。它还深受环境、细胞通讯和发育信号的调控。通过多重化策略,不仅能捕捉这些动态变化,还能在模拟多遗传背景的实验中发现隐藏的分子机制。该研究的意义不仅在于推动基础科学的发展,更在于为神经疾病的诊断、治疗以及药物筛选提供崭新的视角。

人类神经系统的多样性和复杂性既是科学的谜题,也是神经精神疾病研究的核心。遗传变异如何塑造神经发育的分子轨迹,以及环境因素如何与遗传背景交互,仍是尚未解决的重大科学问题。脑类器官作为一种基于多能干细胞(pluripotent stem cells, PSCs)的三维体外模型,能够精准模拟大脑皮质的发育过程,涵盖从放射状胶质细胞到成熟神经元的完整分化路径。这种技术在解析孤独症、精神分裂症等疾病的病理机制方面展现了巨大潜力。
然而,传统研究主要聚焦于单个或少数供体,未能充分反映遗传多样性在神经发育中的作用。多重化策略的引入,通过在多供体水平实现脑类器官的高通量生成和分析,使得研究从单一案例迈向群体规模化探索。这种拓展不仅为大规模神经疾病建模提供了新的可能性,也为精准医学和基因功能研究带来了深远影响。
此外,随着单细胞测序技术和生物信息学的快速发展,研究人员得以捕获细胞间动态变化并重建发育轨迹。通过结合类器官模型与高分辨率数据,遗传与环境的交互作用得以在细胞水平上全面解析。
嵌合类器官(Mosaic Organoids)
嵌合类器官的核心在于将多个供体的PSC按等量混合,通过三维共培养生成包含不同遗传背景细胞的类器官。这种方法旨在研究不同基因型在共同微环境下的表现差异,尤其适合解析细胞间相互作用。
实验流程包括:将多供体PSC按等量比例混合,诱导生成类器官;在分化的50天、100天和300天对类器官进行取样,并通过单细胞RNA测序(scRNA-seq)分析细胞组成和发育轨迹;通过基因型标记追踪每个供体细胞在发育过程中的比例和行为。
实验结果显示,在50天时,各供体细胞的贡献比例保持在35%-40%,但至300天时,某些供体细胞比例显著下降至不足20%,揭示了遗传背景对细胞存活及增殖的显著影响。在嵌合类器官中,WNT和NOTCH信号通路的动态激活模式被明确与基因型相关联,体现了遗传-环境交互的复杂性。
优势与应用场景:能够捕获不同基因型细胞在相同环境下的行为差异;提供了探索细胞间竞争、协同作用及非细胞自主效应的理想平台。
下游多重化(Downstream Multiplexing)
下游多重化策略通过在类器官生成后,将来自不同供体的类器官解离并混合,再进行单细胞测序。与嵌合策略不同,下游多重化关注供体特异性的发育轨迹,适合研究单一遗传背景的独特表现。
实验流程包括:各供体的PSC独立生成类器官;在解离细胞后按等比例混合并进行单细胞RNA测序;基于遗传标记对细胞来源进行溯源分析。
其基因型分类准确率达97%以上。实验中,供体细胞的增殖趋势在早期高度一致,但在晚期分化阶段表现出显著差异。例如,某些供体的神经元迁移能力明显优于其他供体。
优势与应用场景:适用于需严格控制供体间比例的研究。特别适合解析供体特异性效应以及遗传背景对发育轨迹的独立影响。
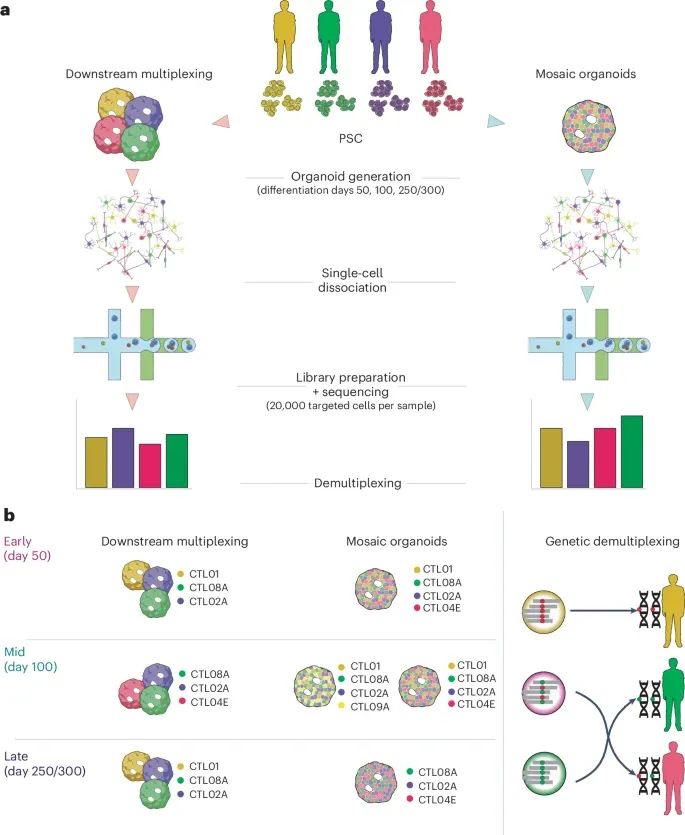
多重化实验策略及设计(Credit: Nature Methods)
多重化策略的架构:
下游多重化(Downstream multiplexing):从不同供体来源的多能干细胞(PSCs)单独生成类器官,然后将这些类器官在单细胞解离后按等比例混合。实验后期进行文库制备、测序和解多重化分析。
嵌合类器官(Mosaic organoids):在类器官生成的早期阶段,将多个供体来源的PSCs按等量混合,直接生成包含多遗传背景的嵌合类器官。这些类器官在单细胞解离后,同样经历文库制备、测序和解多重化。
实验设计的概览:
不同分化时间点(如50天、100天、300天)的类器官被选取,用于比较两种策略的效果。
每个时间点有多个实验重复(replicates),以提高实验的统计可靠性。
使用多种供体的PSCs(代表不同基因型),确保结果具有广泛的适用性。
解多重化方法的应用:
描述了通过遗传标记溯源每个细胞的供体来源,以及两种多重化策略在数据采集和基因型解析中的流程。
技术创新与计算工具
为了提高多重化策略的准确性和可靠性,研究团队开发了全新的计算工具SCanSNP。该工具优化了单细胞数据的基因型分类及双细胞检测,显著提升了解析能力。
身份分配:SCanSNP采用两阶段分析方法,将细胞身份分配与双细胞(doublets)检测分开处理,极大减少了低质量数据的影响。
性能优势:与传统算法相比,SCanSNP在低质量细胞检测上的准确率提升了50%;集成了demuxlet、souporcell和Vireo等算法,基因型分类的总体准确率达到98%以上。
研究团队同时开发了新的质量控制模块,以确保在复杂实验条件下数据的高可靠性。
神经发育的细胞组成
通过单细胞RNA测序,研究人员确认了CBOs在多重化策略下的细胞分化特征:放射状胶质细胞(Radial glia):早期占比高达35%,标志基因为PAX6、SOX2。
兴奋性神经元(Excitatory neurons):300天后占比增至40%以上,标志基因为NEUROD2、SLC17A7。
抑制性神经元(Inhibitory neurons):在中期显著增多,占比约20%,标志基因为DLX2、GAD1。
星形胶质细胞(Astrocytes):晚期分化阶段出现,占比逐渐上升,标志基因为GFAP和S100B。
神经发育轨迹与基因型影响
轨迹解析:通过伪时间(pseudotime)分析,明确了直接与间接神经元分化路径。这些路径受EOMES基因主导,反映了皮质发育的两阶段机制。
基因型作用:PCA分析显示,不同供体在神经元迁移轨迹上表现出显著分离。特定SNP(如SRCIN1相关)被识别为伪时间轨迹差异的主要驱动因子。
动态信号通路激活:嵌合类器官中观察到的WNT和NOTCH通路的激活受遗传差异调控,提供了基因型如何调节发育信号的新见解。
应用前景与扩展潜力
大规模疾病建模:嵌合类器官可将千条PSC系的研究时间从10年缩短至约3年,极大提高了实验效率。
遗传变异与表型关联:单细胞eQTL分析揭示了多个与神经发育相关的重要SNP位点,并为神经疾病的精准治疗提供了潜在靶点。
药物筛选与毒理学研究:通过模拟多供体遗传背景下的药物反应,显著提升了筛选效率和精准度。
多重化脑类器官的开发为研究人类神经发育与遗传多样性之间的关系提供了革命性平台。这一框架通过结合实验技术与计算工具,不仅扩展了脑类器官的规模化应用潜力,还为神经科学研究注入了新动能。未来,这些方法有望在精准医学、遗传疾病研究和药物开发中扮演关键角色。
参考文献
Caporale, N., Castaldi, D., Rigoli, M.T. et al. Multiplexing cortical brain organoids for the longitudinal disp of developmental traits at single-cell resolution. Nat Methods (2024). https://doi.org/10.1038/s41592-024-02555-5


