【Blood Adv】NDMM Dara-KRd诱导后MRD驱动治疗的2期研究
时间:2024-12-11 06:01:25 热度:37.1℃ 作者:网络
MRD驱动治疗
对于新诊断多发性骨髓瘤(NDMM),可测量残留病(MRD)状态对预后很重要,但其在治疗决策中的作用尚不清楚。因此开展了一项一项II期试验(NCT04113018),评估了达雷妥尤单抗、卡非佐米、来那度胺和地塞米松(Dara-KRd)诱导,随后采用基于二代测序(NGS)的MRD适应性(MRD-adapted)治疗升级或降级策略,结果近日发表于《Blood Advances》。

本文要点
1、基于Dara-KRd的MRD适应性的治疗具有高sCR率和MRD阴性,并随着时间的推移而改善。
2、该研究结果支持开展随机研究,对MRD-患者进行初始治疗后的治疗降级和MRD+患者的治疗升级。
研究结果
该研究为研究者发起的、单臂、两阶段2期研究,纳入39例NDMM患者,给予8周期的Dara-KRd诱导治疗,诱导后获得≥VGPR的患者进行MRD评估(NGS,10-5),分为MRD阳性和阴性(诱导后<VGPR或基线骨髓样本克隆检测不足的患者视为MRD阳性)。后续治疗根据MRD状态和是否适合ASCT进行分层:A组(MRD阴性)接受来那度胺维持治疗或不接受进一步治疗;B组(MRD阳性,适合ASCT)行ASCT;C组(MRD阳性,不适合ASCT)接受KRd巩固治疗长达12个周期。B组患者如果ASCT后MRD呈阳性,则可接受长达12个周期的KRd巩固治疗。在任何方案指定的时间点转化为MRD阴性,允许患者接受来那度胺维持或不再接受治疗。
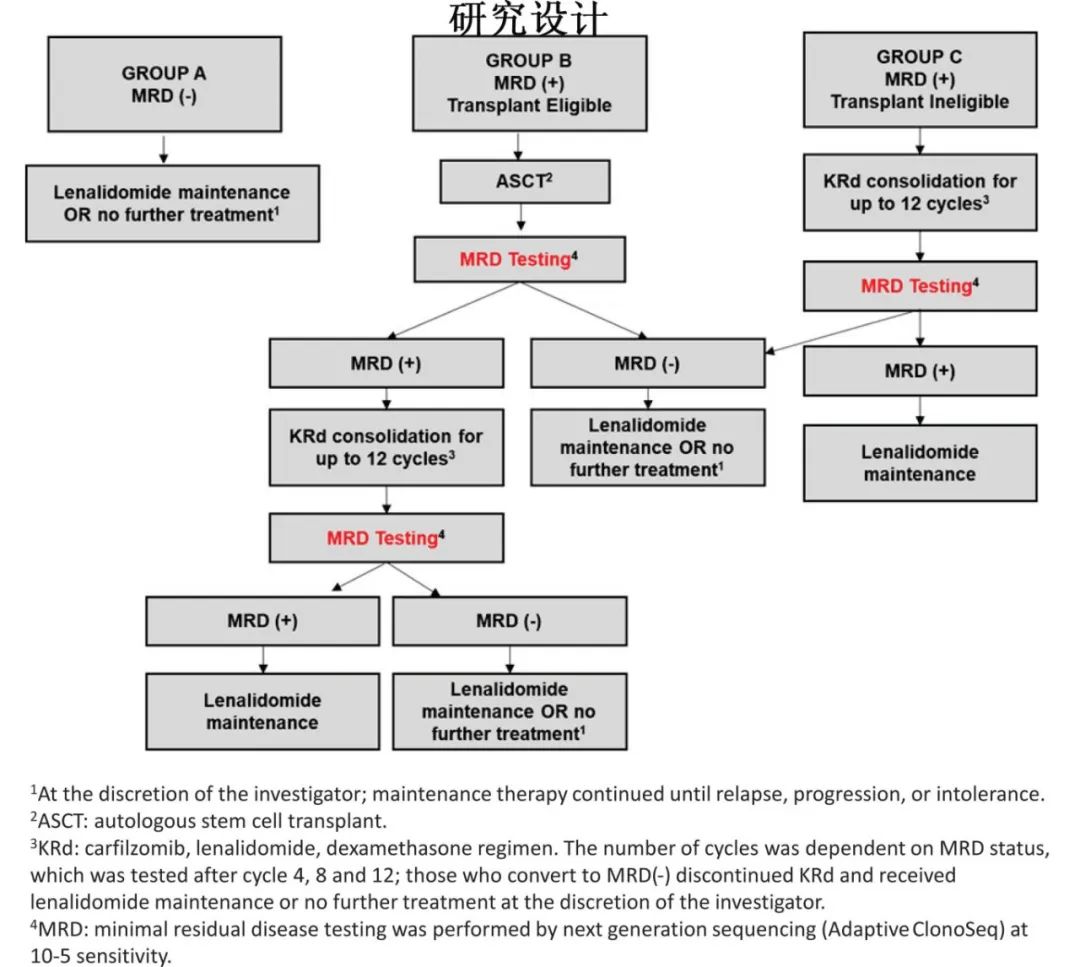
21例(54%)诱导后达到≥CR (P=0.375),16例(1%)达到sCR,ORR为94.9%,MRD(NGS)阴性率为59%(10-5)和41%(10-6),MRD(NGF)阴性率为77%(10-5)和31%(10-6)。且多数患者的缓解随时间的推移进一步改善。
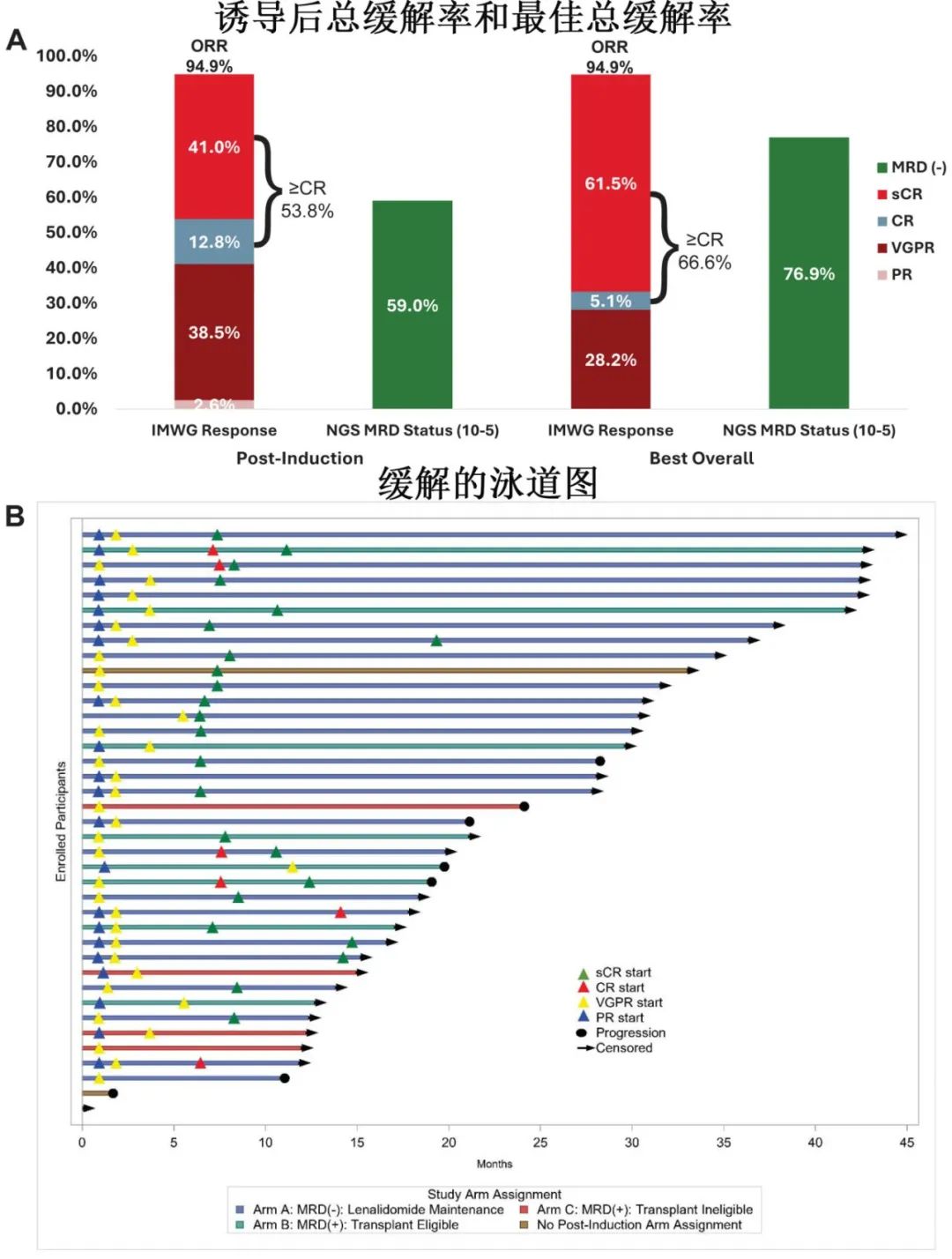
MRD阴性患者(n=24, A组)接受来那度胺维持治疗,其中14/18例(77.8%)患者持续MRD阴性≥12个周期。适合移植的MRD阳性患者(n=8,B组)接受ASCT,其中5例(62.5%)在10-6下转化为MRD阴性、3例(37.5%)在10-5下转化为MRD阴性。MRD阳性且不适合移植的患者(n=4,C组)接受KRd巩固治疗,无患者MRD转阴(10-5, NGS)。
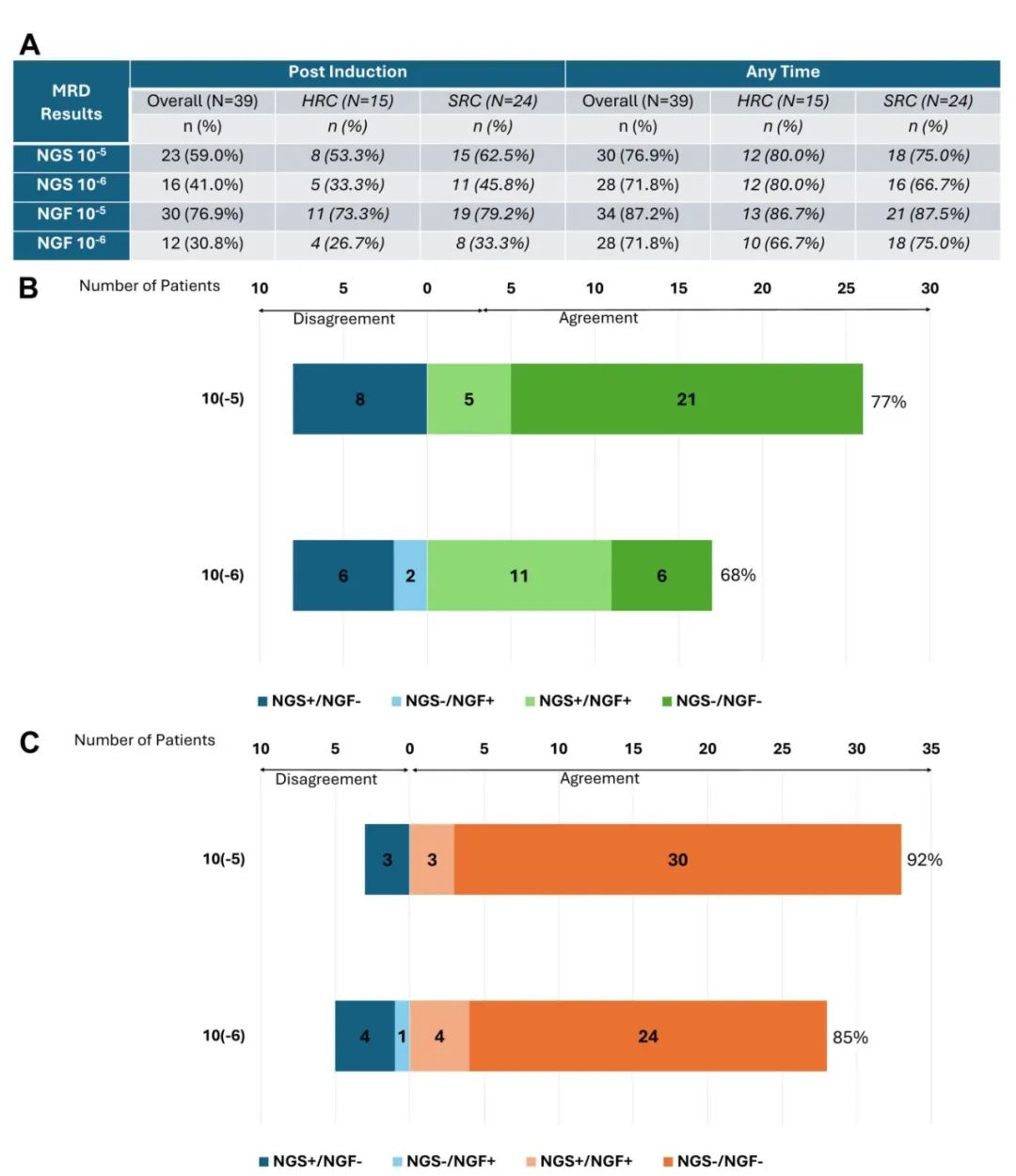
整体患者中,任何时间点的MRD阴性率(NGS)提高到77%(10-5)和72%(10-6),NGF MRD阴性率分别为87%和72%。且细胞遗传学高危和标危患者之间,诱导后和任何时间点的MRD阴性率均无差异。此外,NGS和NGF的一致率:诱导后,10-5下为77%,10-6下为68%;任何时间点,分别为92%和85%。
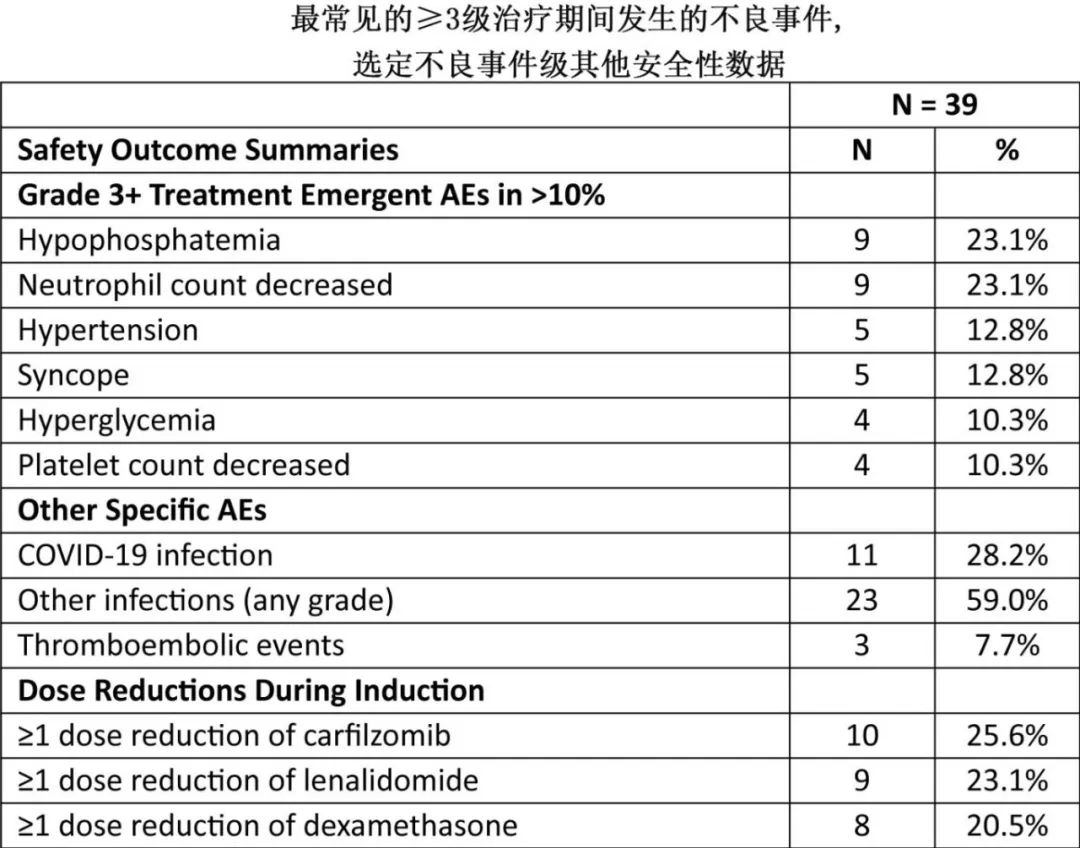
除了已知的Dara-KRd之外,未发现其他安全问题。
中位随访30.1个月,A、B和C组分别有3例、2例和1例患者出现疾病进展或死亡;2年PFS为82.5%,中位PFS未达到;2年OS为97.4%,中位OS未达到。
通过诱导期间的纵向免疫分析揭示传统和非常规T细胞的激活以及与MRD相关的免疫亚群的变化。对外周血的免疫分析中发现,与 MRD 状态相关的免疫细胞组成存在明显差异。较高的γδT细胞和CD8+ TEMRA基线水平与 MRD 阴性相关。在 MRD 阴性组中观察到γδT细胞活化(已知具有抗 MM 活性)和CD8+ TEMRA快速降低,与 MM 的免疫衰老和不良预后相关。Dara-KRd可能改善 MM 中 TEMRA 相关的 T 细胞功能障碍,通过直接靶向表达 CD38 的 TEMRA 或通过间接抑制终末分化过程。Dara-KRd方案强烈激活记忆T细胞,与诱导后的MRD阴性状态有关。需要进一步的机制研究来证实这些发现,确定因果关系,并探索治疗意义。
总结
这项II期研究使用MRD适应性设计研究了Dara-KRd在NDMM中的疗效。Dara-KRd诱导治疗后54%的患者≥CR。此外,在ITT人群中,诱导结束时NGS MRD阴性率,在10-5和10-6时分别为59%和41%。随着时间的推移,反应加深,≥CR率增加到66.7%,MRD阴性增加到77%(10-5)和72%(10-6)。NGS检测到的MRD与NGF检测到的MRD高度一致。重要的是,细胞遗传学高危和标危患者的≥CR率或MRD阴性没有差异。
虽然未达到主要终点(≥70%),但Dara-KRd在NDMM中的诱导≥CR和MRD阴性率很高,没有新的安全性问题。诱导后MRD适应性策略可加深MRD阳性组的反应,同时在MRD阴性组保持持久的MRD控制。该研究结果支持开展随机研究,以比较诱导后MRD阴性患者一线ASCT和不ASCT,并对MRD阳性患者升级治疗。
参考文献
Bhutani M,et al.MRD-driven phase 2 study of daratumumab, carfilzomib, lenalidomide and dexamethasone in newly diagnosed multiple myeloma.Blood Adv . 2024 Nov 22:bloodadvances.2024014417. doi: 10.1182/bloodadvances.2024014417.


