重庆大学张吉喜教授团队AHM:面向肿瘤术后微小残留灶识别和消融的协同激活型纳米传感器
时间:2024-12-02 17:00:21 热度:37.1℃ 作者:网络
手术作为早期乳腺癌患者的首选治疗方法,因其高复发和转移率,致使其长期预后往往不理想。导致这些不良结果的一个重要因素是在手术过程中难以检测和消除的MRD。因此,乳腺癌术后微小残留病灶(Minimal Residual Disease,MRD)的清除对于抑制转移和复发至关重要。为了解决这一问题,术中荧光成像技术已被广泛用于手术导航。然而,该领域最有前景的生物标志物激活的荧光成像策略面临挑战,因为传感器对细胞质靶标的可及性有限,显著影响了成像信噪比和对比度。
2024年11月24日,重庆大学生物工程学院张吉喜教授团队在《Advanced Healthcare Materials》杂志在线发表了题为“Flower-Like Nanosensors for Photoacoustic-Enhanced Lysosomal Escape and Cytoplasmic Marker-Activated Fluorescence: Enabling High-Contrast Identification and Photothermal Ablation of Minimal Residual Disease in Breast Cancer”的工作。在该工作中设计并构建了一种具有光声增强溶酶体逃逸和肿瘤细胞质双靶标激活荧光的花状纳米传感器(FHN@DFP),用于成像指导的乳腺癌术后MRD光热清除,抑制转移和复发。
具体来说,通过将钴离子引入到锌基沸石咪唑骨架(ZIF)的形成过程中,可以使MOF结构具备更高的类儿茶酚氧化酶活性,原位催化多巴胺快速高效的聚合和沉积,导致纳米片微孔堵塞。纳米片的同步交联形成了三维结构的复合纳米花(FHN),其平均尺寸为~80 nm,花瓣厚度为~6 nm。这些纳米花表现出优越的光热转换能力和显著降低的热导率(比氧化石墨烯低~ 4545倍),与脉冲激光(PL)照射下纳米片之间的热场叠加耦合,实现了增强的光声(PA)效应。FHN负载双因子(ATP、miRNA-21)协同激活核酸探针(DFAP),成功构建了纳米传感器FHN@DFP,在上调的ATP和miRNA-21生物标志物存在下激活荧光。FHN@DFP在与ATP类似物共孵育的情况下,荧光信号降低了11.13倍;在与miRNA-21类似物共孵育时,荧光信号降低了20.29倍,实现了对靶标的高特异性检测。FHN@DFP纳米传感器协同PL照射显著提高了肿瘤与正常细胞之间的信号比(CNR),从1.4提升至10.2;MRD模型鼠的肿瘤与正常组织之间的信号比(TNR)从5.1增加到17.4。最终,在精确成像引导下的NIR照射能够有效诱导肿瘤细胞凋亡,并抑制MRD的复发与转移,肺转移结节减少了96.2%。
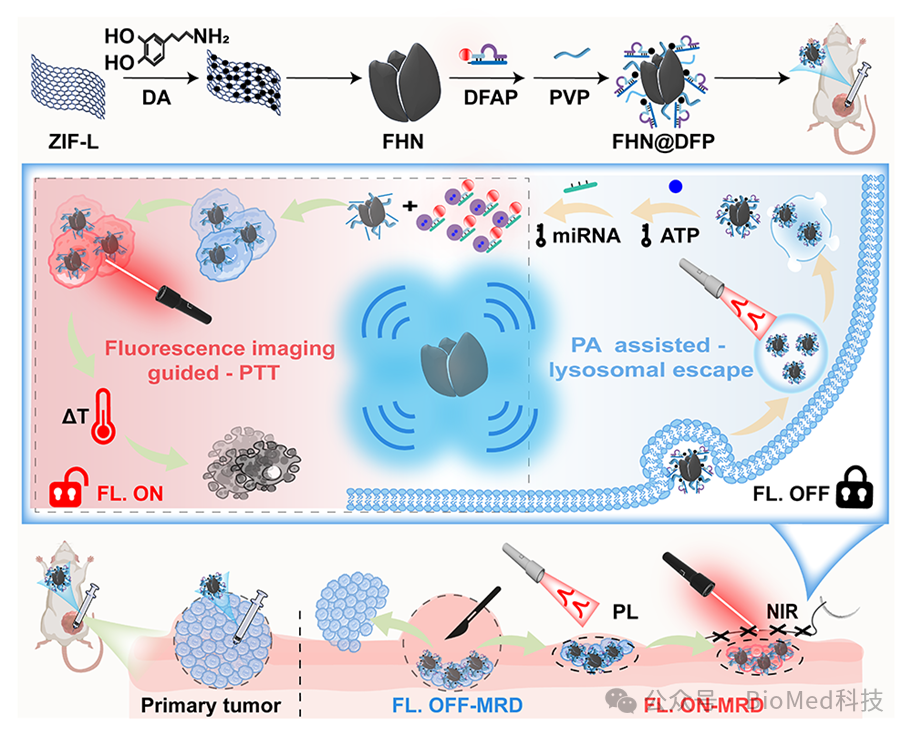
图1. PA效应增强的花状纳米传感器(FHN@DFP),用于乳腺癌术后MRD的精确成像和光热消融。FHN@DFP具有双因子序贯激活性能,利用PL照射辅助其逃逸出溶酶体,提高胞内递送效率和标志物可及性,实现乳腺癌MRD小鼠模型中高TNR成像引导的精确光热消融。
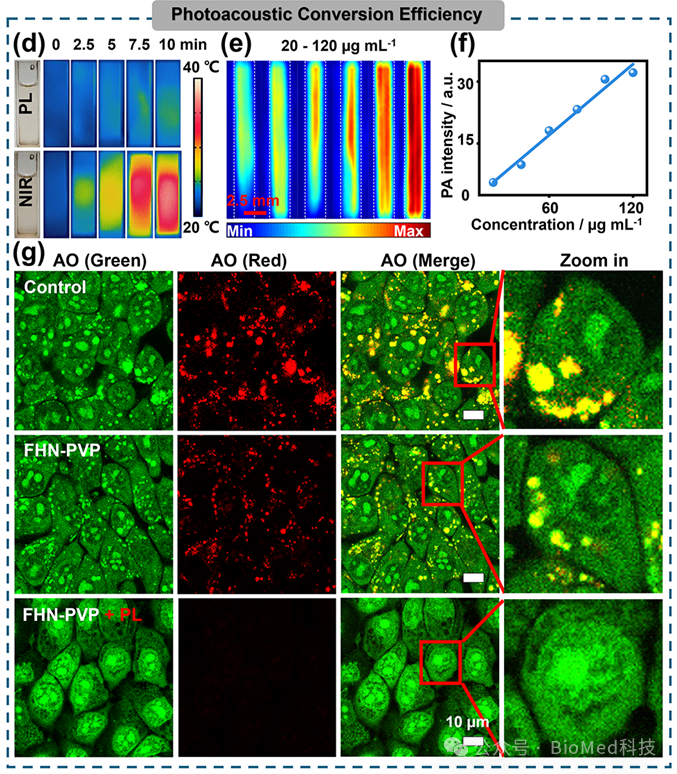
图2 FHN-PVP的光热性能和PA效应评估
光热/光声性能的评估,证明了FHN@DFP在NIR照射下表现出光热效应,在PL照射下产生PA效应的潜力。采用吖啶橙(AO)染色评估4T1细胞中溶酶体的完整性。未经任何处理的4T1细胞,溶酶体发出红色荧光。当使用FHN-PVP+PL处理时(图2g)红色荧光强度最低,表明由于光声效应使溶酶体结构被破坏或改变,导致溶酶体通透性增加。
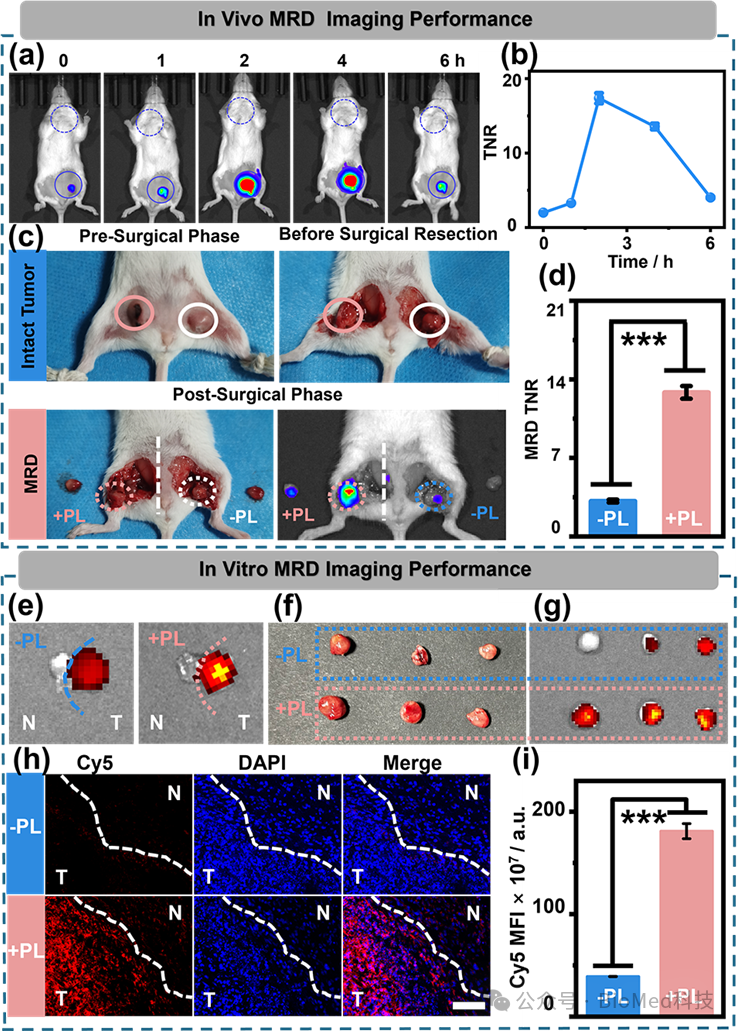
图3 PL照射下FHN@DFP的体内成像效率
在优化的时间条件下,进行FHN@DFP的体内MRD成像效果评估。如图3c,d所示,经PL处理的组的MRD显示出明显较高的荧光强度,约为未处理组的4.1倍。取肿瘤及其瘤旁正常组织制备冰冻切片进行分析,结果如图3h所示。PL处理组的切片中,肿瘤组织显示出明显的红色荧光,而非PL处理的组织中的荧光明显减弱,与PL处理组相比降低了4.6倍(图3i)。证明了FHN@DFP在PL辅助下应用于术中精确检测MRD的潜力。
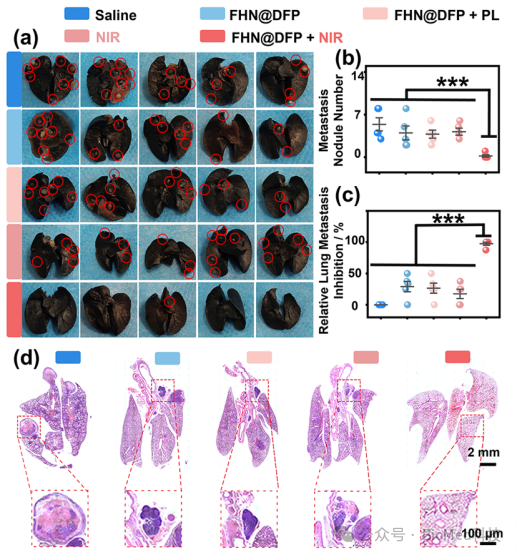
图4 成像引导的MRD光热治疗对乳腺癌术后复发转移抑制评价
最后,通过术后PTT治疗效果和复发与转移抑制评估(图4),证明了高TNR成像引导的术后MRD光热治疗对乳腺癌术后复发转移的有效抑制。在治疗后第30天对小鼠进行安乐死,并使用黑色墨水对肺组织进行染色,以区分健康肺组织(黑色部分)和肺部转移的肿瘤(白色部位)。与生理盐水组相比,FHN@DFP +NIR组的肺转移结节减少了96.2 %(图5c),有效抑制了肿瘤的肺部转移。
综上所述,该研究提出了一种创新的花状复合纳米颗粒设计。在锌基沸石咪唑骨架的形成过程中,钴离子的掺杂使得类儿茶酚氧化酶活性增强,从而原位催化聚多巴胺在MOF纳米片上的聚合和大量沉积,并导致纳米片的微孔堵塞。通过原位交联形成的三维结构复合纳米花,既满足了增强PA效应的需求,又能够负载双因子协同激活荧光探针。当ATP和miRNA标记物同时上调时,特异性地触发荧光的恢复。脉冲激光的应用显著增加了溶酶体膜的通透性,提高了细胞质中标记物的可及性,从而有效提升了TNR。基于高TNR荧光成像引导的光热治疗,可以实现精准的光热消融。该研究基于内源性和外源性因素的协同响应,为MRD的高对比度识别和精准消融提供了新的途径。这项工作推动了多功能诊断和治疗平台的发展,突显了这些纳米传感器作为先进辅助诊疗平台的潜力。
作者简介:
第一作者:李琳,本科毕业于河南农业大学,2021年保送至重庆大学生物工程学院张吉喜教授团队。2024年6月硕士毕业后,继续在原课题组攻读生物医学工程专业学术型博士研究生,主要从事生物材料与诊疗器械研究。
通讯作者:张吉喜,教授,博士生导师,国家级青年人才计划入选者。2007、2012年毕业于上海交通大学,获工学学士、博士学位。2012年-2014年在芬兰功能材料研究中心从事博士后研究。2014年引进入重庆大学生物工程学院工作,任“百人计划”特聘研究员。近年来,面向三阴性乳腺癌等恶性肿瘤围术期诊断和组合消融辅助治疗的难点问题,主持国家自然科学基金项目4项,骨干参研国家自然科学基金重点项目、国家重点研发计划项目,发展诊疗微系统多相反应流传递和响应转化下基元约束耦合的动力学控制方法,在Adv. Funct. Mater, ACS Nano, Nano Today, Small, Small Methods, Biosens. Bioelectron, Adv. Healthcare Mater.等国际知名杂志上发表期刊论文70余篇,获权发明专利5件。
王璐,副研究员,硕士生导师。2016年毕业于中国科学院上海应用物理研究所,获博士学位。2018-2024年在美国杜克大学和重庆大学生物工程学院分别从事博士后和助理研究员工作。2024年通过“求真人才工程”引进入杭州医学院检验医学院、生物工程学院。研究方向围绕亚细胞器分子代谢与疾病发生相关性及检测新方法的构建,基于分子编程技术实施对亚细胞单位的精准测量和同步成像。同时,主持省部级项目1项,担任Nano TransMed青年编委,以第一和通讯作者身份在Nano Research, ACS Applied Materials & Interfaces, Sensors and Actuators B: Chemical 等杂志发表SCI论文多篇。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adhm.202403042


