论文解读 | Taosheng Chen教授团队揭示CYP3A5在胰腺癌中调节葡萄糖代谢的新机制
时间:2024-11-30 15:00:22 热度:37.1℃ 作者:网络
胰腺导管腺癌是一种高度侵袭性的恶性肿瘤,其致死性主要源于早期诊断的困难和治疗手段的局限。在胰腺癌中,糖酵解过程的改变被视为其主要的代谢特征,而葡萄糖转运则是该过程中的一个关键限速步骤。CYP3A5作为一种细胞色素P450酶,参与了药物代谢和外源性致癌物的解毒过程,但其在胰腺导管腺癌发生和发展中的直接生理作用尚不明确。
美国圣犹大儿童研究医院的Taosheng Chen教授团队在本刊发表了题为“CYP3A5 unexpectedly regulates glucose metabolism through the AKT-TXNIP-GLUT1 axis in pancreatic cancer”的研究论文,揭示了CYP3A5在胰腺癌中通过AKT-TXNIP-GLUT1信号通路调节葡萄糖代谢的新机制,为胰腺癌的治疗提供了新的潜在靶点。
01 CYP3A5在AsPC-1细胞中的作用
研究团队通过分析不同癌症细胞系和癌症基因组图谱数据,发现CYP3A5在多种癌症中表达上调,尤其是在胰腺癌细胞系AsPC-1中表达最高。通过代谢组学和转录组学分析,研究团队发现CYP3A5敲低后,AsPC-1细胞内与葡萄糖代谢相关的代谢物显著减少,相关基因表达下调(图1)。进一步实验显示,CYP3A5 敲低/敲除或抑制剂处理后, AsPC-1细胞的葡萄糖摄取均减少。
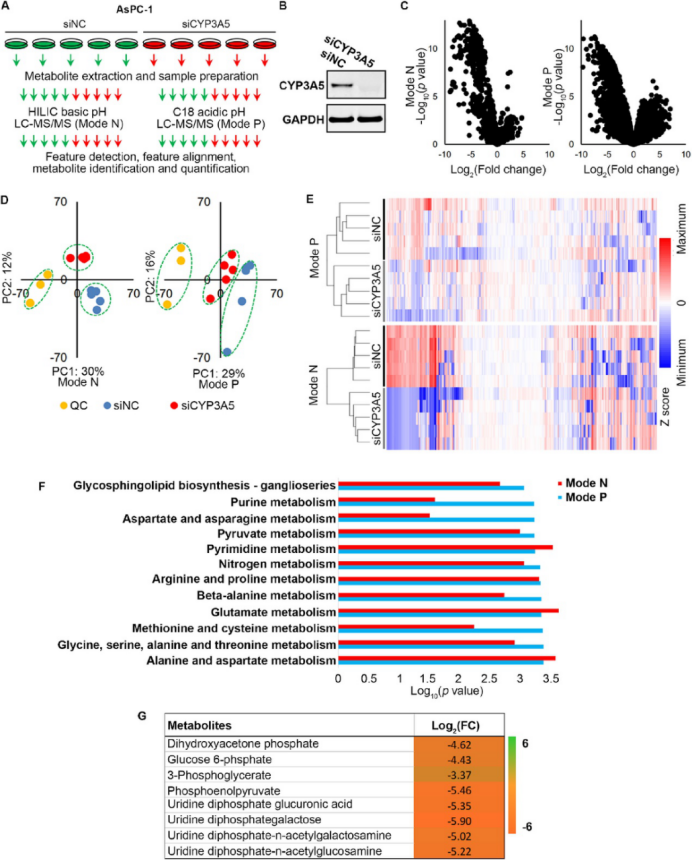
图1. AsPC-1 细胞CYP3A5敲低后的代谢组学分析(原文中Figure 1)。
02 CYP3A5对GLUT1的调控作用
CYP3A5敲低后,GLUT1在细胞膜上的表达减少,而细胞内GLUT1总量并未改变。CYP3A5敲低后,TXNIP蛋白水平上升,考虑到TXNIP是GLUT1的负向调节因子,这一发现表明CYP3A5可能通过抑制TXNIP的翻译来促进GLUT1在细胞膜上的表达(图2)。
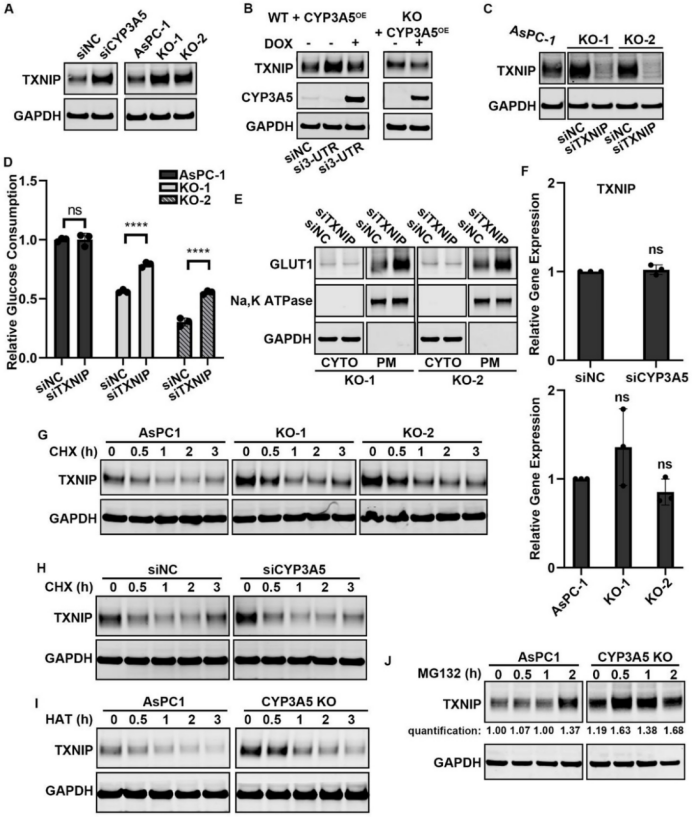
图2. CYP3A5 通过减少 TXNIP 翻译来增强 GLUT1 的膜转运(原文中Figure 5)。
03 CYP3A5产生的ROS对信号通路的调控
研究发现,CYP3A5的敲低导致细胞内ROS水平下降,AKT和4EBP1的磷酸化水平上升,暗示CYP3A5产生的ROS可能在调控AKT-TXNIP-GLUT1信号通路中发挥作用。
04 CYP3A5在类器官培养中的调控作用
与2D细胞培养相比,类器官培养模型更接近体内环境。CYP3A5的敲低导致AsPC-1类器官中TXNIP、p-4EBP1和p-AKT蛋白水平升高,ROS水平降低,葡萄糖消耗减少。抗氧化剂NAC处理降低了AsPC-1类器官的葡萄糖消耗,并增加了TXNIP蛋白水平以及4EBP1和AKT的磷酸化水平。TXNIP的敲低能够恢复CYP3A5敲低导致的葡萄糖消耗减少(图 3)。
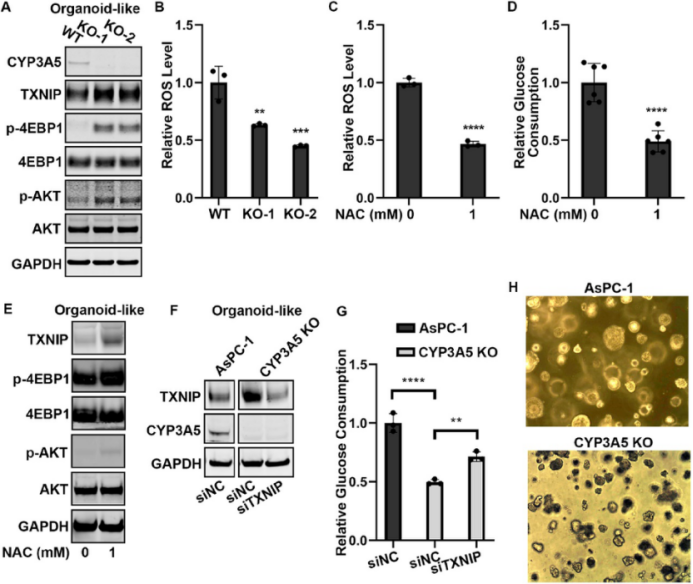
图3. CYP3A5 通过 AKT-4EBP1-TXNIP 信号通路调节AsPC-1类器官的葡萄糖消耗(原文中Figure 8)。
总之,该研究揭示了CYP3A5在胰腺癌中通过产生ROS调控AKT-4EBP1-TXNIP信号通路,影响GLUT1在细胞膜的富集,进而影响葡萄糖摄取,支持胰腺导管腺癌细胞的生长。这一发现不仅增进了我们对胰腺癌代谢重编程的理解,也为开发新的治疗策略提供了潜在靶点。
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304223003628
引用这篇文章:
Shao M, Pan Q, Tan H, et al. CYP3A5 unexpectedly regulates glucose metabolism through the AKT-TXNIP-GLUT1 axis in pancreatic cancer. Genes Dis. 2024;11(4):101079.


