重庆医科大学任建丽/江唯希《Biomaterials》:超声控释的气酶联合纳米平台治疗动脉粥样硬化
时间:2024-11-29 13:00:09 热度:37.1℃ 作者:网络
动脉粥样硬化是一种以氧化应激、脂质代谢紊乱及持续性炎症为特征的慢性进行性疾病,其持续发展将诱发严重的心血管疾病。近年来,硫化氢气体在心血管疾病治疗领域展示出了巨大的应用前景,可有效调控脂质代谢及炎症反应。然而,气体在运输过程中容易发生泄漏且缺乏特异性,影响了其治疗效果。
近期,重庆医科大学附属第二医院超声科任建丽/江唯希共同通讯在《Biomaterials》杂志在线发表了题为“LIFU-unlocked endogenous H2S generation for enhancing atherosclerosis-specific gas-enzymatic therapy”的研究工作。该团队开发了一种超声可控释放的气酶联合多功能纳米平台,用于治疗动脉粥样硬化。团队首先将酶催化下生成内源性硫化氢(H2S)的供体S-烯丙基 L-半胱氨酸(SAC)装载到中空介孔普鲁士蓝(HMPB)中。为防止HMPB和SAC在到达病变部位前的不必要释放,团队利用肽功能化脂质膜对HMPB进行封装并增强纳米颗粒的主动靶向能力。在低强度聚焦超声(LIFU)破坏脂质膜后,HMPB的酶活性恢复,同时SAC释放并产生内源性H2S。这种气酶联合疗法在氧化应激、炎症和脂质代谢紊乱方面都表现出了出色的调节能力,为治疗动脉粥样硬化提供了一种可行的纳米策略。

【文章要点】
本文设计了一种基于内源性硫化氢供体SAC和纳米酶HMPB的肽功能化脂质纳米颗粒。硫化氢供体SAC装载在HMPB中并被肽功能化脂质膜封装(LyP-1Lip@HS),不仅有效防止了其泄露,还赋予了其主动靶向能力,克服了传统气体治疗的局限性。当LyP-1Lip@HS积累在病灶后,利用LIFU破坏脂质膜,恢复HMPB的酶活性并清除病灶内活性氧,如过氧化氢、羟基自由基以及超氧阴离子等。同时释放的SAC在心血管系统中丰富的胱硫醚β-合酶(CBS)和胱硫醚γ-裂解酶(CSE)的催化下产生内源性H2S。H2S通过增强ABCA1表达,调控泡沫细胞胆固醇外排并促进M1型巨噬细胞向M2型巨噬细胞转变来缓解斑块内炎症微环境。此外,HMPB继承了Fe3+的优良特性,具有优异的近红外吸收和顺磁效应,是良好的光声/磁共振成像剂,使动脉粥样硬化的可视化监测成为可能(图1)。
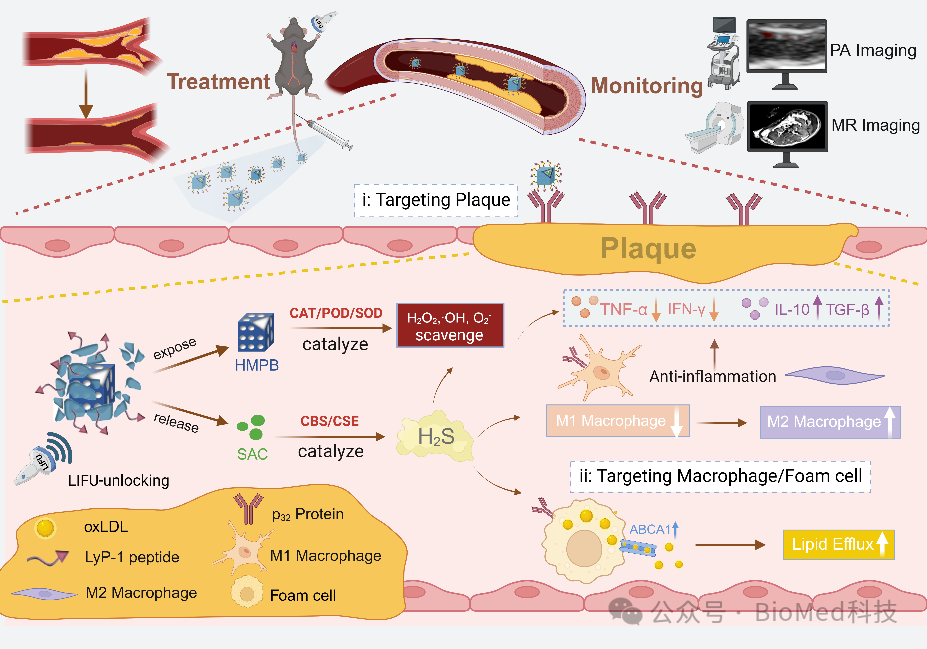
图1. H2S气体与纳米酶联合治疗动脉粥样硬化示意图
通过高脂喂养ApoE敲除小鼠构建动脉粥样硬化病理模型,体内实验结果显示,接受LyP-1Lip@HS+LIFU处理组小鼠的斑块面积显著减少(图2)。
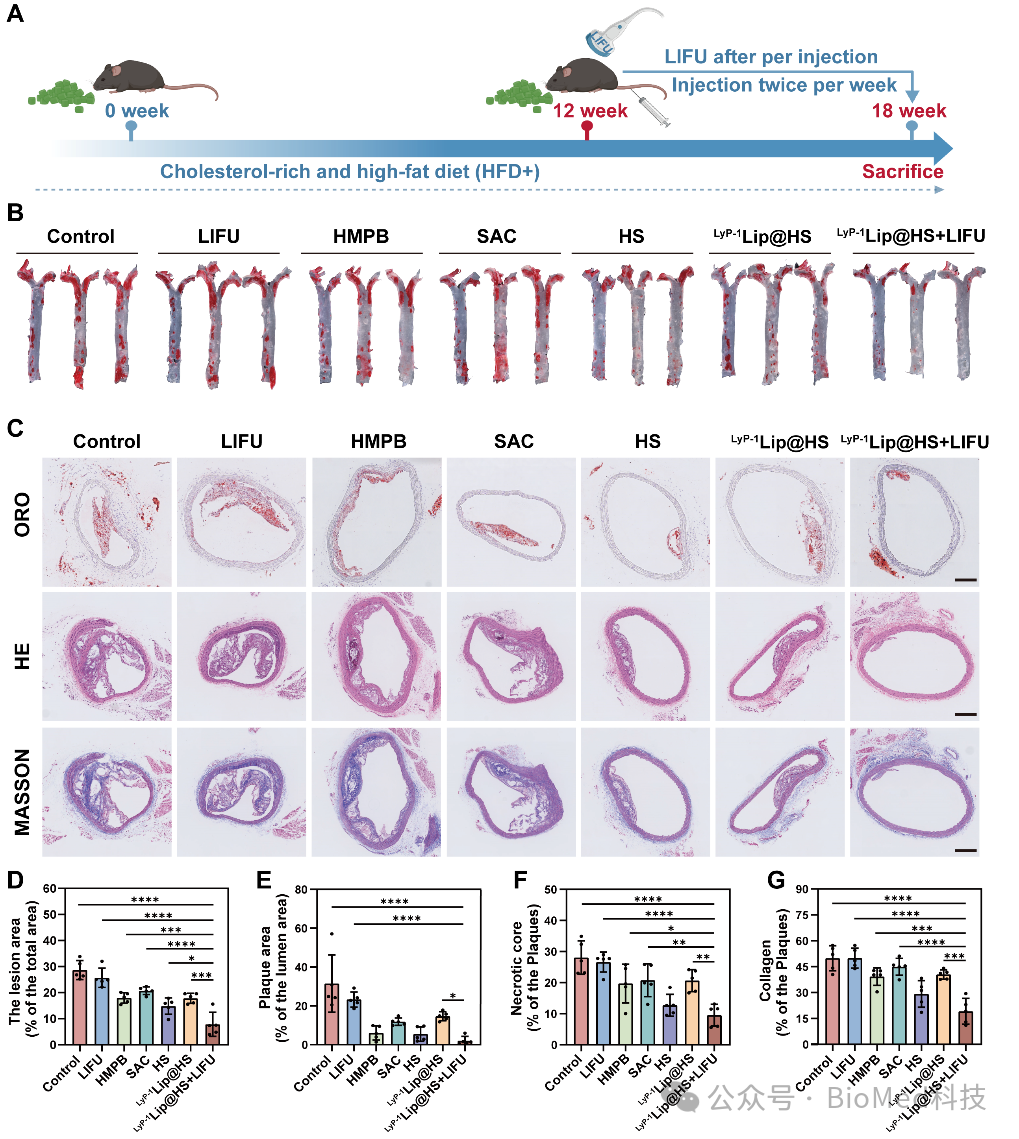
图2. 动脉粥样硬化模型小鼠体内斑块治疗效果
同时荧光染色结果证实LyP-1Lip@HS+LIFU治疗的动脉粥样硬化小鼠的主动脉斑块中表现出更高的ABCA1 表达和抗炎因子IL-10和更低的活性氧和促炎因子TNF-α(图3)。这些结果表明LyP-1Lip@HS+LIFU治疗可有效增强斑块微环境中脂质的外排,减轻斑块微环境中的炎症反应,从而抑制动脉粥样硬化的发展。
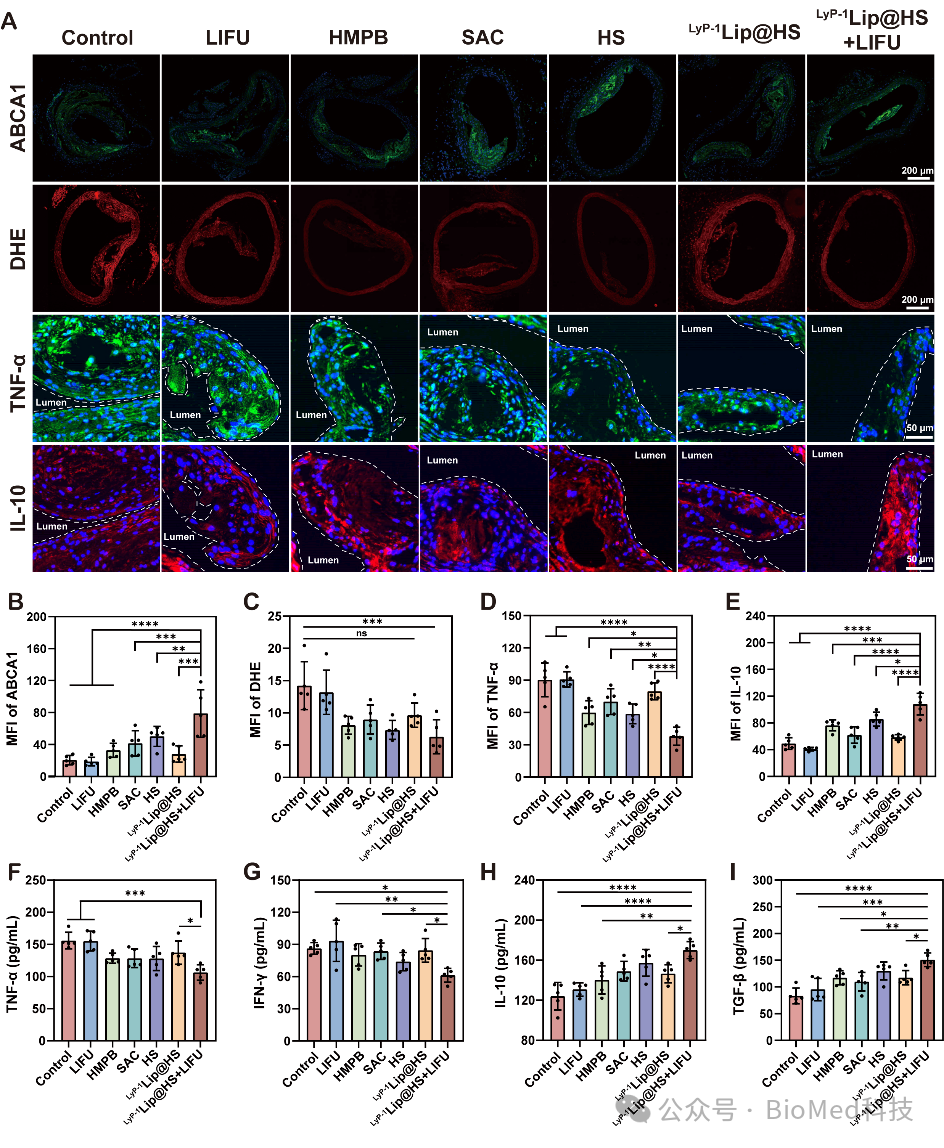
图3. 动脉粥样硬化小鼠内斑块荧光染色分析及炎症水平检测
重庆医科大学第二附属医院超声科任建丽教授和江唯希主治医师为该论文的共同通讯作者。重庆医科大学第二附属医院超声科硕士安虹瑾为本论文的第一作者。本研究受到国家自然科学基金、重庆市自然科学基金,重庆医科大学登峰学科建设等项目资助。
原文链接:


