【论著】| hnRNPK调控Wnt/β-catenin信号转导通路抑制乳腺癌细胞铁死亡
时间:2024-11-28 09:00:21 热度:37.1℃ 作者:网络
[摘要] 背景与目的:核内不均一核糖核蛋白K(heterogeneous nuclear ribonucleoprotein K,hnRNPK)是一种调控基因表达和蛋白翻译的RNA结合蛋白,已被发现与多种肿瘤恶性进展密切相关,但其在乳腺癌中的作用尚未明确。本研究旨在探讨hnRNPK对乳腺癌细胞铁死亡的影响及其作用机制。方法:基于癌症基因组图谱(The Cancer Genome Atlas,TCGA)和基因表达综合(Gene Expression Omnibus,GEO)数据库,联合生信分析hnRNPK在乳腺癌组织及正常组织中的表达及与临床预后的关系;采用实时定量逆转录聚合酶链反应(real-time quantitative reverse transcription polymerase chain reaction,qRT-PCR)、蛋白质印迹法(Western blot)、免疫组织化学法检测hnRNPK在乳腺癌细胞及组织中的表达;将乳腺癌MDA-MB-231和MCF-7细胞进行siRNA转染,设置分组为对照组(control)、空载体组(NC)、干扰载体组(si-hnRNPK),采用细胞计数试剂盒(cell counting kit-8,CCK-8)和平板克隆实验检测细胞增殖能力;高通量RNA测序(RNA-sequencing,RNA-seq)分析hnRNPK富集的生物学功能及信号转导通路,Western blot及活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)、Fe2+试剂盒检测hnRNPK对铁死亡表型的影响,并利用铁死亡抑制剂(ferrostatin-1,Fer-1)检测敲低hnRNPK对铁死亡的回复作用;通过Western blot检测hnRNPK对Wnt/β-catenin通路蛋白表达的影响。结果:数据库结合生物信息学分析结果显示,hnRNPK在乳腺癌组织中表达上调(P<0.01),hnRNPK高表达组患者总生存期OS低于hnRNPK低表达组(P<0.05);hnRNPK在乳腺癌组织及细胞中呈高表达,敲低hnRNPK后乳腺癌细胞增殖能力减弱(P<0.05);RNA-seq分析发现hnRNPK显著富集铁死亡、凋亡、Wnt/β-catenin信号转导通路;敲低hnRNPK通过促进脂质ROS和MDA产生、Fe2+富集促进乳腺癌细胞铁死亡(P<0.05),且联合Fer-1有效抑制敲低hnRNPK对铁死亡的促进作用(P<0.05);hnRNPK下调导致Wnt/β-catenin信号转导通路中β-catenin、c-Myc表达降低,CK1α、APC、GSK-3β复合物表达升高(P<0.05)。结论:hnRNPK在乳腺癌中呈高表达,敲低hnRNPK通过抑制Wnt/β-catenin信号转导通路促进乳腺癌细胞铁死亡,抑制乳腺癌恶性进展。
[关键词] hnRNPK;乳腺癌;铁死亡;Wnt/β-catenin信号转导通路
[Abstract] Background and purpose: Heterogeneous nuclear ribonucleoprotein K (hnRNPK) is an RNA special binding protein that participates in regulating the expression of related genes and protein translation. It has been linked to the malignant occurrence and development of various tumors, but its role in breast cancer remains unclear. The aim of this study was to investigate the effects of hnRNPK on ferroptosis in breast cancer cells and the underlying mechanisms. Methods: Based on The Cancer Genome Atlas (TCGA) and Gene Expression Omnibus (GEO) databases, hnRNPK expression in breast cancer tissues and normal tissues and its relationship with clinical prognosis were analyzed by bioinformatics. We detected hnRNPK expression in breast cancer cells and tissues using real-time quantitative reverse transcription polymerase chain reaction (qRT-PCR), Western blot, and immunohistochemistry staining diagnosis methods. MCF-7 and MDA-MB-231 breast cancer cells were transfected with siRNA, and divided into control group (control), empty body group (NC), and interference vector group (si-hnRNPK). Cell proliferation was detected by cell counting kit-8 (CCK-8) and plate clone formation assays. RNA-seq analysis was applied to explore potential targeted biological functions and signaling pathways affected by hnRNPK. Additionally, we investigated the impact of hnRNPK on ferroptosis phenotype using Western blot and commercial kits for reactive oxygen species (ROS), malondialdehyde (MDA), glutathione (GSH), and Fe2+, ferroptosis inhibitor (ferrostatin-1, Fer-1) was used to detect the rescue effect of hnRNPK knockdown on ferroptosis. The impact of hnRNPK on the expressions of Wnt/β-catenin pathway-related proteins were determined by Western blot. Results: The bioinformatics analyses indicated hnRNPK was upregulated in breast cancer tissues (P<0.01), and the overall survival of patients in the high expression group was poorer compared with those in the low expression group (P<0.05). hnRNPK was highly expressed in breast cancer tissues and cells, and knocking down hnRNPK weakened the proliferation ability of breast cancer cells (P<0.05). The RNA-seq analysis showed that hnRNPK was significantly enriched in ferroptosis, apoptosis, and the Wnt/β-catenin signaling pathway. Knocking down hnRNPK promoted ferroptosis in breast cancer cells by inducing lipid ROS and MDA, as well as Fe2+ accumulation (P<0.05). Interestingly, the ferroptosis inhibitor ferrostatin-1 (Fer-1) reversed the promotive effect of hnRNPK knockdown on ferroptosis (P<0.05). Downregulation of hnRNPK led to a decrease in the expressions of β-catenin and c-Myc in the Wnt/β-catenin signaling pathway, while expressions of CK1α, APC and the GSK-3β complex were elevated (P<0.05). Conclusion: hnRNPK is highly expressed in breast cancer, and knocking down hnRNPK promotes ferroptosis in breast cancer cells by inhibiting the Wnt/β-catenin signaling pathway, thereby suppressing the malignant progression of breast cancer.
[Key words] hnRNPK; Breast cancer; Ferroptosis; Wnt/β-catenin pathway
2024年全球最新癌症统计数据显示,乳腺癌新发病例数高达230万,仅次于肺癌位居第二位,是癌症患者死亡的主要原因之一[1]。乳腺癌是一种高度异质性的疾病,尽管目前乳腺癌治疗已取得较大进步,但由于其发病机制复杂,疾病进展迅速,治疗效果仍不理想[2-3]。因此,积极寻找新的分子靶点,探求新的治疗策略,对改善乳腺癌患者的预后具有重要意义。
铁死亡(ferroptosis)作为新发现的细胞特殊死亡方式,在形态学、生物学和遗传学方面均不同于细胞凋亡、自噬和坏死,其特征是铁依赖性脂质过氧化物的积累,驱动并诱导细胞死亡[4]。近年来,聚焦于铁死亡机制的癌症研究引起了广泛关注,诱导铁死亡可以消除对其他细胞死亡模式具有抵抗力的癌细胞[5]。但由于铁死亡涉及多种复杂机制,铁死亡与乳腺癌患者预后有何种联系,是否与相关基因互作而影响乳腺癌进展尚不明确。
核内不均一核糖核蛋白K(heterogeneous nuclear ribonucleoprotein K,hnRNPK)是hnRNPs家族的重要成员之一,是一种高度保守、广谱表达的核质穿梭蛋白,可以与多种核酸或蛋白质相互作用,参与调节mRNA剪接、转录、翻译、染色质重塑等生物学过程[6-7]。已有研究[8-11]表明,hnRNPK在多种恶性肿瘤中呈高表达,作为致癌基因参与调控肿瘤细胞增殖、转移、血管生成等生物学特性,但也有研究发现hnRNPK在血液系统恶性肿瘤中发挥抑癌基因作用[12],提示hnRNPK在不同肿瘤中表达存在差异,对肿瘤进展调控可能具有双重潜能。迄今为止,hnRNPK在乳腺癌中的调控作用尚未阐明。本研究拟通过公共数据库分析hnRNPK在乳腺癌中的表达及其对患者预后的影响,并利用临床样本和细胞系验证其表达水平。构建敲低细胞模型,通过RNA-Seq生信分析和体外细胞功能实验,探索hnRNPK对乳腺癌细胞铁死亡的影响及可能的作用机制,期望为乳腺癌经铁死亡途径的临床治疗提供潜在靶点。
1 材料和方法
1.1 主要材料
MCF-10A、MCF-7、BT474、T47D、MDA-MB-231细胞购自中国科学院典型培养物保藏委员会细胞库,培养基、胎牛血清、RPMI-1640培养基、MCF-10A专用培养基、青霉素及链霉素混合液均购自美国Gibco公司,si-hnRNPK敲低载体及引物由生工生物工程(上海)股份有限公司合成,Advanced Transfection Reagent助转染试剂购自美国ZATA LIFE公司,反转录试剂盒及实时定量逆转录聚合酶链反应(real-time quantitative reverse transcription polymerase chain reaction,qRT-PCR)试剂盒购自日本Takara公司,蛋白提取试剂盒购自南京凯基生物科技发展有限公司,二辛可宁酸(bicinchoninic acid,BCA)试剂盒、TRIzol试剂购自美国Thermo公司,细胞计数试剂盒(cell counting kit-8,CCK-8)购自大连博格林生物科技有限公司,Ferrostatin-1购自美国MCE公司,MDA试剂盒、GSH试剂盒及ROS试剂盒均购自上海碧云天生物技术有限公司,Fe2+荧光探针购自日本同仁化学研究所。
1.2 公共数据获取和分析
癌症基因组图谱(The Cancer Genome Atlas,TCGA)公共数据库获取乳腺癌患者 hnRNPK转录组表达数据,使用R语言中TCGA biolinks包下载并处理TCGA数据库中的乳腺癌标签表达矩阵,其中肿瘤样本共1 112个,非肿瘤样本共112个。后续使用rstatix包中的Wilcoxon秩和检验方法进行统计学分析,最后使用ggplot2包生成带有数据散点的箱线图。基因表达综合数据库(Gene Expression Omnibus,GEO)(https//www.ncbi.nlm.nih.gov/geo/)下载GSE36295、GSE42568数据集中的转录组数据以及GSE45255、GSE69031数据集中生存信息的完整数据。使用R语言中的GEO query包下载并处理GSE36295(肿瘤样本45例,非肿瘤样本5例)和GSE42568(肿瘤样本79例,非肿瘤样本17例)数据集最终获得带有样本分类的基因表达矩阵。针对hnRNPK的表达情况使用ggpubr包绘制小提琴图并进行Wilcoxon秩和检验。使用R软件中的survminer和survival包进行Kaplan-Meier分析,比较hnRNPK低表达和高表达组患者的总生存期(overall survival,OS),通过计算每个时间点的生存概率,生成一条阶梯形曲线,展示随时间推移的生存率变化。通过Kaplan-Meier Plotter(https//kmplot.com/analysis/)进一步验证hnRNPK对乳腺癌患者总生存率的影响。
1.3 细胞培养及转染
人乳腺癌细胞系MDA-MB-231、MCF-7在含有10%胎牛血清(fetal bovine serum,FBS)和1%青链霉素溶液(双抗)的DMEM高糖完全培养基,放置于37 ℃、CO2体积分数为5%培养箱中培养。将两种细胞以每孔1.2×105个细胞接种于6孔板,待细胞融合度为50%~60%时进行转染。根据转染试剂使用说明书,采用Advanced Transfection Reagent转染试剂将hnRNPK siRNA转染至MDA-MB-231和MCF-7细胞中,分别记为转染空载体组(NC)和hnRNPK敲低组(si-hnRNPK)。转染48 h后收集细胞进行后续分析。si-hnRNPK靶序列为:5’-UGCCAGUGUUUCAGUCCCAGATT-3’(siRNA1)和5’-CCAAAGAUUUGGCUGGAUC UATT-3’(siRNA2)。
1.4 CCK-8法检测细胞活性
取对数生长期MDA-MB-231、MCF-7细胞按2×103个/孔接种于96孔板中,细胞完全贴壁后转染NC和si-hnRNPK,每组设置5个复孔。96孔板周围加入PBS防止干燥,在90 μL新鲜培养基中加入10 μL CCK-8溶液,分别于24、48和72 h加入细胞中,培养箱中避光温育2 h。利用酶标仪读取波长450 nm处的吸光度(D)值,使用软件GraphPad Prism进行分析作图,统计细胞生长增殖差异并绘制生长曲线。
1.5 平板克隆实验检测细胞增殖能力
取对数生长期细胞,胰酶消化吹打制备单细胞悬液,以每孔1 000个细胞数量接种至6孔板,37 ℃、CO2体积分数为5%培养箱中培养7~10 d,定期观察细胞状态,当出现肉眼可见的克隆球时,终止培养,PBS冲洗2次。加入4%多聚甲醛固定15 min,去除固定液后加入0.2%结晶紫染液染色10 min,PBS冲洗3次后进行干燥,使用倒置显微镜观察并拍照,留存照片。
1.6 流式细胞术检测脂质ROS水平
利用荧光探针DCFH-DA进行活性氧检测,用无血清培养基按照1∶1 000稀释DCFH-DA。去除细胞培养基,向细胞中加入1 mL已稀释的DCFH-DA,37 ℃培养箱内温育20 min。温育结束后PBS洗涤3次,每管300~500 μL重悬细胞转移至流式管中检测细胞活性氧的荧光强度。
1.7 细胞GSH水平检测
收集转染处理后的细胞,PBS洗涤后加入细胞沉淀体积3倍量的蛋白去除试剂M溶液,充分混匀后利用液氮和37 ℃水浴对样品进行两次快速冻融。冰浴放置5 min,4 ℃,311 049 r/min离心10 min,取上清液用于总GSH含量测定。准备标准品及待测氧化型谷胱甘肽(oxidized glutathione,GSSG)含量样品,在96孔板中依次加入标准品或样品,加入150 μL总谷胱甘肽检测工作液,混匀后室温温育5 min;加入50 μL NADPH溶液,混匀后立即用酶标仪测定412 nm处D值,每5 min测定1次,共测5次。根据标准曲线计算GSH/GSSG比值变化。
1.8 细胞MDA水平检测
收集转染处理后的细胞,PBS清洗后加入120 μL蛋白裂解液裂解细胞,12 000 r/min离心10 min取上清液;BCA法测定每个样品的总蛋白浓度,然后按照说明书比例加入对应试剂量,设置空白管、标准管和样品管;混匀后100 ℃水浴加热15 min,水浴冷却至室温,1 000 r/min离心 10 min,取200 μL上清液加入96孔板中,用酶标仪测定532 nm处各孔的D值,根据标准曲线计算细胞内MDA含量。
1.9 细胞Fe2+水平检测
将 1 000个细胞/每孔接种于6孔板,在 37 ℃、CO2体积分数为5%的培养箱中培养。待细胞贴壁后去除培养基,PBS清洗细胞3次。用无血清培养基配制1 μmol/L的FerroOrange工作液避光培养30 min,荧光显微镜下观察荧光强度。
1.10 qRT-PCR检测目的基因mRNA表达水平
利用TRIzol试剂提取细胞总RNA,根据反转录试剂盒合成cDNA。以cDNA为模版,加入示踪染料TB Green 预混液进行qRT-PCR,反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共扩增40个循环。以GAPDH作为内参基因,采用2-ΔΔCt测定目的基因的相对表达量。hnRNPK基因正向引物序列为AGCTCCCGCTCGAATCTGAT,反向引物序列为CCTCAACTCGCAGTCAAAGTC;GAPDH基因正向引物序列为TGTTGCCATCAATGACCCCTT,反向引物序列为CTCCACGACGTACTCAGCG。
1.11 Western blot检测蛋白质水平
细胞培养后弃去培养皿中的培养基,胰酶消化收集细胞沉淀,预冷PBS清洗后离心去除上清液,保留细胞沉淀。利用全蛋白提取试剂盒(蛋白裂解物采用lysis buffer裂解液、蛋白酶抑制剂PMSF、磷酸酶抑制剂)提取细胞总蛋白。采用BCA蛋白定量试剂盒测定蛋白浓度,上清液与5×loading buffer混匀,100 ℃煮沸10 min促使蛋白变性。经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE),将蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。用5%脱脂牛奶在室温下封闭2 h,加入一抗(hnRNPK、c-Myc、APC、GSK-3β抗体均购自英国Abcam公司,1∶1 000稀释;HO-1、 GPX4、SLC7A11、FACL4抗体均购自美国Abmart公司,1∶2 000稀释)4 ℃温育过夜。加入HRP标记的二抗摇床温育1 h,TBST清洗后加入ECL化学发光液,凝胶成像仪进行曝光显影。
1.12 免疫组织化学染色检测hnRNPK蛋白表达
将石蜡包埋组织切片放入65 ℃烘箱中加热 2 h,分别通过二甲苯和乙醇溶液进行去石蜡和再水化处理。将组织切片放入EDTA缓冲液中进行抗原修复,阻断内源性过氧化物酶活性,利用山羊血清封闭液室温封闭1 h。滴加抗hnRNPK抗体(购自英国Abcam公司,ab52600,1∶200)温育过夜,清洗后与生物素标记的二抗温育1 h,加入DAB显色液染色,苏木精显色,酸性乙醇分化,脱水和透化,最后用中性树胶封片。完成染色的切片使用数字病理图文采集系统DX300扫描仪进行扫描,软件分析图片结果。
1.13 统计学处理
计量资料以x±s表示,两组均数间比较采用独立样本t检验,多组均数比较采用单因素方差分析(One-Way ANOVA),组间两两比较使用LSD-t法。使用log-rank检验比较hnRNPK高表达组和低表达组的生存曲线之间是否存在显著差异,计算χ²值和P值并说明差异性。使用Cox比例风险回归模型估计风险比(hazard ratio,HR)值,将生存时间作为因变量,hnRNPK的表达情况作为自变量。如果HR=1则表示hnRNPK的表达情况对应总生存期的风险相同;HR>1则表示hnRNPK的表达情况针对总生存期的风险较高,反之较低。P<0.05为差异有统计学意义。采用SPSS 26.0软件对数据进行统计学分析,GraphPad Prism 9.0软件进行统计分析并绘制结果柱状图。
2 结 果
2.1 hnRNPK在乳腺癌中的表达及与患者预后的相关性
泛癌分析和TCGA基因差异分析数据来源于TCGA公共数据库,获得各种常见肿瘤组织和正常组织关于hnRNPK转录组的大阵列表达矩阵。使用R语言的TCGA plot软件包进行差异分析和箱线图可视化。结果显示hnRNPK在BRCA (乳腺癌)、COAD(结肠癌)、ESCA(食管癌)、LUAD(肺腺癌)等多种恶性肿瘤中的表达高于正常组织(图1A,P<0.01);癌组织中hnRNPK的表达较正常组织明显上调(图1B,P<0.01);同时纳入GEO数据库GSE36295和GSE42568子集绘制小提琴图,结果显示, hnRNPK在肿瘤组织中的表达水平较正常组织明显升高(图1C,P<0.05),且GSE45255和GSE69031数据集绘制生存曲线,结果显示,高表达hnRNPK组患者OS较低表达组期间更差(图1D,P<0.05);Kaplan-Meier曲线显示,与hnRNPK低表达患者相比,hnRNPK高表达患者生存期较短(图1E,P<0.01)。以上结果表明,hnRNPK在乳腺癌中呈高表达,且与患者预后不良相关。
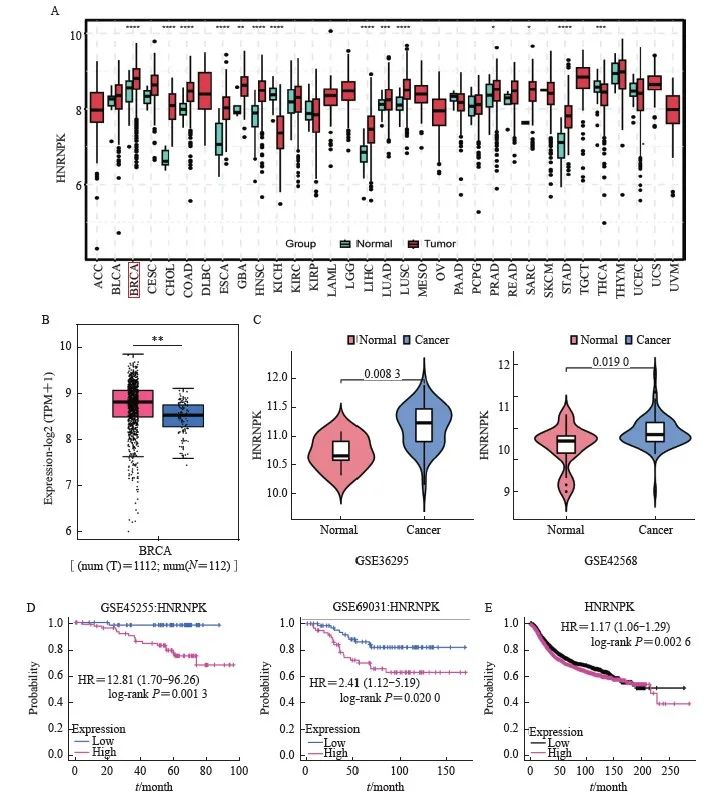
图1 hnRNPK 在乳腺癌中的表达及与患者预后的相关性
Fig. 1 Expression of hnRNPK in breast cancer and its correlation with patient's prognosis
A: hnRNPK pan cancer analysis; B: Analysis of hnRNPK expression in breast cancer tissues using TCGA database; C: Expression of hnRNPK in breast cancer tissue and normal tissue from GSE36295, GSE42568 in GEO database; D: GSE45255 and GSE69031 dataset analysis of survival prognosis of hnRNPK; E: Kaplan-Meier curve analysis of hnRNPK in breast cancer.
2.2 hnRNPK在乳腺癌组织及细胞系中呈高表达
为了验证hnRNPK在乳腺癌中的表达,收集来自宁夏医科大学总医院10例乳腺癌患者癌组织及配对的癌旁组织标本,Western blot检测结果显示,与癌旁组织(N)相比,癌组织(T)中hnRNPK表达明显上调(图2A),免疫组织化学染色结果与Western blot结果一致(图2C)。进一步通过Western blot和qRT-PCR检测hnRNPK mRNA及蛋白在乳腺癌细胞系MCF-7、T47D、BT474、MDA-MB-231中的表达,结果显示,与人正常乳腺上皮细胞MCF-10A相比,乳腺癌细胞系中hnRNPK mRNA表达及蛋白水平均显著增加(图2B、D,P<0.05)。以上结果表明,hnRNPK在乳腺癌组织及细胞中呈高表达。
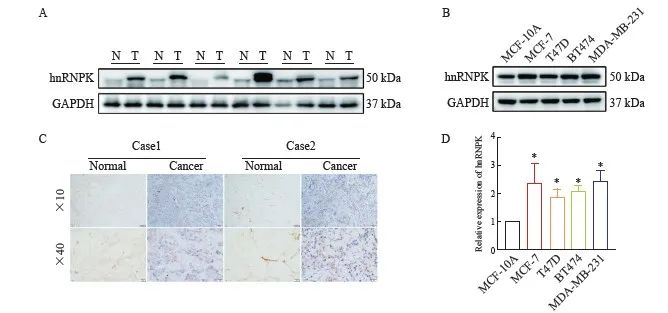
图2 hnRNPK在乳腺癌组织及细胞中的表达
Fig. 2 Expression of hnRNPK in breast cancer tissues and cells
A: Western blot was used to verify the expression of hnRNPK in breast cancer tissue; B: Determination of hnRNPK protein expression levels in normal breast cell lines (MCF-10A) and breast cancer cell lines (MCF-7, T47D, BT474 and MDA-MB-231); C: Immunohistochemistry staining of hnRNPK expression in breast cancer tissues and adjacent normal tissues; D: Determination of hnRNPK mRNA expression levels in MCF-10A and breast cancer cell lines. N: Normal; T: Tumor. *: P<0.05, compared with MCF-10A.
2.3 敲低hnRNPK抑制乳腺癌细胞增殖
选择hnRNPK相对表达较高的MDA-MB-231、MCF-7细胞系,通过转染siRNA构建hnRNPK敲低模型,利用qRT-PCR和Western blot验证敲低效率。结果显示,与对照组(control)和转染空载体组(NC)相比,敲低组(si-hnRNPK)hnRNPK mRNA表达及蛋白水平显著降低,表明敲低载体转染成功(图3A、B, P<0.05)。CCK-8实验结果显示,与对照组、NC组相比,si-hnRNPK组细胞增殖曲线明显被抑制(图3C,P<0.05);平板克隆实验结果显示,敲低组细胞增殖能力较对照组和NC组明显降低(图3D,P<0.05),与CCK-8实验结果一致。以上结果表明,敲低hnRNPK可显著抑制细胞增殖能力。

图3 hnRNPK对乳腺癌细胞增殖能力的影响
Fig. 3 The impact of hnRNPK on the proliferation ability of breast cancer cells
A: qRT-PCR was used to verify the knockdown effect of hnRNPK mRNA in MDA-MB-231 and MCF-7 cell lines; B: Western blot assay verified the knockdown effect of hnRNPK protein in both of cells; C: CCK-8 assays were used to detect the effect of hnRNPK knockdown on the viability of cells; D: Representative images of and quantification of clone formation. P<0.05, compared with control group and NC group.
2.4 hnRNPK与铁死亡信号转导通路密切相关
进一步研究hnRNPK对乳腺癌细胞表型的调控作用,选择对照组和si-hnRNPK组的MCF-7细胞进行RNA-seq分析,使用DESeq2软件进行筛选差异表达基因;以Fold Change≥1.5且FDR<0.05作为筛选标准判断基因表达量在两组之间是否存在差异。共筛选出203个上调基因和115个下调基因,对筛选出的所有差异表达基因进行层次聚类分析,并通过聚类热图进行展示(图4A)。应用超几何检验,将差异显著基因进行KEGG富集分析。采用ClusterProfiler对富集结果使用气泡图进行可视化,发现敲低hnRNPK显著富集铁死亡、凋亡、Wnt/β-catenin信号转导通路(图4B)。为了验证测序结果,通过Western blot检测铁死亡关键蛋白FACL4、HO-1、SLC7A11、GPX4表达,结果显示,与对照组相比,si-hnRNPK组诱导铁死亡蛋白FACL4、HO-1水平升高,抑制铁死亡蛋白SLC7A11、GPX4水平降低(图4C,P<0.05)。以上结果表明,hnRNPK异常表达与细胞铁死亡表型密切相关。

图4 hnRNPK与铁死亡信号转导通路密切相关
Fig. 4 hnRNPK is closely related to the ferroptosis signaling pathway
A: RNA-seq clustering heatmap analysis; B: KEGG pathway enrichment analysis; C: Western blot was used to detect ferroptosis-related proteins in MDA-MB-231 and MCF-7 cells after hnRNPK knockdown; P<0.05, compared with control group and NC group.
2.5 敲低hnRNPK促进细胞铁死亡
为了通过体外细胞实验验证RNA-seq富集结果,我们首先通过流式细胞术检测脂质活性氧ROS水平,结果发现,敲低hnRNPK促使MDA-MB-231和MCF-7细胞ROS水平升高(图5A);利用MDA比色法进行脂质过氧化检测,结果显示,敲低组细胞内MDA水平显著高于对照组(图5B);GSH检测结果显示,敲低组细胞内GSH水平低于对照组(图5C);应用Fe2+荧光染色试剂对乳腺癌细胞内Fe2+进行荧光染色,发现敲低组荧光强度较对照组增强(图5D)。以上结果表明,敲低hnRNPK促进乳腺癌细胞铁死亡。

图5 hnRNPK对铁死亡表型的影响
Fig. 5 The impact of hnRNPK on the ferroptosis phenotype
A: Flow cytometry analysis of knocking down hnRNPK on ROS levels in breast cancer cells; B: Changes in MDA levels in breast cancer cells after knocking down hnRNPK; C: Changes in GSH levels in breast cancer cells after knocking down hnRNPK; D: Fe2+ ion fluorescent probe observation of Fe2+ levels in cells; P<0.05, compared with control group and NC group.
2.6 铁死亡抑制剂(ferrostatin-1,Fer-1)可逆转hnRNPK敲低对细胞铁死亡的促进作用
为了明确敲低hnRNPK是否通过诱导铁死亡抑制乳腺癌恶性进展,我们利用Fer-1处理细胞,结果发现单用Fer-1抑制脂质过氧化ROS和MDA产生,联合敲低hnRNPK可以回复hnRNPK下调对ROS和MDA的促进作用(图6A、B);GSH表达结果与上述结果相反(图6C);Fe2+荧光染色结果显示,与Control组相比,Fer-1处理组Fe2+荧光强度减弱,联合hnRNPK敲低组Fe2+荧光强度有所增强(图6D)。Western blot进一步检测铁死亡蛋白的水平,结果显示,与单独敲低hnRNPK作用相比,联合Fer-1处理导致FACL4表达水平降低,SLC7A11和GPX4表达升高,(图6E)。以上结果表明,hnRNPK敲低对细胞铁死亡的促进作用可以通过Fer-1作用有效逆转。
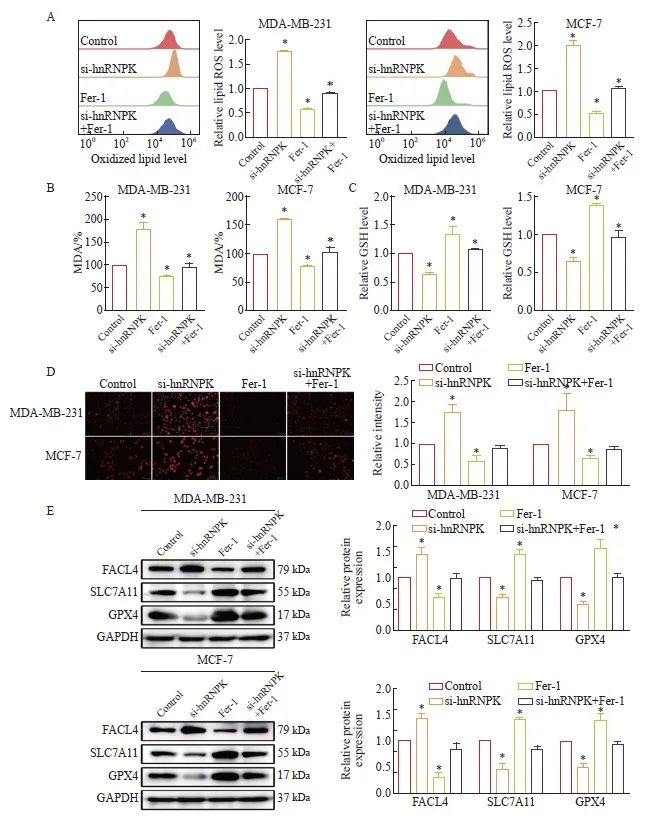
图6 Fer-1联合si-hnRNPK作用对细胞铁死亡的影响
Fig. 6 The combined action of Fer-1 and si-hnRNPK on cell ferroptosis
A: The impact of flow cytometry analysis of Fer-1 combined with si-hnRNPK on the ROS levels in breast cancer cells; B: Changes in the MDA levels within breast cancer cells after Fer-1 combined with si-hnRNPK; C: Changes in the GSH levels within breast cancer cells after Fer-1 combined with si-hnRNPK; D: Observation of Fe2+ ion fluorescent probe on the levels of Fe2+ within cells after Fer-1 combined with si-hnRNPK treatment; E: Western blot detection of the effect of Fer-1 on the expression levels of ferroptosis marker proteins; P<0.05, compared with control group.
2.7 敲低hnRNPK抑制Wnt/β-catenin信号转导通路
前期RNA-seq KEGG通路富集分析提示, hnRNPK与Wnt信号转导通路密切相关。为了验证测序结果,利用Western blot检测hnRNPK对Wnt/β-catenin信号转导通路核心蛋白表达的影响。结果显示,与Control组和NC组相比,si-hnRNPK组复合物蛋白APC、GSK-3β、CK1α表达升高,β-catenin和下游蛋白c-Myc表达降低,表明敲低hnRNPK促进细胞质复合物APC、GSK-3β、CK1α形成,增加对细胞质β-catenin蛋白的降解作用,抑制Wnt/β-catenin信号转导通路,导致下游蛋白c-Myc表达减少(图7)。

图7 hnRNPK对Wnt/β-catenin信号转导通路的影响
Fig. 7 The impact of hnRNPK on the Wnt/β-catenin signaling pathway
Western blot was performed to detect the expression levels of proteins related to the Wnt/β-catenin signaling pathway; P<0.05, compared with control group and NC group.
3 讨 论
乳腺癌已成为严重威胁女性健康的疾病,癌症进展主要源于程序或治疗诱导的细胞凋亡抵抗。因此,急需寻找乳腺癌新的分子靶标以改善患者预后。hnRNPK是一种核质穿梭蛋白,是hnRNPs亚家族的一员,在人类基因中广谱表达[13]。hnRNPK功能复杂多变,在不同的癌症类型中可能具有不同的作用机制。研究发现hnRNPK通过调控CLCN3表达促进肿瘤细胞与CAF相互作用,诱导肺腺癌的进展和侵袭[10]。Xi等[14]研究证实LINC00571可以与hnRNPK相互作用促使IDH2表达失调,调节三羧酸循环代谢物影响三阴性乳腺癌的进展。本研究联合TCGA和GEO公共数据库分析发现,hnRNPK在乳腺癌组织中表达显著上调,且与患者不良预后相关;进一步利用乳腺癌手术切除标本和细胞系验证发现,hnRNPK在乳腺癌组织和细胞系中呈高表达,与数据库结果一致。体外细胞功能实验结果表明,敲低hnRNPK抑制乳腺癌细胞增殖能力。以上研究结果表明,hnRNPK作为癌基因与乳腺癌的发生、发展密切相关,可能作为乳腺癌诊疗的潜在靶点。
hnRNPs是一个蛋白超家族,已经发现有20多种蛋白,其作为RNA结合蛋白直接作用于pre-mRNA的特定区域,对mRNA选择性剪切、运输、翻译等核酸代谢过程具有调控作用。近年来,研究发现hnRNPs家族的其他成员在肿瘤铁死亡调控过程中发挥重要作用。Zhou等[15]报道hnRNPL通过靶向YY1/PD-L1轴,抑制细胞铁死亡促进去势抵抗性前列腺癌免疫逃逸。Yang等[16]发现,CUL9通过hnRNPC泛素化促进结直肠癌细胞增殖,抑制铁死亡发生,最终诱导肿瘤形成。然而,关于hnRNPK如何参与乳腺癌铁死亡的发生发展过程尚不清楚。
为了研究hnRNPK在乳腺癌铁死亡中的作用,我们利用RNA-seq数据分析发现敲低hnRNPK显著富集铁死亡、凋亡信号转导通路,并在体外细胞层面验证敲低hnRNPK导致脂质过氧化ROS和MDA水平升高,GSH表达降低。铁死亡是以铁依赖为机制、过度脂质过氧化为特征的调节性细胞死亡,包括谷胱甘肽过氧化物酶4 (GPX4)调节途径、铁代谢途径、脂代谢途径三种方式[17],与各种类型肿瘤的发生和治疗反应密切相关[18]。本研究采用Western blot检测铁死亡抑制蛋白SLC7A11和GPX4的表达,发现敲低hnRNPK导致SLC7A11和GPX4蛋白表达降低,初步判断hnRNPK对乳腺癌细胞铁死亡抵抗具有调控作用。进一步探索hnRNPK对乳腺癌细胞铁死亡的影响及其机制,本研究采用Fer-1处理细胞,发现Fer-1可以有效地逆转hnRNPK敲低对细胞铁死亡的促进作用。以上结果表明hnRNPK下调通过促进铁死亡而抑制乳腺癌细胞恶性增殖。
研究[19]发现,hnRNPK与PROX1相互作用激活Wnt/β-catenin信号转导通路促进乳腺癌细胞侵袭转移;另一项研究[20]证实Wnt/β-catenin通路可以参与hnRNPK驱动的头颈部恶性肿瘤增殖和转移抑制过程[20]。Wnt/β-catenin通路在人类癌症中广泛存在,其异常激活与癌症发病、进展、恶性转化等诸多方面紧密相关[21-22]。乳腺癌是第一个被证实与Wnt信号转导通路相关的癌症,参与乳腺癌增殖、转移、免疫微环境调节和治疗耐药等[23]。β-catenin是该通路的核心介质,由APC、GSK-3β、CK1α复合物共同调控,β-catenin激活可增强下游分子c-Myc表达,提高其转录效率。为了探究hnRNPK与Wnt通路在乳腺癌中的调控关系,本研究发现敲低hnRNPK促进细胞质复合物APC、GSK-3β、CK1α形成,增加对细胞质β-catenin蛋白的降解作用,抑制Wnt/β-catenin信号转导通路。
综上所述,本研究从生物信息学及细胞学层面证实hnRNPK在乳腺癌中呈高表达,敲低hnRNPK抑制乳腺癌细胞增殖,其作用机制可能是hnRNPK通过激活Wnt/β-catenin通路促进细胞铁死亡抵抗,进而促进乳腺癌细胞恶性增殖。本研究表明hnRNPK可能是经铁死亡途径调控乳腺癌诊治的潜在靶点,但由于缺乏体内实验验证, hnRNPK影响乳腺癌铁死亡及进展的具体分子机制有待进一步探索。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:马小兰:操作实验,处理数据,撰写文章;王娟:完成免疫组织化学染色及分析;石斌:收集及整理数据;王南:生物信息学分析;田治翠:文献调研与整理;曹佳:设计实验,修改文章,提供经费。
[参考文献]
[1] BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263.
[2] WANG Z L, LI S Q, XU F, et al. ncRNAs-mediated high expression of TIMM8A correlates with poor prognosis and act as an oncogene in breast cancer[J]. Cancer Cell Int, 2022, 22(1): 177.
[3] GADALETA E, THORN G J, ROSS-ADAMS H, et al. Field cancerization in breast cancer[J]. J Pathol, 2022, 257(4): 561-574.
[4] SUI S Y, XU S P, PANG D. Emerging role of ferroptosis in breast cancer: new dawn for overcoming tumor progression[J]. Pharmacol Ther, 2022, 232: 107992.
[5] LEI G, ZHUANG L, GAN B Y. Targeting ferroptosis as a vulnerability in cancer[J]. Nat Rev Cancer, 2022, 22(7): 381-396.
[6] WANG Z Y, QIU H, HE J B, et al. The emerging roles of hnRNPK[J]. J Cell Physiol, 2020, 235(3): 1995-2008.
[7] ZHOU W W, JIE Q L, PAN T, et al. Single-cell RNA binding protein regulatory network analyses reveal oncogenic HNRNPK-MYC signalling pathway in cancer[J]. Commun Biol, 2023, 6(1): 82.
[8] LEE W J, SHIN C H, JI H, et al. hnRNPK-regulated LINC00263 promotes malignant phenotypes through miR-147a/CAPN2[J]. Cell Death Dis, 2021, 12(4): 290.
[9] MUCHA B, QIE S, BAJPAI S, et al. Tumor suppressor mediated ubiquitylation of hnRNPK is a barrier to oncogenic translation[J]. Nat Commun, 2022, 13(1): 6614.
[10] LI Y X, YANG Y, MA Q, et al. HNRNPK/CLCN3 axis facilitates the progression of LUAD through CAF-tumor interaction[J]. Int J Biol Sci, 2022, 18(16): 6084-6101.
[11] IWABUCHI E, MIKI Y, SUZUKI T, et al. Heterogeneous nuclear ribonucleoprotein K is involved in the estrogensignaling pathway in breast cancer[J]. Int J Mol Sci, 2021, 22(5): 2581.
[12] GALLARDO M, LEE H J, ZHANG X R, et al. hnRNP K is a haploinsufficient tumor suppressor that regulates proliferation and differentiation programs in hematologic malignancies[J]. Cancer Cell, 2015, 28(4): 486-499.
[13] XU Y J, WU W, HAN Q, et al. Post-translational modification control of RNA-binding protein hnRNPK function[J]. Open Biol, 2019, 9(3): 180239.
[14] XI Z H, HUANG H H, HU J, et al. LINC00571 drives tricarboxylic acid cycle metabolism in triple-negative breast cancer through HNRNPK/ILF2/IDH2 axis[J]. J Exp Clin Cancer Res, 2024, 43(1): 22.
[15] ZHOU X M, ZOU L B, LIAO H Y, et al. Abrogation of HnRNP L enhances anti-PD-1 therapy efficacy via diminishing PD-L1 and promoting CD8+ T cell-mediated ferroptosis in castrationresistant prostate cancer[J]. Acta Pharm Sin B, 2022, 12(2): 692-707.
[16] LV Y, TANG W T, ZHANG Z Y, et al. Cullin-9/p53 mediates HNRNPC degradation to inhibit erastin-induced ferroptosis and is blocked by MDM2 inhibition in colorectal cancer[J]. Oncogene, 2022, 41(23): 3210-3221.
[17] ZHANG C, LIU X Y, JIN S D, et al. Ferroptosis in cancer therapy: a novel approach to reversing drug resistance[J]. Mol Cancer, 2022, 21(1): 47.
[18] CHEN X, KANG R, KROEMER G, et al. Broadening horizons: the role of ferroptosis in cancer[J]. Nat Rev Clin Oncol, 2021, 18(5): 280-296.
[19] ZHU L Z, TIAN Q, GAO H, et al. PROX1 promotes breast cancer invasion and metastasis through WNT/β-catenin pathway via interacting with hnRNPK[J]. Int J Biol Sci, 2022, 18(5): 2032-2046.
[20] LIU H F, CHEN X H, YANG X J, et al. Involvement of the Wnt/β-catenin signaling pathway in the heterogenous nuclear ribonucleoprotein K-driven inhibition of proliferation and migration in head and neck squamous cell carcinoma[J]. Oncol Lett, 2020, 20(6): 394.
[21] YU F Y, YU C H, LI F F, et al. Wnt/β-catenin signaling in cancers and targeted therapies[J]. Signal Transduct Target Ther, 2021, 6(1): 307.
[22] LIU J Q, XIAO Q, XIAO J N, et al. Wnt/β-catenin signalling: function, biological mechanisms, and therapeutic opportunities[J]. Signal Transduct Target Ther, 2022, 7(1): 3.
[23] XU X F, ZHANG M F, XU F Y, et al. Wnt signaling in breast cancer: biological mechanisms, challenges and opportunities[J]. Mol Cancer, 2020, 19(1): 165.


