肝癌切除或肝移植,哪个应优先考虑?
时间:2024-11-27 21:00:42 热度:37.1℃ 作者:网络
原发性肝细胞癌(HCC)是一种原发于肝脏的恶性肿瘤,是世界范围内最常见的五大恶性肿瘤之一,其病死率也高居全球癌症的第四位。每年我国新诊断HCC和死于HCC的患者40余万例,发病及死亡人数约占世界的一半。我国HCC具有发病率高、诊断晚、病死率和复发率高等特点,预后较差。
早期HCC可通过手术切除或肝移植而治愈。近期,首都医科大学附属北京佑安医院王孟龙教授分享了肝癌的外科治疗方法、时机与中长期效果。肝癌在线特将精华整理成文,以飨读者。
一 原发性肝癌治疗的概述
HCC是原发于肝脏上的恶性实体肿瘤,其特点之一是不受控制地生长,可以发出持续增殖信号,有无限复制潜力。其特点之二是侵袭性占位,容易浸润和转移。逃避生长抑制信号,抵抗细胞死亡并诱发血管再生为其侵袭行为提供了保障。多结节性HCC可分为单中心起源和多中心起源,即肝内转移(IM)和多中心发生(MO)。
HCC的治疗方式包括手术治疗和非手术治疗。手术治疗包括肝切除、肝移植,可能根治HCC。非手术治疗包括局部治疗(介入、消融、放疗)和系统治疗(靶向药物、免疫治疗)。一般的治疗策略是首选手术、消融这种根治性治疗方式,但只有20%~30%的肝癌病人有手术机会。如果不具备能根治条件,则努力通过非根治性手段实现。不可手术的患者可以进行转化治疗,经治疗后达到手术条件。有指征可手术,但预期达不到根治效果的患者可以进行新辅助治疗。在肝移植前,可以进行桥接治疗或降期治疗。如果患者手术后复发风险较高,可以后续进行辅助治疗。如果仍然实现不了,则继续非根治性治疗。
HCC患者的治疗决策依据肿瘤分期、肝脏功能及全身状况。肝癌分期主要依据其标志性影像学表现:①肿瘤大小;②个数;③大血管癌栓;④淋巴结转移;⑤远处转移。BCLC分期[1]增加了肝功能及全身状况,目前又增添了血清学肿瘤标志物,目的是推荐治疗策略,预测预后(图1)。CNLC分期强调以手术为主的综合治疗策略。
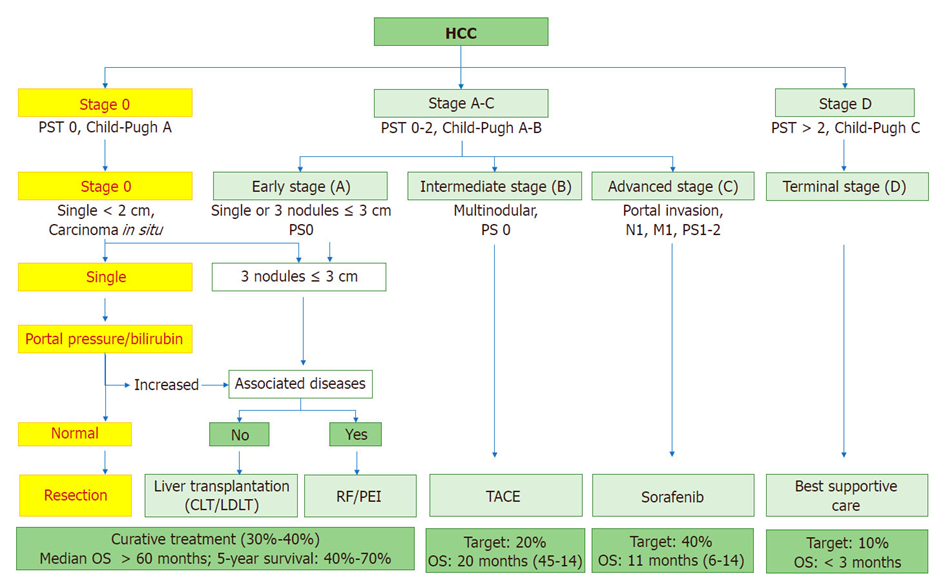
图1. HCC的BCLC分期
对于外科医生来说,关注的影像学要点是肿瘤的大小、个数、侵犯范围和与大血管的关系。①大小及个数:大的、单中心的肿瘤一般恶性程度较低,尽量切除;小的肿瘤可能是单中心或多中心,建议消融或微创切除;如果是多个肿瘤,一大加一小集中于门脉路径走行,可能是单中心起源,不建议消融;大小相当,较分散的可能是多中心起源可能,建议消融、微创切除或移植。②侵犯范围:半肝以内,可以切除或消融;超过半肝,建议肝移植或系统治疗。如果有淋巴结或远处转移,建议系统治疗或放疗。③与大血管的关系:紧邻或侵犯或疑似侵犯可切除的大血管,建议解剖性肝切除;紧邻或侵犯或疑似侵犯必须保留的大血管,建议非解剖性切除,除非有包膜或者肝移植。
肿瘤与大血管的关系是最关键的地方。①贴近可以切除的大血管可以解剖性切除。②贴近必须保留的大血管则难以实施宽切缘的解剖性切除。解剖性切除存在大出血风险,所保留的大血管可能存在血供或回流问题,还可能影响残肝容积,最好肝移植。③侵犯(或癌栓)或疑似侵犯(边界模糊,形态不规则)的大血管如果只有一支或同侧两支,可以中肝叶切除、半肝或超半肝切除;如果侵犯的大血管有两支以上或一侧一支,则不可以切除,最好肝移植。④有包膜的肿瘤压迫大血管,可以剥离肿瘤进行非解剖性切除。
二 手术治疗
HCC的手术治疗方式包括肝癌切除术和肝移植。肝癌切除术是切除肿瘤和部分肝组织,在肝内离断血管胆管然后闭合,要求残留肝组织质量足够。肝移植是切除肿瘤和整个病肝,离断受体肝外血管胆管然后与供体重建,要求供肝质量良好。
1 肝癌切除术
肝切除方式包括解剖性肝切除术和非解剖性肝切除术。解剖性肝切除术是肝癌肝切除的首选手术方式,要求完整切除解剖上相对独立的肝段、亚段或联合肝段,完成切除病灶和相应门静脉分支流域的肝组织,理论上可以降低肿瘤随门静脉血流在肝段播散转移的风险,并可减少术后并发症的发生。研究显示[2],解剖性肝切除5年生存率与无瘤生存率都比非解剖性肝切除高。在肿瘤有完整包膜,或者患者肝硬化严重,肝功能Child B级,合并门静脉高压症,肝功能储备差,肿瘤紧邻必须保留的重要血管时,可以行非解剖性肝切除术。
肝切除范围主要根据肿瘤占据的肝段数来决定,最大可切除肝段数必须小于最低保留肝段数。外生性肿瘤大小一般不影响切除的可行性(图2)。
图2. IVb段局部肿瘤切除加胃、横结肠切除
除了肝移植,几乎所有肝癌治疗手段对肝功能都有要求,以便耐受各种治疗手段对肝功能的打击。选择肝切除方式时除关注肝功能的Child pugh分级外也要重视肝功能贮备的作用。对于门静脉高压症的患者,部分可以做小范围切除/腹腔镜下的消融± 脾动脉结扎/脾切除/TIPS。对于多数没有腹腔开腹手术病史的病人,微创外科(腹腔镜与机器人)达到几乎与开腹切除相当的手术效果。腹腔镜扩大了消融的适应证如邻近胆囊、左侧膈肌或其它与周围脏器相邻的表面肿瘤。此外,腹腔镜的探查作用可以增加消融的安全性。
2 肝移植
相对于肝切除,肝移植具有以下三个突出特点:高风险、高投入、高回报。中国肝移植注册中心数据显示,2018-2020年国内肝移植数量平均约6000例/年,其中肝癌肝移植占比为35.0%,佑安医院约占48.5%。肝移植手术分类如图3所示。肝移植是风险最大的手术,常应用于无法肝切除的病例。
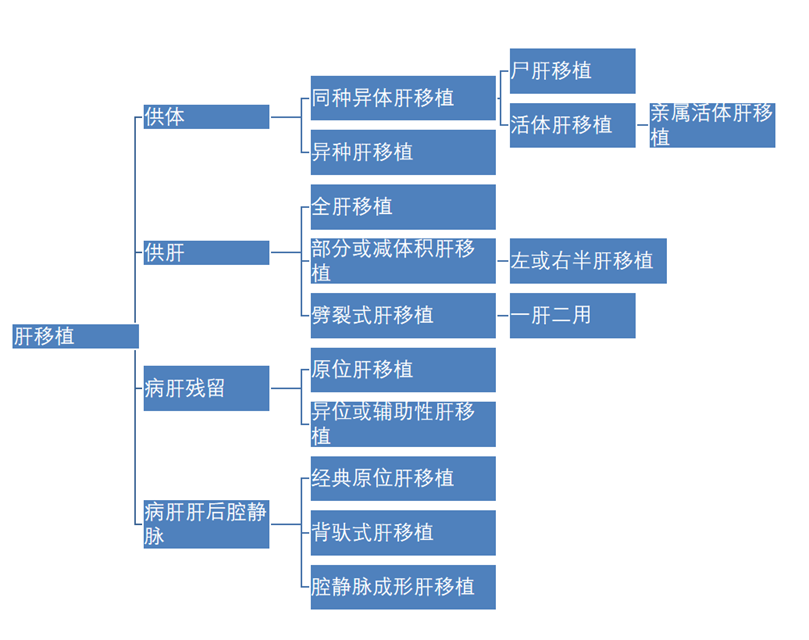
图3. 肝移植手术分类
肝移植常用的标准是米兰标准和美国加州大学旧金山分校(UCSF)标准等。米兰标准的4年生存率为75%,肿瘤复发率小于10%;UCSF标准下1年生存率为90%,5年生存率为75.2%。
根据肝移植的目的可以分为抢救型肝移植、刚需型肝移植、改善型肝移植、奢侈型肝移植(图4)。
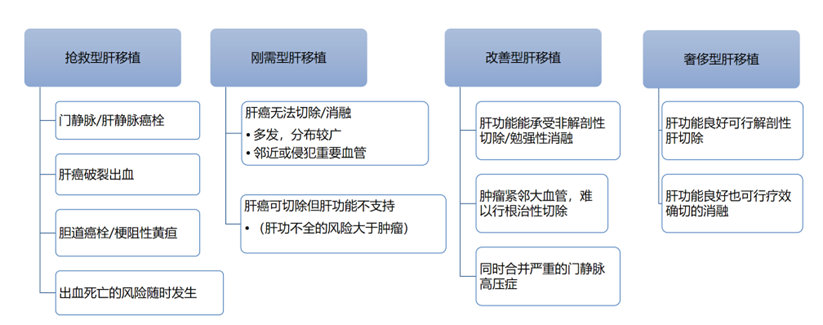
图4. 肝移植的目的分类
3 桥接治疗与降期治疗
桥接治疗是指患者符合移植标准,防止失去移植机会。桥接治疗常以微创治疗如经动脉化疗栓塞 (TACE)、消融为主,有时辅以一线靶向药物治疗。降期治疗是指超出移植标准,争取移植机会。降期治疗多以消融和TACE治疗为主,较大的肿瘤或者合并大血管癌栓者可在放射栓塞 (Y-90) 或立体定向放射治疗的基础上辅以靶向药物治疗或免疫治疗。
如果将HCC成功降期至米兰标准内,则移植后的长期无复发生存率和总生存率与符合米兰标准相当。如果降期不成功甚至肿瘤继续进展,则不适合移植。对于左半肝巨大肿瘤合并门静脉癌栓,或原发性肝癌消融后多发复发且双肺转移的患者,我们均有很多经介入±放疗±靶向药物治疗后成功降期的案例。
三 术后肿瘤复发
肝切除后复发多与肿瘤残留有关:①术前未发现(影像或肿瘤标志物局限);②术中切除不彻底;③术中挤压转移或脱落。残余肝脏新发肿瘤则是由于仍存在肝硬化基础及其它引起肿瘤恶变的原因如乙肝病毒等。
肝移植术后肿瘤复发则可能是由于超出米兰标准、病理报告肿瘤分化程度低、有微血管侵犯和卫星灶、或AFP >400 mg/dL。30–50% 病人复发通常发生在移植以后的2年以内,预后不良。一般认为弥漫性肝癌(全肝)肝移植术后效果不好,但是有一例弥漫性肝癌患者在肝移植术后继续靶向药物治疗3年,5年后仍无瘤生存。
复发后的治疗方式包括变更免疫抑制方案、再次手术切除、TACE、消融治疗、放射治疗、系统抗肿瘤治疗等综合治疗手段,免疫检查点抑制剂用于肝癌肝移植术前及术后的治疗仍需慎重。
对于先切除还是移植这一争议问题,有报道认为早期肝癌首选肝移植比补救肝移植效果好。事实上,与首选肝移植组相比,首选肝切除的生存率相似,如果首选肝移植,会增加移植排斥和免疫抑制相关的危险,移植可切除肝癌也会加剧供体紧张。因此,我个人建议“切除优先”。
参考文献
[1] Reig M, Forner A, Rimola J, et al. BCLC strategy for prognosis prediction and treatment recommendation: The 2022 update[J]. J Hepatol, 2022, 76(3): 681-693.
[2] Shindoh J, Makuuchi M, Matsuyama Y, et al. Complete removal of the tumor-bearing portal territory decreases local tumor recurrence and improves disease-specific survival of patients with hepatocellular carcinoma[J]. J Hepatol, 2016, 64(3): 594-600.


