Adv Sci 周菁/彭琴/张韬团队合作揭示静脉移植血管脂肪酸代谢重塑的力学调控机制
时间:2024-11-27 21:00:39 热度:37.1℃ 作者:网络
冠状动脉旁路移植术是阻塞性冠状动脉疾病患者的金标准治疗方法[1]。但50%的静脉移植物(Vein Graft, VG)在术后10年出现血管再狭窄乃至梗阻,严重影响预后[2]。动脉机械牵张诱导移植静脉平滑肌细胞(vascular smooth muscle cell, VSMC)过度增殖和迁移已被证明是导致移植物再狭窄的重要原因之一[3, 4],但作用机制仍不清楚。细胞外机械力可以通过细胞骨架传递到细胞核,导致核机械感受器的激活,如细胞质磷脂酶A2 (cytosolic Phospholipase A2, cPLA2)[5, 6]。cPLA2可水解磷脂,在脂质代谢中发挥重要作用[7]。周菁课题组2022年4月发表在Circulation Research上的研究发现,机械牵张促进VSMC代谢重编程,诱导氧化磷酸化到糖酵解的转变[8]。尽管有研究证明脂质代谢途径—如脂肪酸氧化(fatty acid oxidation, FAO)—参与了VSMC的功能调节[9, 10],但脂质代谢异常是否参与血管内病理性重塑过程少有研究。
2024年11月26日,北京大学基础医学院生理学与病理生理学系周菁课题组、深圳湾实验室彭琴课题组与北京大学人民医院张韬等合作在Advanced Science杂志在线发表了题为“Mechanical Activation of cPLA2 Impedes Fatty Acid β-Oxidation in Vein Grafts”的研究论文。该研究发现并证明了细胞核可感知机械牵张,通过机械信号转导途径抑制血管平滑肌细胞脂肪酸氧化水平,促进细胞增殖与迁移的新机制,为临床上动-静脉移植后血管再狭窄干预策略研究提供了新的见解。

研究者首先分析小鼠静脉移植物和下腔静脉的转录组学数据,发现线粒体FAO相关基因表达下调。由于动静脉瘘和动静脉移植手术后,出现相似的力学特性和病理学改变,研究者对临床病人动静脉瘘转录组学进行数据分析[11],也发现脂质代谢通路的表达下调。肉碱棕榈酰转移酶1-B (carnitine palmitoyltransferase1-B, CPT1B)位于线粒体外膜,将长链脂肪酰基辅酶从细胞质转运到线粒体,是脂肪酸β-氧化的关键酶。定量RT-PCR和免疫荧光显示,静脉移植物内膜层中CPT1B的表达较低。为进一步研究静脉移植物脂肪酸代谢是否受损,研究者给小鼠尾静脉注射荧光棕榈酸酯类似物BODIPY FL C16,体内成像显示,静脉移植物中BODIPY FL C16以脂滴的形式过度积聚。游离脂肪酸(FFA)含量检测显示,静脉移植物中的FFA含量显著高于下腔静脉。接下来,研究者使用体外机械牵张加载模型,分别采用5%和15%应变来模拟静脉和动脉力学条件,进行脂质组学分析表明,脂肪酸降解等途径受到影响。热图显示,15%拉伸下VSMCs中的长链脂肪(碳原子数超过18)水平更高。研究者进一步探索发现,机械牵张抑制FAO水平会导致活性氧含量增加,促进VSMC的增殖和迁移。
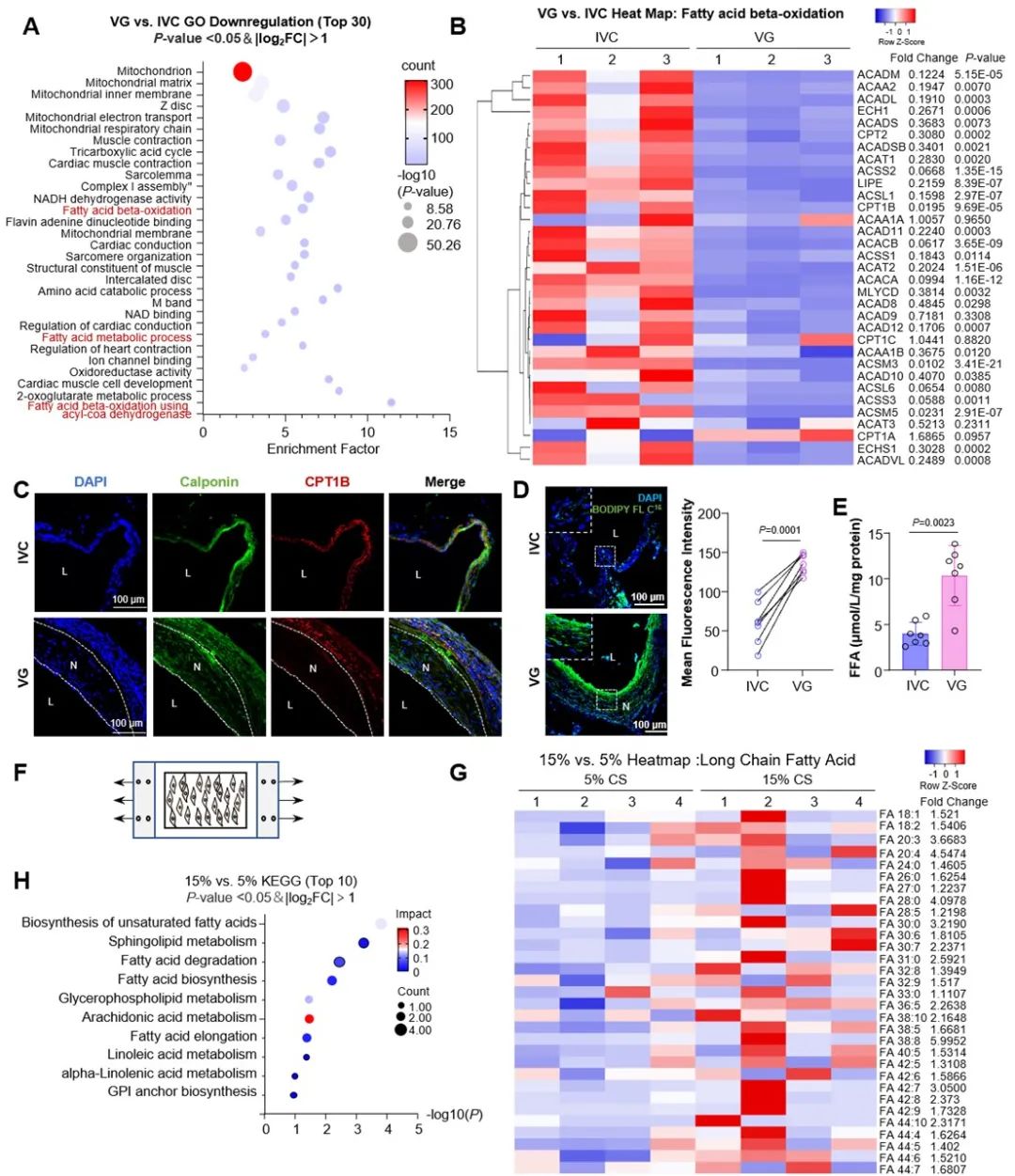
图1. 动-静脉移植和机械牵张抑制VSMCs中CPT1B表达和FAO水平
随后,研究者试图了解VSMCs如何感知和转导机械牵张以下调CPT1B表达并抑制FAO。cPLA2已被确定为能检测核膜膨胀的核机械传感器,周菁课题组2022年9月发表在Advanced Science上的研究发现cPLA2能感受不同的细胞几何形状[5]。深圳湾实验室彭琴团队与北京大学周菁团队在前期合作中,基于荧光共振能量转移(FRET)设计和开发了一种新型的Lamin A磷酸化传感器(Lamin A phosphorylation sensor,LAPS),实现了核膜张力的活细胞动态观测,低FRET效率能指示高核膜张力[12]。研究者利用LAPS和cPLA2-mCherry构建体转染细胞,低渗处理后发现核膜张力增加,cPLA2激活易位到核膜,这项工作显示出了LAPS探针在探究血管疾病力学机制中的实际应用。研究者将cPLA2酪氨酸-96和缬氨酸-97位点突变为丙氨酸(Y96A和V97A),降低cPLA2核膜亲和力,抑制了cPLA2的激活。沿Z轴的免疫荧光扫描显示,机械牵张诱导cPLA2从核质易位到核膜上。
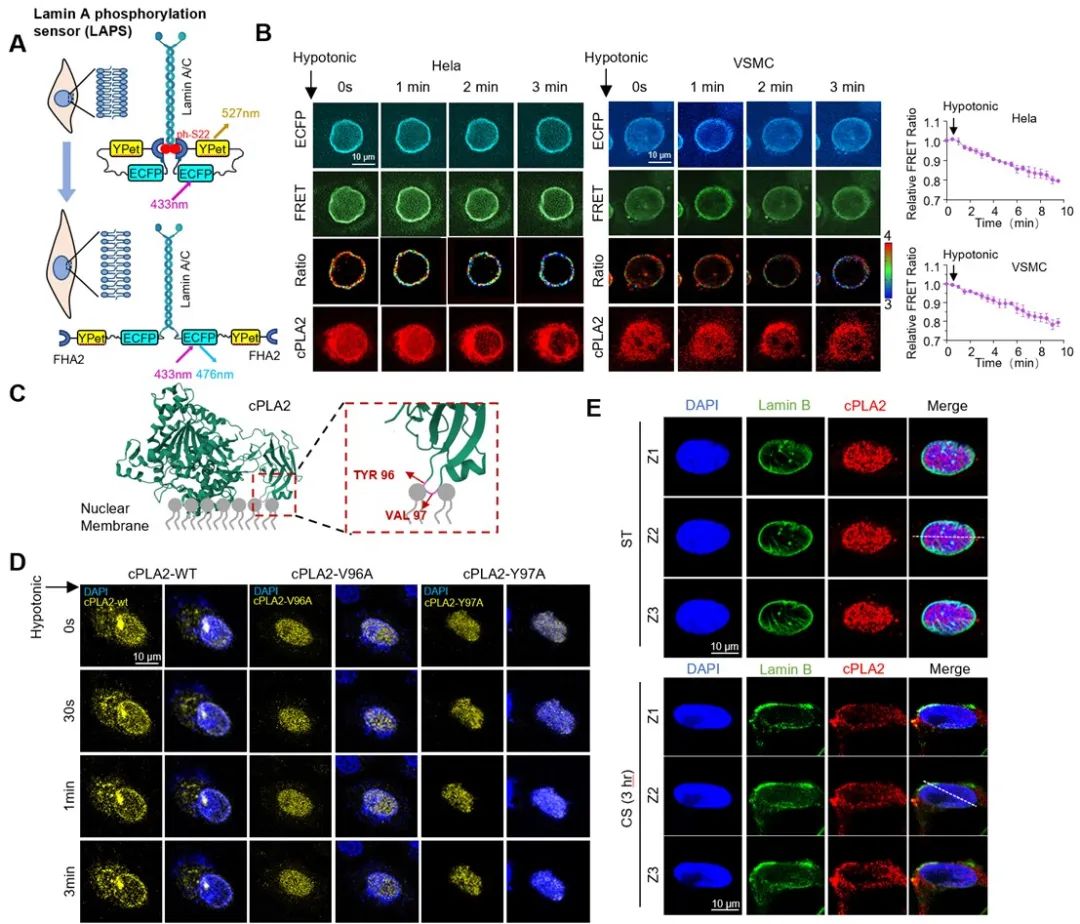
图2. 利用基于FRET原理的核膜张力探针证明机械牵张激活力学传感器cPLA2
那么cPLA2是如何调节CPT1B的表达?研究者使用CHEA3与JASPAR在线工具筛选出了可能发挥重要作用的转录因子YY1,与CPT1B启动子区域有23个潜在结合位点。利用抗YY1抗体进行染色质免疫沉淀(ChIP)试验表明,YY1与VSMCs中CPT1B启动子直接结合。YY1荧光素酶报告基因检测表明,ArAc抑制YY1的转录活性。经进一步探究,研究者发现机械牵张或ArAc处理不影响YY1 mRNA表达,而通过促进蛋白酶体途径降解来下调YY1的蛋白质水平,机械牵张增加了YY1泛素化水平。研究者进一步揭示了ArAc和YY1泛素化间的结构基础,将YY1赖氨酸-341位点突变为丙氨酸(L341A)减弱了ArAc诱导的YY1泛素化。然后,研究者评估了YY1对CPT1B表达和脂质代谢的调节。结果表明,YY1敲除抑制了CPT1B mRNA的表达,并导致脂肪酸在线粒体外积累。总之,这些发现表明cPLA2的机械激活通过促进转录因子YY1降解来下调CPT1B的表达。
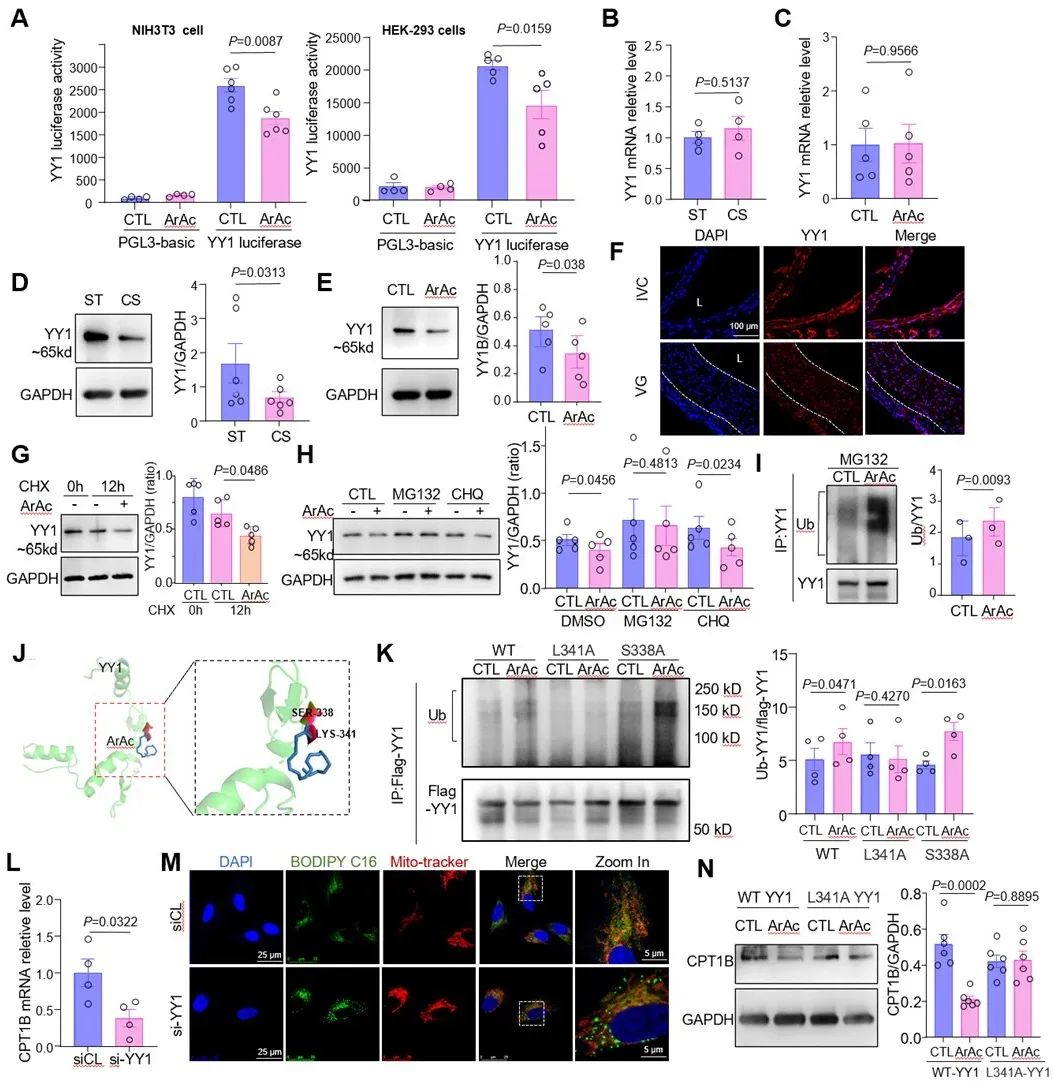
图3. cPLA2激活促进转录因子YY1泛素化降解以调控CPT1B表达
鉴于核膜主要由脂质双层组成,研究者提出假设:FAO水平失调会反馈调控核膜张力。使用LAPS传感器,研究者发现FAO抑制增加了核膜张力。为评估FAO失调下的细胞核脂质代谢变化,研究者提取细胞核进行了脂质组学分析,etomoxir导致细胞核中长链不饱和脂肪酸(UFA)及长链不饱和磷脂酰胆碱(PC 32-PC 40)富集,这能增加核膜的流动性和张力。相比之下,GW501516治疗降低了一些UFA和不饱和PC的水平。cPLA2的免疫荧光和ArAc检测表明,敲除CPT1B或YY1及etomoxir处理能诱导cPLA2激活。这些数据表明,在FAO抑制期间,膜成分的动态重塑导致核膜张力增加,从而协调cPLA2的激活。
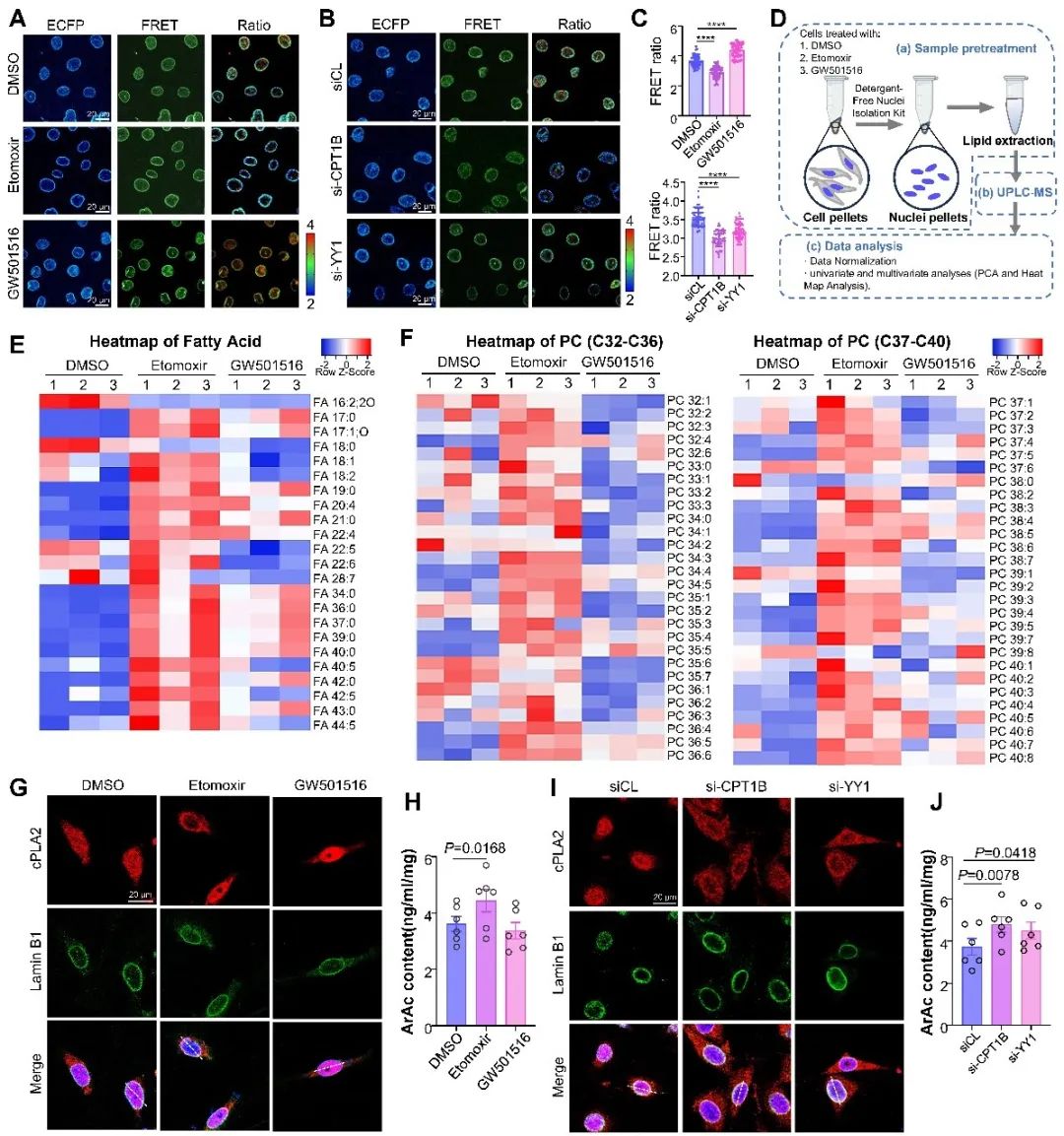
图4. FAO抑制通过影响核膜脂质成分增加核膜张力进一步激活cPLA2
研究者使用小鼠动静脉移植模型验证了上述分子机制。静脉在移植前用含CAY10650或DMSO的生理盐水孵育,结果显示,CAY10650处理减少了静脉移植物再狭窄面积,增加VSMCs中CPT1B表达,并抑制VSMC增殖。研究者构建了VSMC特异性Lamin A/C敲除小鼠(LMNA sKO),以获得核膜张力增加的静脉进行动静脉移植,在移植前用含Ad-CPT1B腺病毒生理盐水孵育静脉以过表达CPT1B。H&E染色及Ki67染色表明,使用LMNA sKO小鼠下腔静脉为供体会加重静脉移植物再狭窄和VSMC增殖,而病毒介导的CPT1B过表达则减轻了静脉移植物再狭窄及VSMC增殖。这些结果表明,靶向cPLA2-CPT1B通路可能是预防VG过度重塑的有效干预措施。
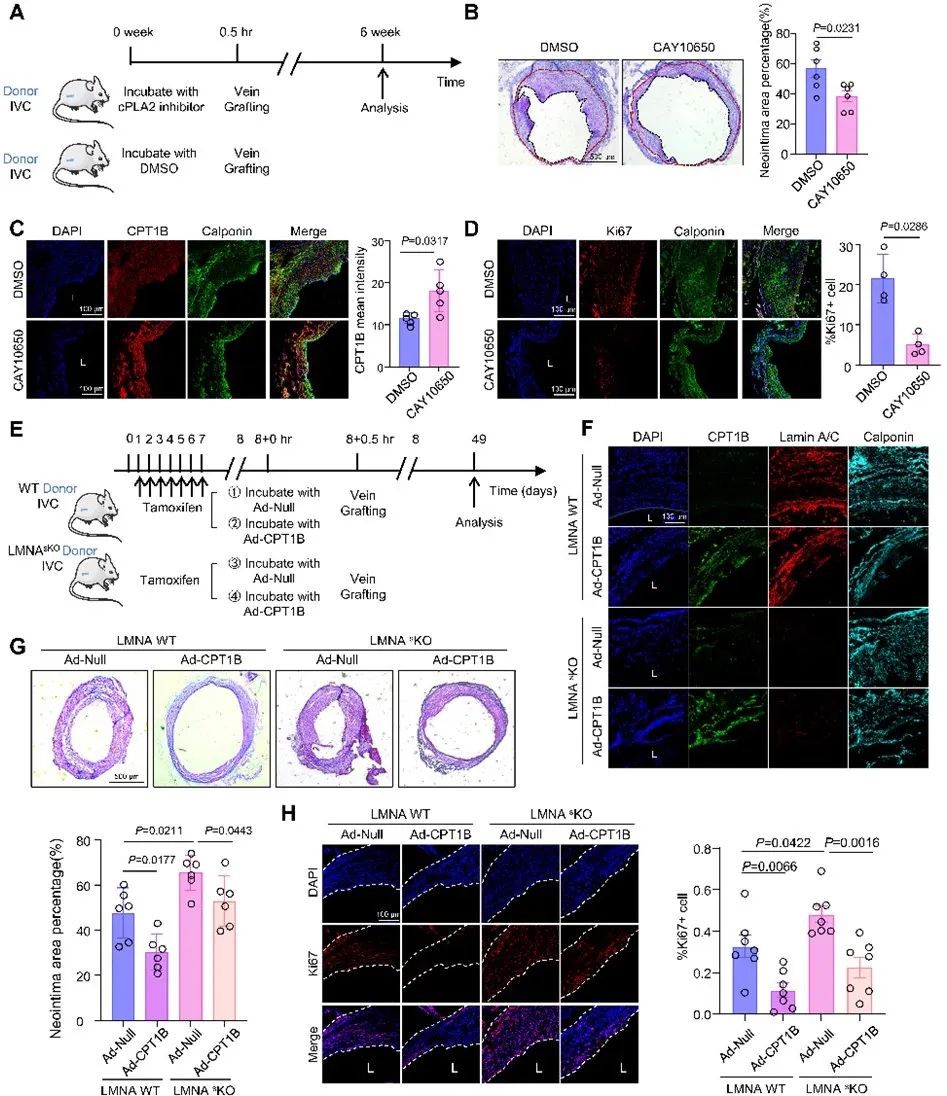
图5. 靶向cPLA2-CPT1B轴减轻静脉移植物再狭窄
综上,研究者提出,动脉系统高压作用于静脉管壁所引起的机械牵张激活cPLA2,生成花生四烯酸,介导YY1泛素化降解,导致CPT1B的转录抑制从而抑制FAO水平。此外,研究者发现FAO抑制会增加核膜张力,进一步协调cPLA2的激活。通过抑制cPLA2激活或过表达CPT1B来靶向cPLA2/YY1/CPT1B信号级联,可以减轻脂肪酸积累、细胞增殖及静脉移植物再狭窄,可能作为临床上预防血管再狭窄的有效干预措施。
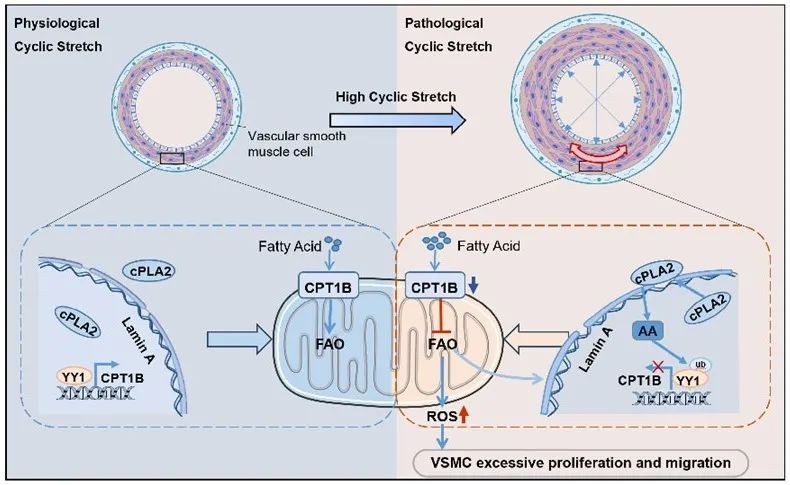
图6. cPLA2感知机械牵张通过ArAc-YY1-CPT1B通路调控FAO水平
北京大学基础医学院生理学与病理生理学系博士生樊林玮为该论文的第一作者,北京大学生理学与病理生理学系周菁教授、深圳湾实验室彭琴研究员和北京大学人民医院血管外科张韬教授为共同通讯作者。该工作还得到了北京大学心血管研究所郭宇轩研究员和冼勋德研究员的支持与帮助。该研究受到科技部和国家自然科学基金项目的资助。
一作面对面:
樊林玮,北京大学2017级基础医学八年制学生,周菁课题组,博士论文课题是机械牵张调控血管平滑肌细胞脂肪酸氧化的机制研究,曾获得国家奖学金、三好学生等奖项。
参考文献
[1] THUIJS D, KAPPETEIN A P, SERRUYS P W, et al. Percutaneous coronary intervention versus coronary artery bypass grafting in patients with three-vessel or left main coronary artery disease: 10-year follow-up of the multicentre randomised controlled SYNTAX trial [J]. Lancet, 2019, 394(10206): 1325-34.
[2] CAMPEAU L, ENJALBERT M, LESPéRANCE J, et al. Atherosclerosis and late closure of aortocoronary saphenous vein grafts: sequential angiographic studies at 2 weeks, 1 year, 5 to 7 years, and 10 to 12 years after surgery [J]. Circulation, 1983, 68(3 Pt 2): Ii1-7.
[3] OWENS C D. Adaptive changes in autogenous vein grafts for arterial reconstruction: clinical implications [J]. J Vasc Surg, 2010, 51(3): 736-46.
[4] WADEY K, LOPES J, BENDECK M, et al. Role of smooth muscle cells in coronary artery bypass grafting failure [J]. Cardiovasc Res, 2018, 114(4): 601-10.
[5] LIU H, LIU Y, WANG H, et al. Geometric Constraints Regulate Energy Metabolism and Cellular Contractility in Vascular Smooth Muscle Cells by Coordinating Mitochondrial DNA Methylation [J]. Adv Sci (Weinh), 2022, 9(32): e2203995.
[6] ENYEDI B, JELCIC M, NIETHAMMER P. The Cell Nucleus Serves as a Mechanotransducer of Tissue Damage-Induced Inflammation [J]. Cell, 2016, 165(5): 1160-70.
[7] MURAKAMI M. The phospholipase A(2) superfamily as a central hub of bioactive lipids and beyond [J]. Pharmacol Ther, 2023, 244: 108382.
[8] TANG Y, JIA Y, FAN L, et al. MFN2 Prevents Neointimal Hyperplasia in Vein Grafts via Destabilizing PFK1 [J]. Circ Res, 2022, 130(11): e26-e43.
[9] LEGCHENKO E, CHOUVARINE P, BORCHERT P, et al. PPARγ agonist pioglitazone reverses pulmonary hypertension and prevents right heart failure via fatty acid oxidation [J]. Sci Transl Med, 2018, 10(438).
[10] SUTENDRA G, BONNET S, ROCHEFORT G, et al. Fatty acid oxidation and malonyl-CoA decarboxylase in the vascular remodeling of pulmonary hypertension [J]. Sci Transl Med, 2010, 2(44): 44ra58.
[11] MARTINEZ L, TABBARA M, DUQUE J C, et al. Transcriptomics of Human Arteriovenous Fistula Failure: Genes Associated With Nonmaturation [J]. Am J Kidney Dis, 2019, 74(1): 73-81.
[12] LIU J, LI Q, WANG J, et al. Genetically Encoded FRET Biosensor for Live-cell Visualization of Lamin A Phosphorylation at Serine 22 [J]. bioRxiv, 2024.
原文链接:
http://doi.org/10.1002/advs.202411559


