【协和医学杂志】面积骨化率——常规超声定量评估青少年骨龄的新参数
时间:2024-11-22 23:01:13 热度:37.1℃ 作者:网络
骨龄是反映个体生长发育水平的重要指标,在儿童生长发育评估、疾病诊断等方面具有重要意义[1]。目前常用的骨龄测定方法为Greulich-Pyle(GP)图谱法和Tanner-Whitehouse 3(TW3)法[2-3]。但GP图谱法缺少定量标准,易受阅片者的主观影响;TW3法较为复杂、耗时耗力。超声检查作为一种安全、便捷的诊断方法,在评估儿童骨龄方面具有很好的应用前景。
2019年,Wan等[4]提出骨骺骨化率(OR)法,即计算人体13块骨的骨化中心最大长径与骨骺的最大长径之比,且研究发现OR值与放射学骨龄之间存在显著相关性。本研究基于此方法,提出新的超声测量参数——面积骨化率(AOR),探索超声评估骨龄的简易方法,并评价AOR与放射学骨龄之间的相关性。
1 资料与方法
1.1 研究对象
本研究为横断面研究。选取2023年6月山东省某中学的青少年为研究对象。纳入标准:(1)年龄小于18岁;(2)可在1周内接受超声及左手腕部X线检查。排除标准:(1)腕关节或膝关节存在病理改变,如关节炎、外伤、畸形、肿瘤等;(2)无法配合影像学检查或影像学检查质量差、无法满足判读要求。
本研究已通过北京协和医院伦理审查委员会审批(审批号:K4393)。所有研究对象均签署知情同意书。
1.2 样本量估算
采用PASS 21.0.3软件估算样本量。参数设置为:备择假设相关系数r=0.50,检验水准α=0.05,检验效能1-β=0.80,脱失率=15%,经计算本研究所需最小样本量为男生、女生各35人。
1.3 超声检查方法
1.3.1 检查仪器与方法
应用GE LOGIQ E20彩色多普勒超声诊断仪。受试者取坐位,L6-24靴型探头分别置于其尺骨茎突冠状面及桡骨茎突冠状面进行尺骨、桡骨成像。受试者取俯卧位,L2-9线阵探头分别置于其股骨外上髁冠状面、胫骨内侧髁冠状面及胫骨后正中矢状面进行股骨、胫骨成像。
1.3.2 AOR测量方法
在超声图像中的生长板最深处画一条水平辅助线,辅助线与骨骺上界所围成区域的面积即为相应长骨的骨骺面积。辅助线、骨化中心表面及骨化中心末端两条垂直线所围成区域的面积即为相应长骨的骨化中心面积(图1)。某长骨的AOR=该长骨骨化中心面积/骨骺面积。
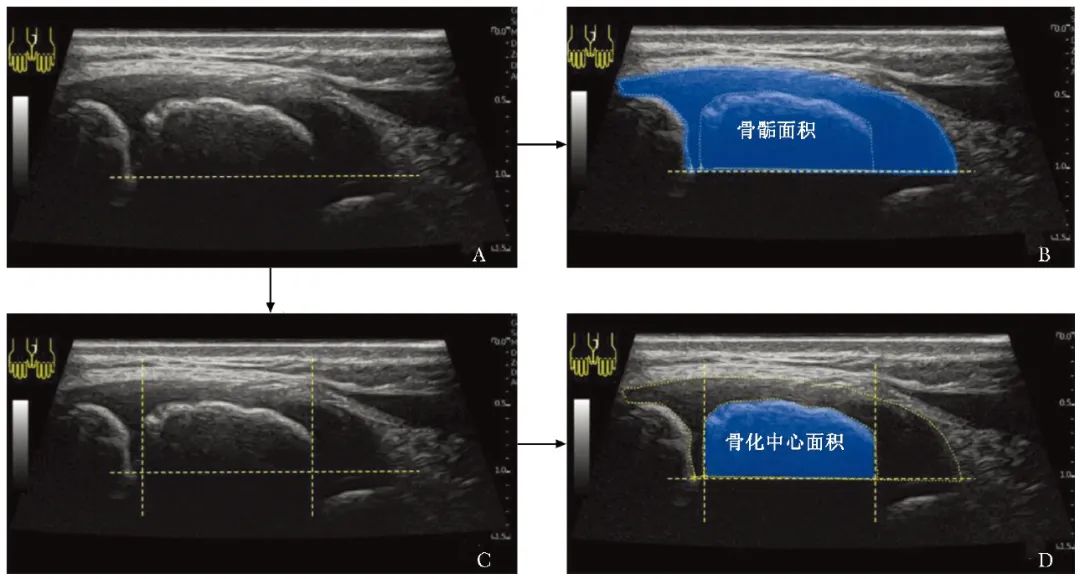
图1 骨骺及骨化中心面积勾画方法(以桡骨茎突冠状面声像图为例)
A.于生长板最深处画水平辅助线;B.骨骺面积:水平辅助线与骨骺上界所围成区域的面积;C.于骨化中心两端画两条垂直辅助线;D.次级骨化中心面积:三条辅助线与骨化中心上界所围成区域的面积
1.3.3 可重复性分析
随机选取15例受试者左侧5个部位(尺骨茎突冠状面、桡骨茎突冠状面、股骨外上髁冠状面、胫骨内侧髁冠状面、胫骨后正中矢状面)的超声图像,分别由北京协和医院2名不同年资的超声科医师采用盲法进行图像勾画及AOR值测量,分析不同观察者间测量的一致性。间隔4个月后,由第1名超声科医师再次对上述15名受试者的5个部位超声图像进行勾画及AOR值测量,并分析观察者内一致性。
1.4
放射学骨龄评估方法
放射学骨龄评估采用GP图谱法[5],由北京协和医院2名经验丰富的内分泌科或放射科医师共同阅片。2名医师判读结果一致时,该结果可作为受试者的放射学骨龄,不一致时则取平均值作为该受试者的放射学骨龄。
1.5 统计学处理
采用SPSS 26.0软件进行统计分析。采用Kolmogorov-Smirnov检验判断计量资料是否符合正态分布,符合正态分布的数据以均数±标准差表示,非正态分布的数据以中位数(四分位数)表示。采用组内相关系数(ICC)及Bland-Altman法评估观察者间及观察者内一致性。采用Pearson或Spearman法分析评估AOR与放射学骨龄的相关性,0<│r│<0.3为弱相关,0.3≤│r│<0.5为低度相关,0.5≤│r│< 0.8为显著相关,│r│≥0.8为高度相关。以P<0.05为差异具有统计学意义。
2 结果
2.1 受试者一般资料
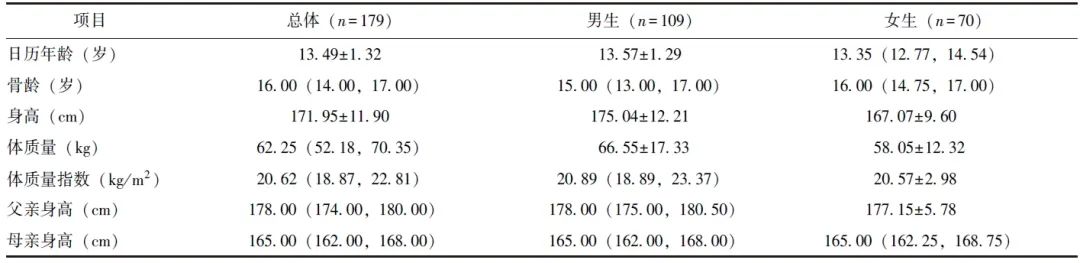
本研究共纳入179名符合纳入与排除标准的青少年,其中男生109人,女生70人,平均日历年龄(13.49±1.32)岁,骨龄中位数为16.00(14.00,17.00)岁,平均身高(171.95 ± 11.90)cm,体质量指数(BMI)中位数为20.62(18.87,22.81)kg/m2。男生骨龄中位数为15.00(13.00,17.00)岁,女生骨龄中位数为16.00(14.75,17.00)岁,详见表1。
表1 受试者一般资料[  ±s/M( P25,P75)]
±s/M( P25,P75)]
2.2 AOR值与放射学骨龄的相关性
超声测量各骨龄青少年5个部位的AOR总和详见表2。
表2 超声测量各骨龄男、女青少年5个部位的AOR总和
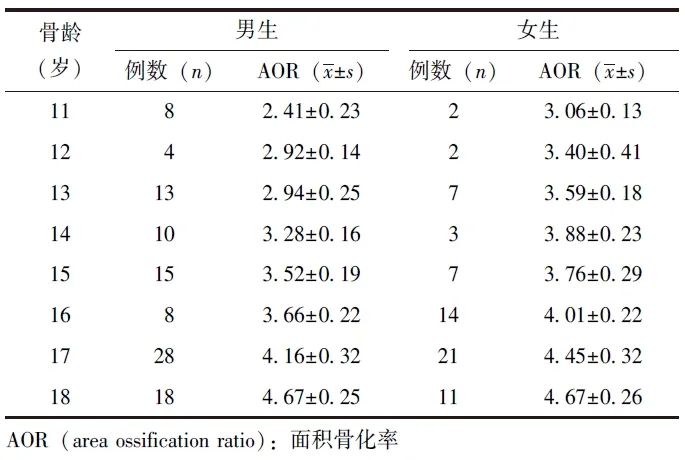
男、女青少年5个部位的AOR与放射学骨龄均呈显著或高度相关(r=0.60~0.91)。男、女青少年5个部位的AOR总和与放射学骨龄呈高度相关(男:r=0.95,女:r=0.87),详见图2和表3。
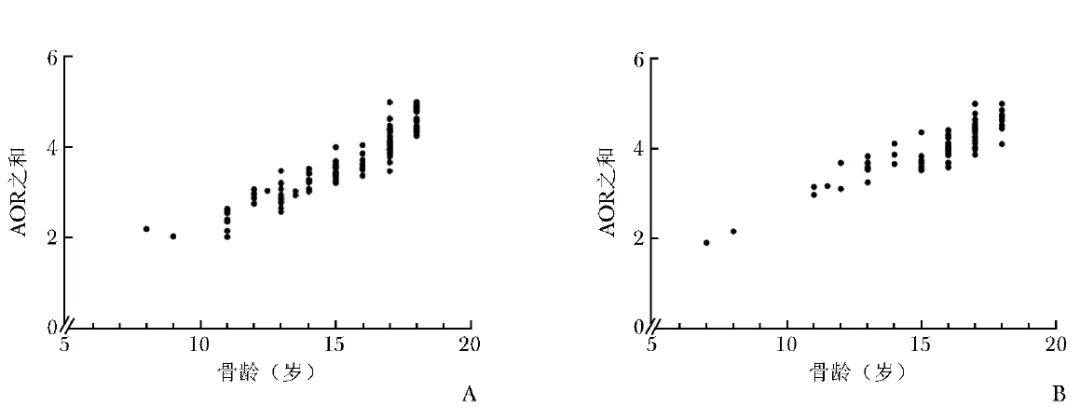
图2 男(A)、女(B)青少年5个部位AOR之和与放射学骨龄的相关性
表3 超声测量5个部位AOR与放射学骨龄间的Spearman相关系数
下肢股骨、胫骨3个部位的AOR总和与放射学骨龄呈高度相关(男:r=0.93,女:r=0.84)。上肢尺骨、桡骨2个部位的AOR总和与放射学骨龄呈显著或高度相关(男:r=0.90,女:r=0.74)。
2.3 可重复性分析
对于随机选取的15例受试者,2名观察者的AOR值具有较高的可重复性,ICC=0.926(95% CI:0.796~0.975,P<0.001),第1名观察者重复测量的ICC为0.954(95% CI:0.869~0.984,P<0.001)。采用Bland-Altman法统计分析,2名观察者测量AOR差值的平均值为0.022(95% CI:-0.482~0.527),第1名观察者2次测得的AOR差值平均值为-0.009(95% CI:-0.395~0.377),说明该测量具有较好的一致性(图3)。
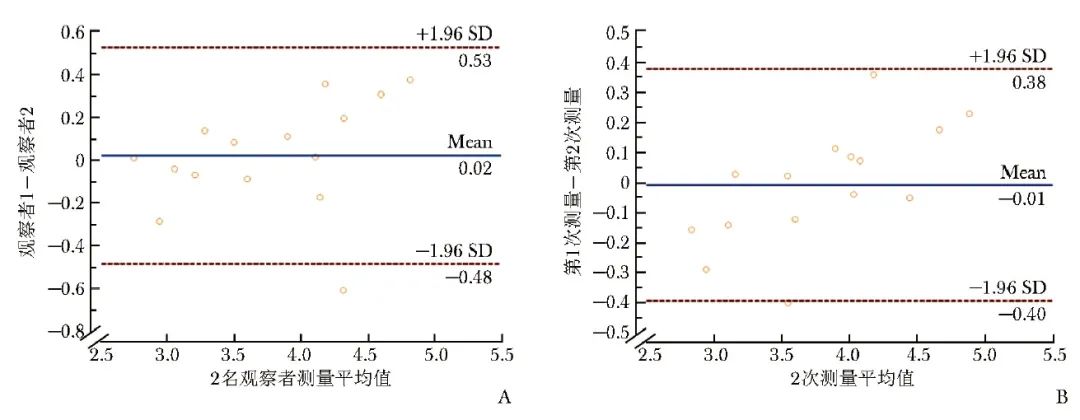
图3 观察者间(A)及观察者内(B)一致性的Bland-Altman图
3 讨论
本研究共纳入179名健康青少年作为研究对象,通过超声扫查其左侧尺骨茎突冠状面、桡骨茎突冠状面、股骨外上髁冠状面、胫骨内侧髁冠状面及胫骨后正中矢状面5个部位,收集超声图像并测量相应部位骨骺的AOR。
研究发现,青少年5个部位的AOR与GP图谱法测量的放射学骨龄均呈显著或高度相关(r=0.60~0.91),5个部位AOR之和与放射学学骨龄高度相关(男:r=0.95,女:r=0.87)。同时,ICC分析和Bland-Altman法均表明AOR测量法具有良好的观察者间一致性(ICC=0.926)及观察者内一致性(ICC=0.954),提示AOR是评估青少年长骨骨骺发育的可靠参数。
目前临床最常用的骨龄评估方法为GP图谱法,该方法操作简单、便捷,但易受评估者的主观影响,且短期内多次进行X线检查存在累积电离辐射的风险。近年来,相关研究开始探索使用常规超声评估骨龄的方法[4,6-12]。
2003年,Bilgili等[6]采用超声检查97名0~6岁儿童左侧腕骨及手部骨骼的骨化中心出现情况,并根据GP图谱法评估骨龄,结果显示超声检查与传统X 线检查测量的骨龄呈显著相关性(男:r=0.994,女:r=0.986)。
2019年,Wan等[4]测量了包含尺骨、桡骨、掌骨、指骨等13块骨的骨化中心最大长径与骨骺最大长径之比(即OR值),结果显示13块骨的OR值与放射学骨龄均呈显著相关性(r=0.75~0.93)。随后研究人员还发现儿童桡骨、尺骨和股骨内侧髁的OR值总和与放射学骨龄具有较高相关性(男:r=0.97,女:r=0.96)[8],提示超声检查在连续定量评估骨龄中具有潜在价值。
骨化中心的生长模式为自中心向四周辐射状生长,并最终与骨干融合[13]。笔者认为在二维超声图像中,骨化中心与骨骺的面积之比可更精细地反映骨骺的生长发育过程,因此提出AOR这一概念,并评估AOR与放射学骨龄之间的相关性。
本研究结果显示,健康青少年尺骨、桡骨、股骨、胫骨5个部位的AOR之和与放射学骨龄呈高度相关性(男:r=0.95,女:r=0.87),下肢股骨、胫骨3个部位的AOR之和与放射学骨龄也呈高度相关性(男:r=0.93,女:r=0.84),提示AOR能够较好地反映青少年的骨骼发育水平,仅测量下肢骨3个部位的AOR总和可能是超声评估骨龄的简便方法。
相较于前文提到的相关研究[4,6,8],本研究的Spearman相关系数略低,原因可能为:(1)本研究聚焦于青少年群体,骨龄范围小;(2)相较于儿童,青少年特别是女性青少年的骨骼发育水平更高,AOR测量、放射学骨龄判读难度及产生的随机误差均有所增加。
本研究亦存在一定的局限性。首先,目前骨龄测量尚缺乏金标准,本研究采用专家阅片法,根据GP图谱法评估放射学骨龄,可能存在误差。其次,本研究未对各年龄段青少年的标准AOR范围进行划分,未来需扩大样本量进一步研究。
综上,本研究提出了AOR这一新参数,发现健康青少年人群的左侧尺骨茎突冠状面、桡骨茎突冠状面、股骨外上髁冠状面、胫骨内侧髁冠状面及胫骨后正中矢状面5个部位的AOR总和与放射学骨龄高度相关,且测量方法具有较高的可重复性,提示AOR是常规超声定量评估骨龄的可靠参数。
参考文献
[1]Martin D D, Wit J M, Hochberg Z, et al. The use of bone age in clinical practice-part 1[J]. Horm Res Paediatr, 2011, 76(1): 1-9.
[2]Greulich W W, Pyle S I. Radiographic atlas of skeletal development of hand wrist[M]. Stanford: Stanford Universtiy Press, 1971.
[3]Tanner J M, Healy M J R, Goldstein H, et al. Assessment of skeletal maturity and prediction of adult height (TW3 method)[M]. 3rd ed. London: W.B. Saunders, 2001.
[4]Wan J, Zhao Y, Feng Q Q, et al. Potential value of conventional ultrasound in estimation of bone age in patients from birth to near adulthood[J]. Ultrasound Med Biol, 2019, 45(11): 2878-2886.
[5]Gaskin C M, Kahn S L, Bertozzi J C, et al. Skeletal development of the hand and wrist: A radiographic atlas and digital bone age companion[M]. Oxford: Oxford University Press, 2011.
[6]Bilgili Y, Hizel S, Kara S A, et al. Accuracy of skeletal age assessment in children from birth to 6 years of age with the ultrasonographic version of the Greulich-Pyle atlas[J]. J Ultrasound Med, 2003, 22(7): 683-690.
[7]Wan J, Zhao Y, Feng Q Q, et al. Statistical confirmation of a method of US determination of bone age[J]. Radiology, 2021, 300(1): 176-183.
[8]Wan J, Zhao Y, Feng Q Q, et al. Summation of ossification ratios of radius, ulna and femur: a new parameter to evaluate bone age by ultrasound[J]. Ultrasound Med Biol, 2020, 46(7): 1761-1768.
[9]赵泽庆, 潘慧, 张莉, 等. 超声评估骨龄研究现状及临床应用前景[J]. 协和医学杂志, 2024, 15(2): 400-405.
[10]赵莹, 洪恺, 冯群群, 等. 常规超声定量评估骨龄[J]. 中国医学影像技术, 2021, 37(9): 1405-1409.
[11]Lv P, Zhang C. Tanner-Whitehouse skeletal maturity score derived from ultrasound images to evaluate bone age[J]. Eur Radiol, 2023, 33(4): 2399-2406.
[12]Rüeger E, Hutmacher N, Eichelberger P, et al. Ultrasound imaging-based methods for assessing biological maturity during adolescence and possible application in youth sport: a scoping review[J]. Children (Basel), 2022, 9(12): 1985.
[13]Roselló-Díez A, Joyner A L. Regulation of long bone growth in vertebrates; it is time to catch up[J]. Endocr Rev, 2015, 36(6): 646-680.


