四川大学林云锋/叶庭洪《ACS Nano》:四面体框架核酸负载吡非尼酮用于治疗特发性肺纤维化
时间:2024-09-19 14:00:53 热度:37.1℃ 作者:网络
特发性肺纤维化(IPF)是一种不可逆转且危及生命的疾病,其特征是肺部炎症反应、成纤维细胞过度生长和细胞外基质异常积聚,从而导致呼吸困难和肺功能衰竭。吡非尼酮(pirfenidone, PFD)于2014年获得FDA批准可用于治疗IPF。尽管PFD有效,但其对IPF的临床治疗效果并不理想。其消除速度快、用量大、毒副作用明显等缺点限制其临床价值。因此,需要改进向肺组织的药物输送,以优化PFD的疗效。
尽管已经开发了多种PFD递送系统,但设计更高效、更稳定、更安全的递送系统仍然是研究的重点。现有的PFD的递送策略面临着诸多挑战,例如负载效率不足,毒性和副作用强,成本高和生物利用率低。
四面体框架核酸(Tetrahedral framework nucleic acid,tFNA)是一种纳米结构DNA药物递送载体,因其良好的生物相容性、优异的药物递送性、简便的合成途径和出色的产量等优点,已成为三维核酸材料中的热门话题。除了作为运输载体的优异性能外,tFNA还具有生物活性。有研究表明,tFNA具有抗纤维化潜力,其抗纤维化作用可能源于其抗炎和抗氧化作用。考虑到tFNA的药理活性和良好的递送性,我们选择了它作为载体来克服PFD的固有缺陷,并协同PFD增强其抗纤维化特性。
2024年9月14日,四川大学华西口腔医院林云锋教授和四川大学华西医院叶庭洪研究员在《ACS Nano》杂志上发表了题目为“Tetrahedral framework nucleic acids delivery of pirfenidone for anti-inflammatory and antioxidative effects to treat idiopathic pulmonary fibrosis”的文章。该研究成功构建了一种纳米颗粒复合物PFD-tFNA(Pt),它具有良好的药物输送和细胞进入能力,此外,在体内实验中,该研究运用了一种Pt气管内给药系统,以减少口服PFD时所需的剂量和次数,实现了更为有效的IPF雾化治疗。

【主要内容】
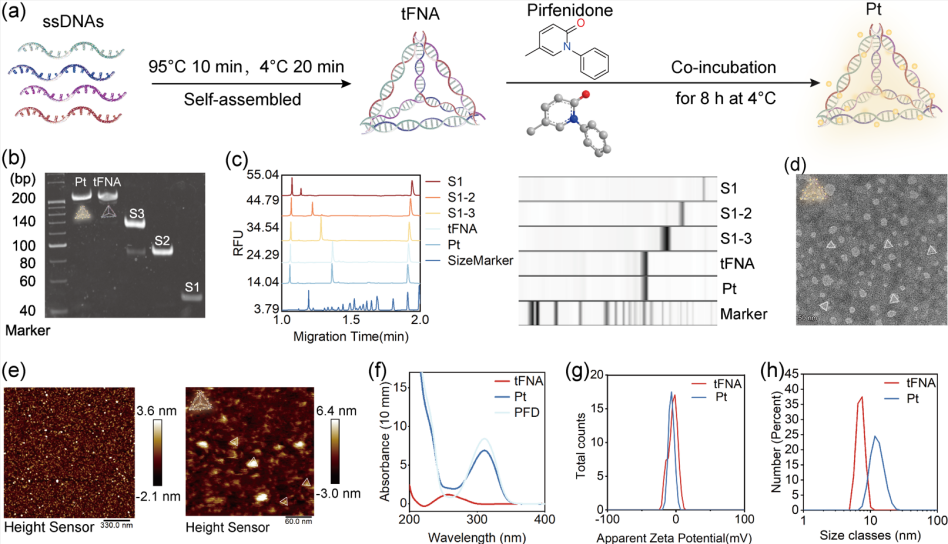
图1 Pt递送系统的设计和功能验证
Pt复合物的合成包括两个步骤,具体步骤见图1a。随后,我们验证了Pt是否成功合成。聚丙烯酰胺凝胶电泳(PAGE)结果表明,在合成四种ssDNA和复合物的过程中,tFNA和Pt的移动性最小(图 1b)。此外,高性能毛细管电泳检测证实了tFNA和Pt的特性(图 1c),这表明Pt成功合成。透射电子显微镜(图 1d)和原子力显微镜(图 1e)图像中显示的Pt的形态与我们预测的结果一致。此外,紫外线光谱显示tFNA的吸光波长约为260 nm,而Pt和PFD的吸光波长约为310 nm,这表明PFD成功地负载到了tFNA上(图 1f)。此外,还通过动态光散射测定了tFNA和Pt的zeta电位和分子大小,结果显示tFNA和Pt都带负电(图1g)。图1h显示,tFNA和Pt的分子尺寸分别约为7 nm和14.5 nm。综上所述,PFD可通过插层结合模式嵌入tFNA的螺旋结构中,这表明Pt复合物的构建获得成功。
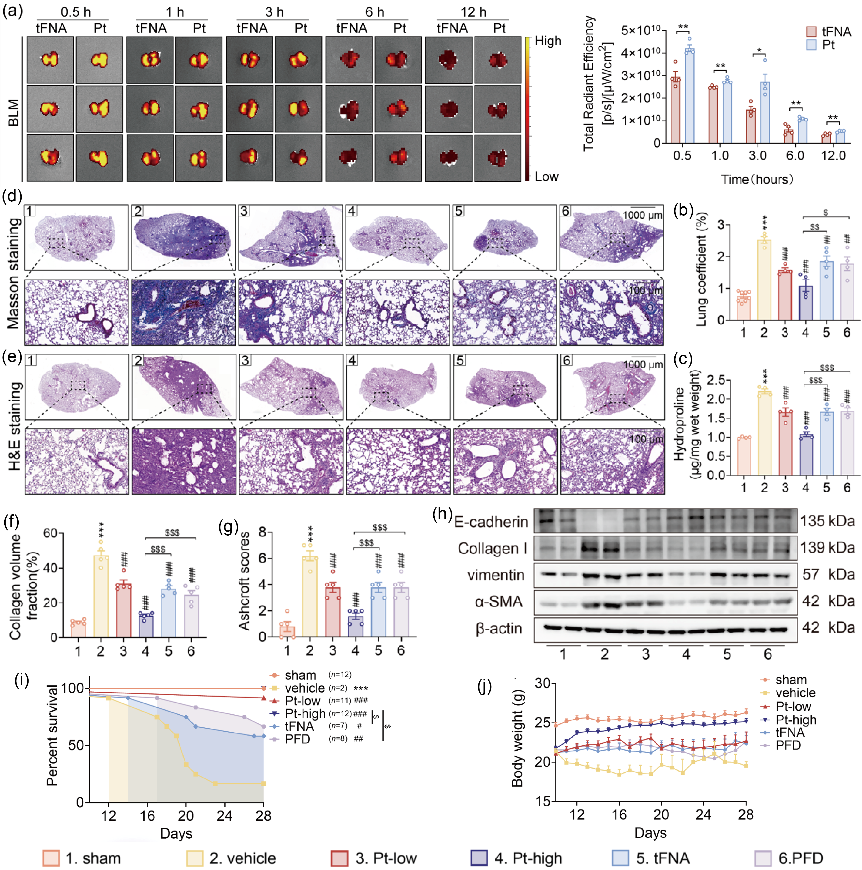
图2 Pt在肺纤维化小鼠体内的生物分布和治疗效果
在肺部纤维化的环境中,我们通过气管内途径给小鼠注射了Cy5-tFNA和Cy5-Pt,随后评估了它们在IPF小鼠体内的生物分布(图 2a)。与tFNA相比,在肺部观察到了更强的Pt荧光强度,这表明Pt在肺部纤维化环境中的局部聚集能力更强。为了验证Pt在IPF模型小鼠中的高效给药能力,我们评估了Pt对小鼠IPF的疗效,以确认其通过气管内雾化途径进行肺部给药的疗效。结果显示,Pt高剂量治疗显著改善肺纤维化中的病理表现(图 2d-h),这表明tFNA增强了PFD的抗纤维化作用,并将肺组织的病理表现控制在接近正常的水平。其次,我们评估了Pt对IPF小鼠存活率和体重的影响,Pt能显著缓解小鼠肺功能的恶化,提高小鼠的存活率(图 2-j)。
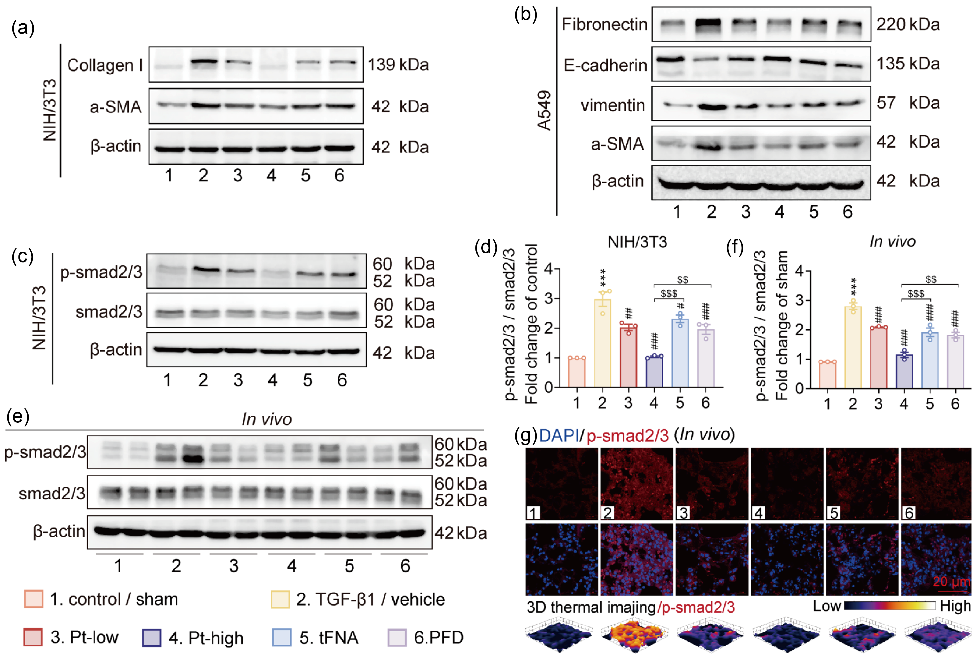
图3 Pt通过调节smad2/3信号通路保护NIH/3T3和A549细胞免受TGF-β1的损伤
为了在体外模拟肺纤维化,研究者用NIH/3T3和A549细胞在饥饿后接触TGF-β1,以促进肌成纤维细胞和EMT模型的生成。研究表明,Pt可发挥有效的抗成纤维细胞活化作用,并抑制上皮细胞的EMT(图 3a-b)。经典的TGF-β1/Smad通路对IPF的发展至关重要,因此研究者探讨了Pt对于异常激活的TGF-β1/Smad通路的影响。值得注意的是,与Pt高剂量组相比,单药组(tFNA和PFD)调节成纤维细胞活化和上皮细胞EMT的能力有限(图 3c-g),表明Pt通过TGF-β1/Smad通路有效增强了PFD和tFNA的抗成纤维细胞活化和抑制上皮细胞EMT效应。
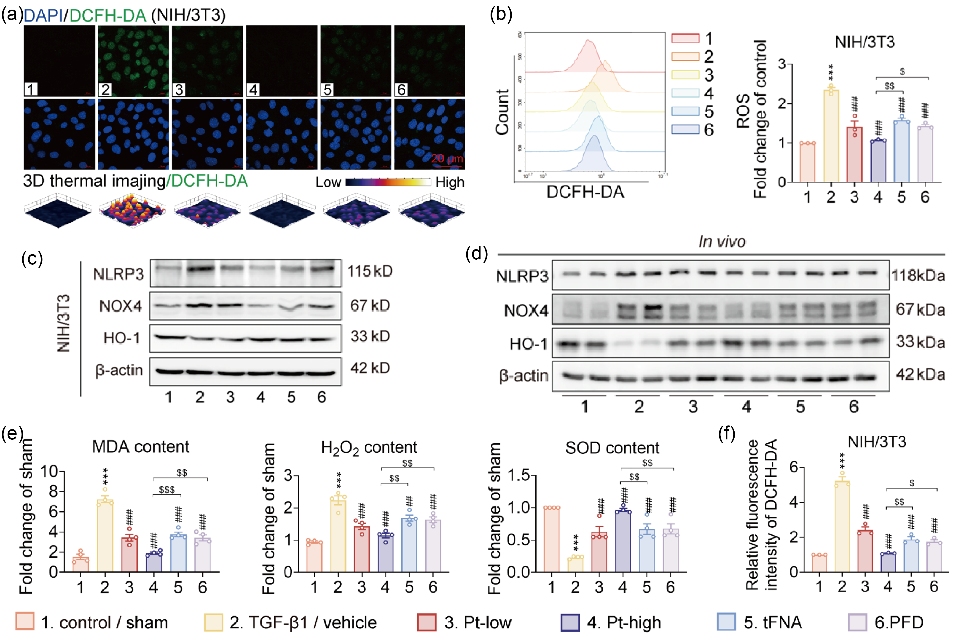
图4 Pt对炎症反应和氧化应激异常的抑制作用
在整个IPF疾病进展过程中,炎症和氧化应激都会上调。在炎症微环境中,存在高水平的活性氧(ROS),而过量的ROS又会造成损伤并加剧氧化应激。此外,氧化应激可进一步增强炎症反应,破坏免疫微环境平衡。因此,研究者通过TGF-β1刺激NIH/3T3细胞产生过度的ROS,在这种ROS过度产生的环境中模拟了肺纤维化中的氧化应激,并检测了Pt干预是否能抑制ROS的产生。荧光显微镜和流式细胞术结果表明Pt低剂量组、tFNA和PFD处理能有效减少ROS的产生,但抑制作用有限,而Pt高剂量组的抑制作用大于其他三组(图 4a-b)。此外,研究者通过免疫印迹实验在体内外检测了各组药物处理后炎症和氧化应激指标表达的变化。研究发现,Pt具有很好的调节免疫反应和氧化应激平衡的能力(图 4c-e)。总之,Pt通过调节TGF-β1/Smad通路,有效增强了PFD和tFNA的免疫调节能力和抗氧化损伤作用。
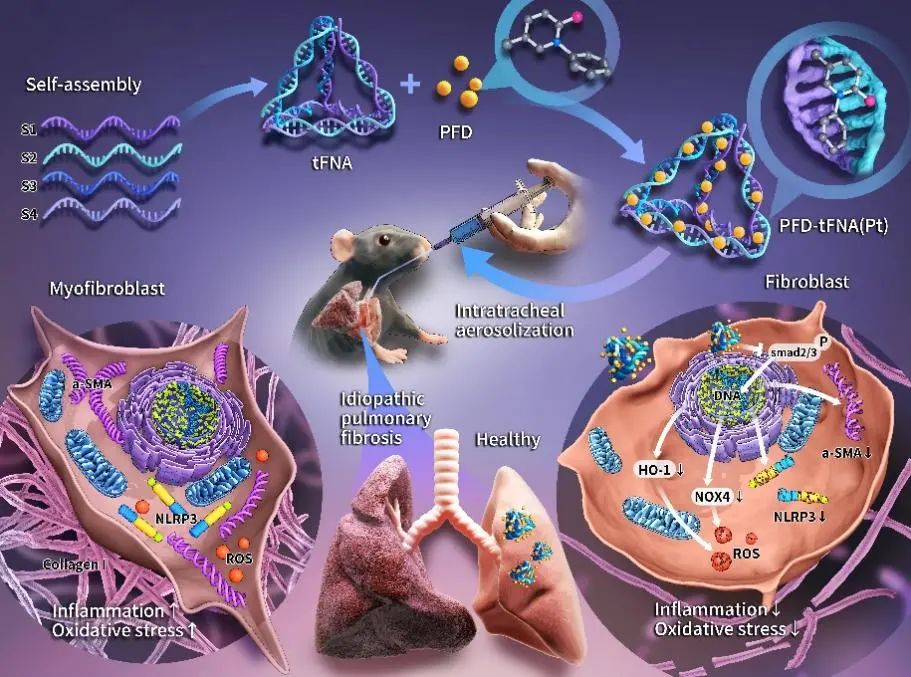
图5 Pt治疗IPF的机制
【文章结论与讨论,启发与展望】
为了提高PFD对IPF的疗效并降低全身毒性,研究人员引入了tFNA作为PFD的有利载体,并成功构建了一种纳米颗粒复合物PFD-tFNA(Pt),它具有良好的药物输送和细胞进入能力,且实现了有效的IPF雾化治疗。Pt良好的体内治疗效果体现在显著降低了IPF小鼠的死亡率和持续性体重恢复,并改善了肺部病理状况等。同时,该研究还证明了Pt具有出色的免疫调节能力和抗氧化损伤作用,可将IPF期间的肺部炎症和氧化应激生物标志物恢复到几乎正常的水平。此外,考虑到Pt具有良好的生物安全性,因此,Pt展现出作为IPF治疗药物的潜力。
四川大学华西口腔医院林云锋教授和四川大学华西医院叶庭洪研究员为该论文的共同通讯作者,博士生谢雨庭和石思容副研究员为本论文的共同第一作者。本研究受到国家自然科学基金、四川省科技计划项目、四川大学华西口腔医学院/四川大学华西口腔医院和贵州省科技项目等项目资助。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c06598


