袁振刚教授:肝细胞癌系统治疗现状和思考
时间:2024-09-01 15:00:28 热度:37.1℃ 作者:网络
我国是肝细胞癌(HCC)高发国家,早期HCC以外科手术治疗为主。但是大多数HCC患者初诊时即为中晚期,已丧失外科手术、肝移植等根治机会。因此,探索有效的系统治疗方案对改善HCC患者的整体预后具有重要意义。
近年来,HCC的系统治疗可选择的方案取得了令人瞩目的进展,不仅改善了患者总的生存情况,而且也为中期和进展期HCC患者带来新的希望。近日,海军军医大学第三附属医院袁振刚教授分享《肝细胞癌系统治疗现状和思考》精彩报告。肝癌在线特将该报告的精华部分整理成文,以飨读者。
一、概述
近年来,肝细胞癌的靶向、免疫治疗获得了突飞猛进的发展。系统性治疗的巨大进步为各期肝细胞癌患者的治疗带来了新的机遇。各国指南都在进行不断的更新。《原发性肝癌诊疗指南2024版》提出的肝癌临床分期及治疗路线图如图1所示。BCLC分期指导下的肝细胞癌治疗策略也有所改变。既往BCLC B期的患者是不推荐药物治疗的,从2023年开始,弥漫性分布的BCLC B期HCC也可以启用药物治疗。
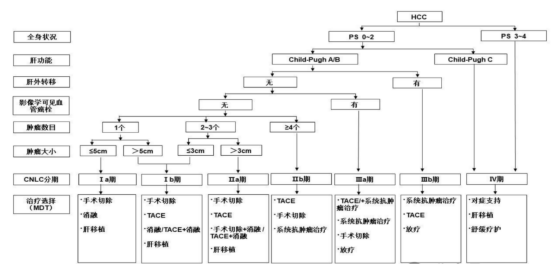
图1. 中国肝癌临床分期及治疗路线图
二、晚期肝癌一线靶免治疗还有多少提升空间
1. 免疫联合模式已经成为一线优选治疗
➤TKI:优势为起效快,ORR相对较高。RECIST 1.1研究显示其ORR为18.8%,mRECIST研究显示其ORR为21.5%。TKI局限性在于易耐药,疗效持续时间短,难以控制病程进展。
➤IO:优势为生存有一定延长,安全性良。CheckMate 459研究、KEYNOTE 224研究、RATIONALE-301分别显示其OS可达16.4个月、17个月、15.9个月。局限性为较TKI的ORR无优势。
➤联合突破:使患者的生存更好,有效率更高。靶免联合是目前的标准治疗方式。
1)IMbrave150研究
IMbrave150研究是一项国际多中心、前瞻性、随机对照、开放标签、Ⅲ期临床研究。HCC患者按2:1的比例随机接受阿替利珠单抗(1200mg IV q3w)+贝伐珠单抗(15mg/kg IV q3w)联合治疗(T+A)或索拉非尼(400mg PO BID)治疗,直至无临床获益或出现不可接受的毒性。主要终点为意向治疗(ITT)人群的OS和PFS。次要终点为客观缓解率(ORR)和缓解持续时间。
2022年公开的数据[1]显示T+A方案的mOS为19.2个月,索拉非尼组的mOS为13.4个月,T+A方案可使OS风险降低34%(HR=0.66, 95% CI 0.52-0.85, P<0.001)。T+A方案的mPFS为6.9个月,优于索拉非尼组的4.3个月,疾病进展风险降低35%(HR=0.65, 95% CI 0.53-0.81, P<0.001)。T+A方案的广泛应用也引起了我们对食管静脉曲张破裂出血的重视。IMbrave150研究的大血管侵犯亚组分析显示,T+A治疗会使患者静脉曲张出血(14%)和胃肠道出血(5%)发生率增加,尤其是在有食管静脉曲张的患者中。
2)HIMALAYA研究
HIMALAYA研究是一项随机、开放标签、多中心、全球性III期研究。2017年10月至2019年6月,在16个国家的181个地点对1950例患者进行了筛查,纳入标准为:不可切除HCC、BCLC B期和C期、既往未接受过全身性治疗、不适合局部治疗、Child Pugh评分A级、门脉主干无血栓形成。
1171例患者随机分为三组:STERID组(393例)、度伐利尤单抗组(389例)和索拉非尼组(389例)。STERID组:在度伐利尤单抗1500mg每4周1次常规治疗基础上添加一剂tremelimumab 300mg;度伐利尤单抗组:度伐利尤单抗1500mg单药治疗,每4周1次;索拉非尼组:400mg,每日2次。
研究结果显示:STERID组的中位OS为16.43个月,度伐利尤单抗组为16.56个月,索拉非尼组为13.77个月。36个月的总生存率分别为30.7%、24.7%和20.2%。STRIDE组、度伐利尤单抗组和索拉非尼组的研究者评估客观缓解率(ORR)分别为:20.1%、17.0%、5.1%。三组的中位疾病进展时间分别为:5.4个月、3.8个月、5.6个月[2]。优点是不需要考虑食管静脉曲张破裂出血的风险。
在4年的OS随访更新数据中[3],STRIDE方案组4年OS率为25.2%,较索拉非尼组提高了67%(25.2% vs. 15.1%)。在获得疾病控制的患者中,STRIDE方案组的4年OS率为36.2%,较索拉非尼组提高了78%(36.2% vs. 20.3%)。
3)CheckMate-9DW研究
CheckMate-9DW是一项大型III期、随机、开放标签的全球多中心临床试验,在未接受过系统治疗的晚期HCC患者中对比了纳武利尤单抗联合伊匹木单抗(O+Y)与仑伐替尼或索拉非尼的有效性和安全性。
研究结果显示,O+Y组患者的中位OS为23.7个月,仑伐替尼或索拉非尼的中位OS为20.6个月(HR 0.79,P = 0.018)。中位随访35.2个月后,O+Y组的中位OS为23.7个月,对照组为20.6个月,O+Y组存在显著获益(HR=0.79;95%CI:0.65-0.96;P=0.0180)。两组的24个月OS率分别为49%和39%,36个月OS率分别为38%和24%,ORR分别为36%和13%。但是两组患者的中位PFS分别为9.1个月和9.2个月,差异无统计学意义[4]。
4)COSMIC-312
COSMIC-312研究[5]是一项开放标签、随机分组的III期研究。参与者被随机分配到三组(2:1:1),分别接受卡博替尼加阿替利珠单抗、索拉非尼或单一卡博替尼。研究表明,虽然卡博替尼联合阿替利珠单抗的PFS优于索拉非尼组,但两组之间的OS在中期分析中并无显著差异。
5)CARES-310
CARES-310研究是一项国际多中心、随机对照Ⅲ期临床研究,该研究共纳入543例既往未接受过系统治疗的不可切除或转移性肝细胞癌患者,按1:1随机接受卡瑞利珠单抗联合阿帕替尼(“双艾”组合)治疗(272例)或接受索拉非尼治疗(271例),主要研究终点是PFS和OS。结果显示[6],相比标准治疗组,“双艾”治疗组的中位OS显著延长(22.1个月 vs. 15.2个月;HR=0.62,95%CI:0.49-0.80;单侧p<0.0001)。经过16个月的进一步随访,最终分析结果显示,“双艾”组的中位OS达到了23.8个月,相较标准治疗组延长了8.6个月(23.8个月 vs. 15.2个月;HR=0.64,95% CI:0.52-0.79;单侧p<0.0001)。
不同免疫联合治疗方案的安全性存在差异,不良反应不尽相同。值得关注的是患者是不是免疫禁忌,是不是有出血倾向。临床上选择靶免治疗的患者大多基于这两点。肝细胞癌一线靶免治疗汇总如表1所示。目前已经进入平台期,20-30%的有效率,20个月左右的生存期。

表1. 肝细胞癌一线靶免治疗汇总
目前免疫检查点抑制剂(ICI)后HCC的最佳二线治疗方案尚未确定。2024 ASCO年会上报告了一项瑞戈非尼联合帕博利珠单抗的研究结果,研究根据先前治疗定义了2组队列,队列1:阿替利珠单抗+贝伐珠单抗;队列2:任何其他ICI方案(单独或联合),主要终点是独立中心审查(RECIST 1.1)的总缓解率(ORR)。
结果显示队列1的ORR为5.9%,队列2为11.1%,疾病稳定率分别为48.5%和63.0%。队列1的中位PFS为2.8个月,队列2为4.2个月。这是首个在一线ICI治疗后评估激酶抑制剂+ICI的前瞻性研究。瑞戈非尼+帕博利珠单抗在一线ICI方案后的二线中显示出一定的活性。
那么在靶免治疗的基础上再加上一些药物治疗的疗效如何呢?
1)MORPHEUS-liver研究
MORPHEUS-liver研究评估了tiragolumab联合阿替利珠单抗(atezo)和贝伐珠单抗(bev)治疗不可切除、局部晚期或转移性肝细胞癌(uHCC)患者的Ib/II期的疗效。共有58例患者被随机分组(tira+atezo+bev组,n=40;atezo+bev组,n=18)。研究结果显示,tira+atezo+bev组中位随访时间为14.0个月,对照组为11.8个月。与对照组相比,tira+atezo+bev组ORR较高(42.5% vs. 11.1%);PFS较长(11.1个月 vs. 4.2个月),相应的PFS风险比(HR)为0.42(95%CI:0.22-0.82)。III期试验IMbrave152研究的结果值得期待。
2)AdvanTlG-206研究
AdvanTIG-206是针对晚期肝细胞癌(HCC)患者中Ociperlimab(OCI)+替雷利珠单抗(TIS)+BAT1706(贝伐珠单抗生物类似物)对比TIS+BAT1706的II期随机开放标签研究。在晚期HCC患者中,TIS+BAT1706显示出了良好的ORR,而将OCI添加到这一治疗方案中并没有增加其抗癌效果。OS数据尚不成熟,需要进一步随访。
除了叠加药物外,是否可以叠加介入治疗呢?
LAUNCH研究
LAUNCH研究是一项评估仑伐替尼(LEN)联合TACE对比LEN单药一线治疗晚期HCC疗效和安全性的多中心、随机对照III期临床研究。研究结果显示,在主要终点OS(中位数17.8m vs. 11.5m,HR=0.45;P<0.001)和其他终点PFS(中位数10.6m vs. 6.4m HR=0.43;P<0.001)、ORR (54.1% vs. 25.0%;P<0.001)以及各亚组分析中,相较于LEN单药,LEN+TACE的获益都更加明显。
三、肝癌靶免治疗后续治疗
现阶段HCC的二线治疗选择存在极大挑战,基于一线模式的二线选择策略仍需高级别循证医学证据支持。晚期二线系统治疗经索拉非尼治疗进展的患者有相对丰富的数据,仑伐替尼、靶免联合治疗进展的数据相对较少。
1)仑伐替尼治疗后,后续治疗的无进展生存期数据显示:索拉非尼mPFS为1.8个月,瑞戈非尼mPFS为3.2个月。
2)伊匹木单抗联合纳武利尤单抗/帕博利珠单抗作为经IO治疗后的挽救治疗,表现出持久的抗肿瘤活性及令人鼓舞的生存获益。
3)T+A治疗进展后使用TKI单药治疗的方案比较结果显示:仑伐替尼的mPFS显著优于索拉非尼,mOS相当。维持当前治疗还可能使部分患者获益。
4)IMbrave251研究是一项在既往接受过T+A方案治疗的不可切除HCC患者中比较阿替利珠单抗联合仑伐替尼/索拉非尼与仑伐替尼单药或索拉非尼单药治疗的III期、开放性、随机研究,相信能为免疫治疗跨线治疗带来很好的提示。
四、肝癌术后辅助治疗
辅助治疗是降低HCC术后复发风险、延长生存的重要手段。目前的共识是,对于HBV感染的肝癌病人,术后抗病毒治疗显著减少复发、延长生存时间。除此之外,肝癌术后选择何种辅助治疗方式、持续多长时间均没有定论。术后高危患者的辅助治疗尚需探索。
五、肝癌生物标志物的探索
系统治疗未来发展方向就是探寻生物标志物。HCC目前尚无公认的预后/疗效预测生物标志物。需要加强对肝癌进行分子病理学水平的精准诊断和治疗的研究。寻找特定肿瘤分子标记物选择敏感人群,才能从根本上实现量体裁衣的个体化治疗。
六、总结
现阶段肝癌治疗面临诸多挑战
● 一线:如何选择最佳方案让更多患者获得长生存的机会?
● 二线:治疗转换的时机及序贯方案的选择?
● 术后辅助:如何筛选患者?如何治疗?
靶免治疗时代,靶向治疗与免疫治疗药物以及靶免联合方案给肝癌带来更多机会
● 免疫联合治疗成为晚期肝癌新一线治疗标准之一,但肝癌异质性较强,免疫最佳联合方案有待进一步研究,新药的加入可能会增加疗效。
● 二线及后线方案如何选择还需进一步探索。已有研究提示,一线免疫治疗进展后继续接受免疫治疗,仍有机会取得临床获益。
● 术后辅助治疗研究如火如荼,最佳方案和人群仍未确定。
● HCC预后/疗效预测生物标志物探索方兴未艾,生物标志物组合、预后预测算法/模型等,有望成为未来研究方向。
参考文献
1. Cheng AL, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY, et al. Updated efficacy and safety data from IMbrave150: Atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma. J Hepatol 2022; 76(4):862-873.
2. Abou-Alfa GK, Lau G, Kudo M, Chan SL, Kelley RK, Furuse J, et al. Tremelimumab plus Durvalumab in Unresectable Hepatocellular Carcinoma. NEJM Evid 2022; 1(8):EVIDoa2100070.
3. Bruno S SL, Robin KK, et al.Four-year overall survival update from the phase 3 HIMALAYA study of tremelimumab plus durvalumab in unresectable hepatocellular carcinoma.2023 WCGIC.Abstract SO-15.
4. Peter Robert Galle eaNNpiIvlLosSaf-ltfuhcu.
5. Yau T, Kaseb A, Cheng AL, Qin S, Zhu AX, Chan SL, et al. Cabozantinib plus atezolizumab versus sorafenib for advanced hepatocellular carcinoma (COSMIC-312): final results of a randomised phase 3 study. Lancet Gastroenterol Hepatol 2024; 9(4):310-322.
6. Qin S CS, Gu S, et al. Camrelizumab plus rivoceranib versus sorafenib as first-line therapy for unresectable hepatocellular carcinoma (CARES-310): a randomised, open-label, international phase 3 study[J]. Lancet, 2023, 402(10408):1133-1146.


