【新英格兰医学杂志】综述:系统性轻链型淀粉样变性
时间:2024-07-11 13:02:01 热度:37.1℃ 作者:网络
AL型淀粉样变性
系统性免疫球蛋白轻链型(AL)淀粉样变性是由单克隆免疫球蛋白轻链错误折叠形成淀粉样蛋白,沉积于组织器官,可导致组织结构破坏(源自蛋白聚集体或低聚物或两者的直接细胞毒作用)、器官功能障碍并进行性进展、器官衰竭和最终死亡。器官功能障碍是由于淀粉样蛋白沉积引起的结构破坏,蛋白聚集体或低聚物或两者的直接细胞毒作用,主要与克隆性浆细胞异常增殖有关,少部分与淋巴细胞增殖性疾病有关。
新英格兰医学杂志近日发表综述,描述了AL型淀粉样变性的发病机制、临床特征、危险分层和治疗。作者为波士顿医科大学Vaishali Sanchorawala教授。

AL型淀粉样变性的特征性表现为正常可溶性前体蛋白的异常折叠。异常折叠是蛋白水解事件或氨基酸序列的结果,使免疫球蛋白轻链在热力学和动力学上不稳定,导致自聚集。
AL型淀粉样变性发病机制
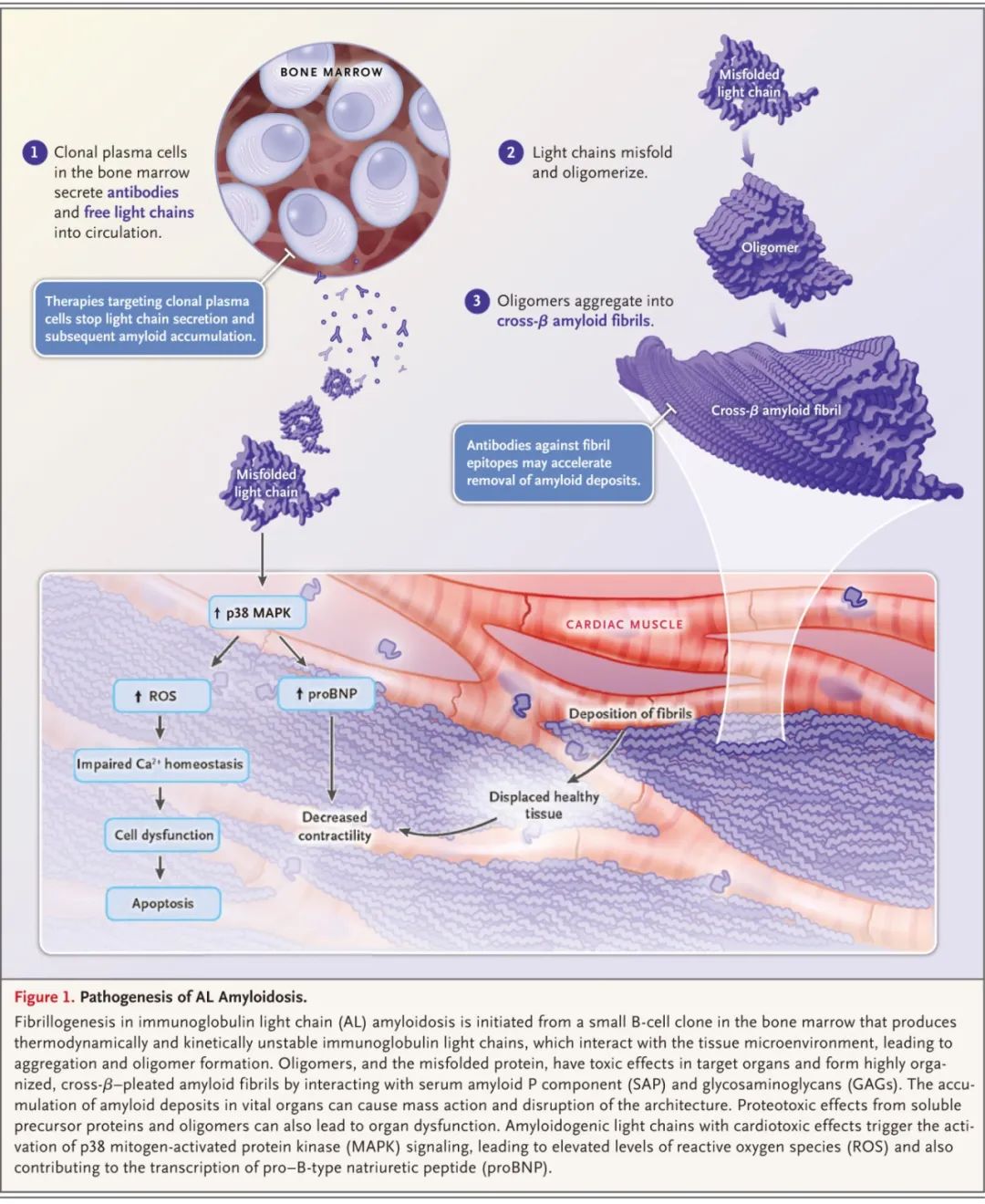
对于大多数患者,AL型淀粉样变性的特征为快速进展的疾病,伴有各种临床综合征。60-70%存肾脏症状,通常表现为肾病范围蛋白尿、低白蛋白血症、继发性高脂血症和水肿;在某些情况下,由于间质或血管淀粉样蛋白沉积,可在无蛋白尿的情况下发生肾衰竭。心脏也经常受累(70~80%),是死亡的主要原因。
AL型淀粉样变性的临床表现
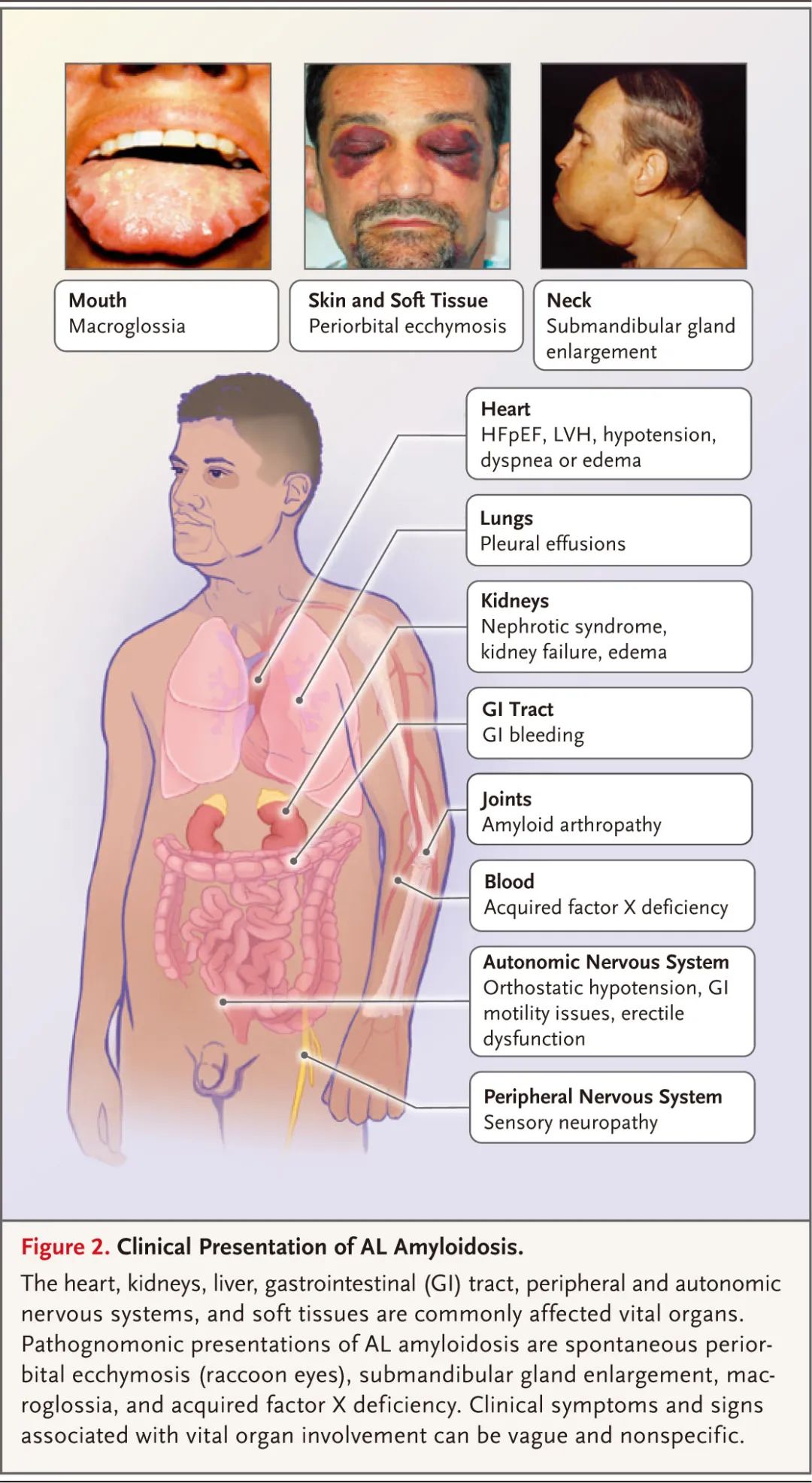
AL型淀粉样变性的症状特异性较低,可导致延迟诊断,早期诊断和适当转诊极为重要。对于不明原因蛋白尿、不明原因的缺血性心肌病、具有自主神经特征的周围神经病变、双侧腕部腕管综合征的患者,或无影像学异常的肝肿大,以及伴非典型表现(如巨舌症或浣熊眼)的单克隆丙种球蛋白病或多发性骨髓瘤患者,应考虑AL型淀粉样变性。

AL 淀粉样变性的诊断需要组织淀粉样蛋白沉积的证据和浆细胞病变的证据。首先通过靶器官或替代器官活检确定淀粉样变的组织学诊断,然后需证实浆细胞病变,包括血清或尿液免疫固定电泳测定单克隆蛋白、免疫球蛋白游离轻链测定、骨髓活检标本中存在λ或κ限制性浆细胞,或三者。须进行骨髓穿刺和活检,以评估浆细胞负荷并排除多发性骨髓瘤和其他可能与 AL 型淀粉样变性相关的不太常见的疾病,包括 B 细胞淋巴增生性疾病如慢性淋巴细胞白血病、惰性淋巴瘤和华氏巨球蛋白血症。
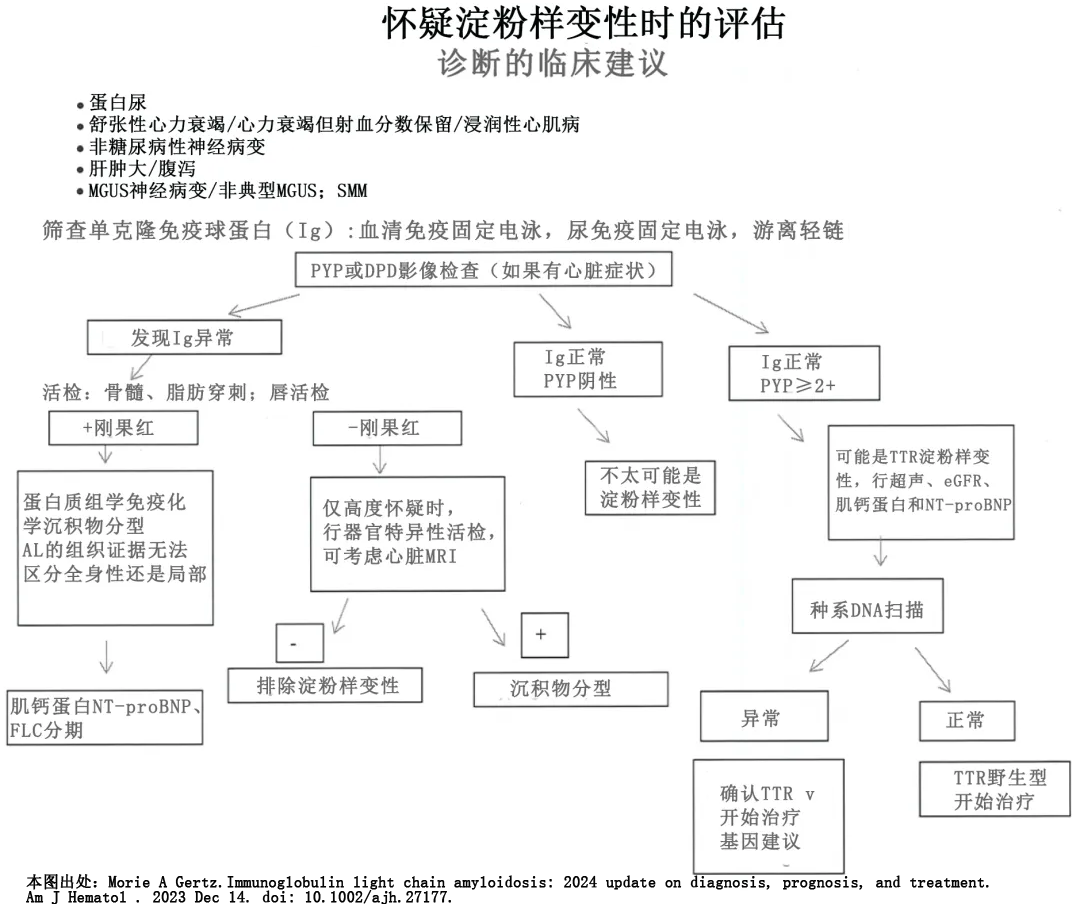
如果在活检标本中检测到淀粉样沉积物,准确鉴定前体蛋白对于指导治疗至关重要。
心脏影像学是AL淀粉样变患者全面心脏评估的关键组成部分,包括超声心动图、心脏磁共振成像、使用放射性示踪剂PET、骨显像等。
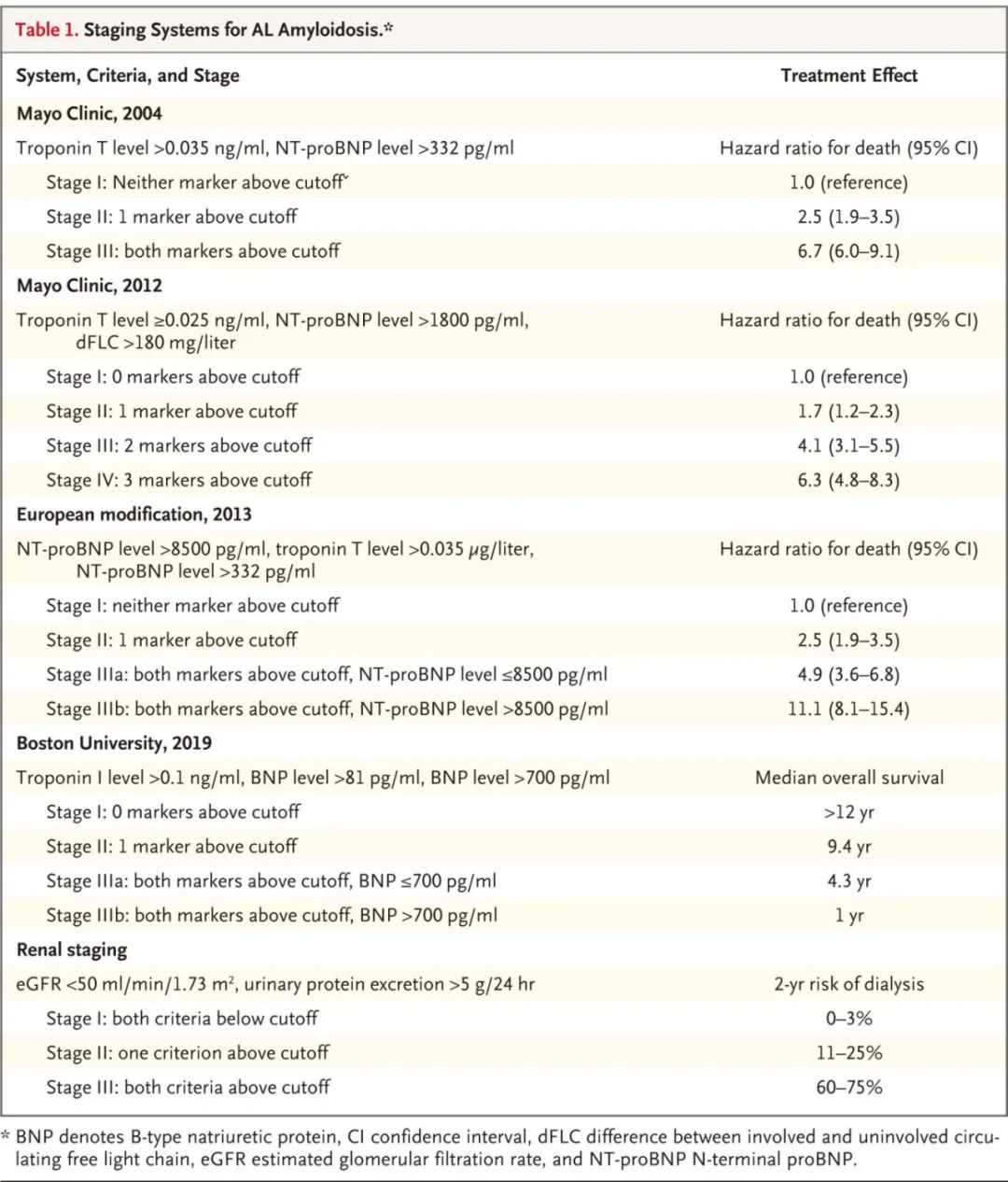
目前用于危险分层和预后的分期系统使用浆细胞病变和心脏和肾脏受累的生物标志物。
AL型淀粉样变性的分期系统
AL型淀粉样变性的治疗原则:快速和持续地减少致病淀粉样蛋白单克隆蛋白的产生;根据器官受累程度、预期毒性作用和疾病程度进行个体化治疗;提供器官特异性的支持治疗,以尽量减少治疗相关的并发症、降低死亡风险、最大限度地提高生活质量。
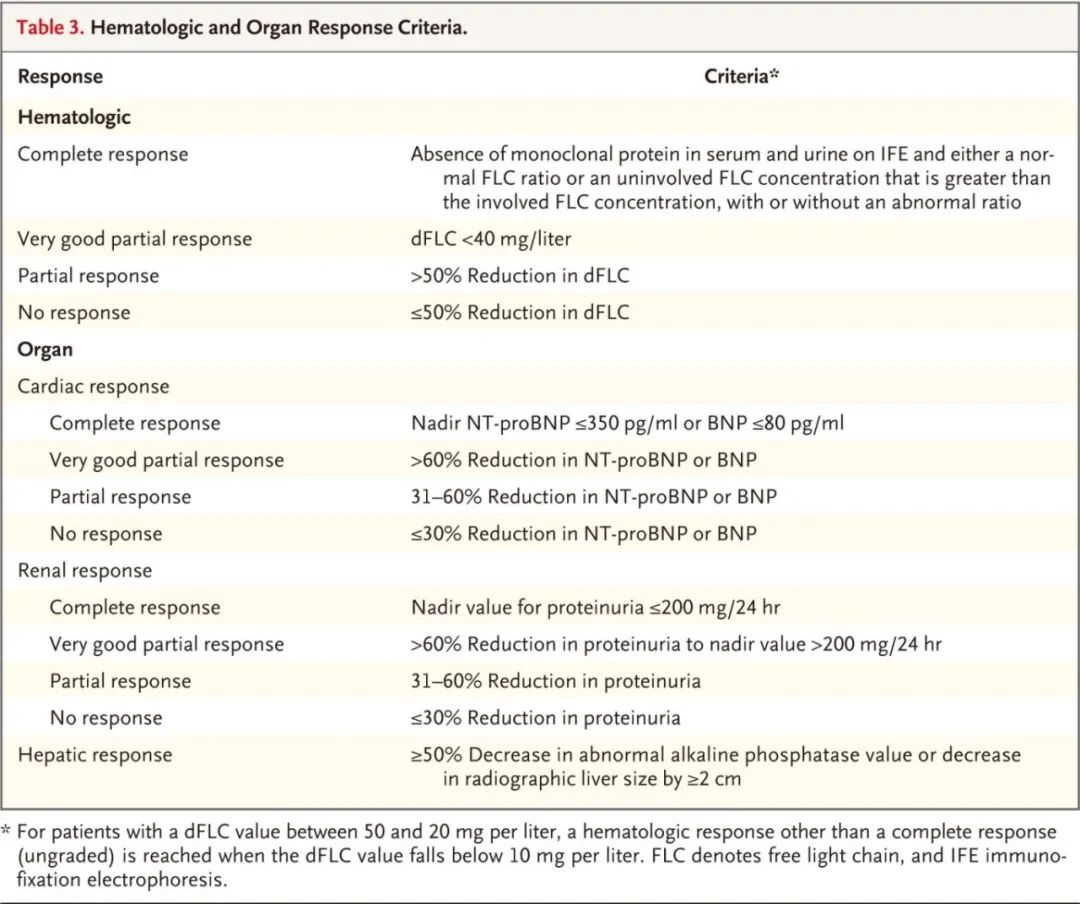
AL型淀粉样变性的支持治疗
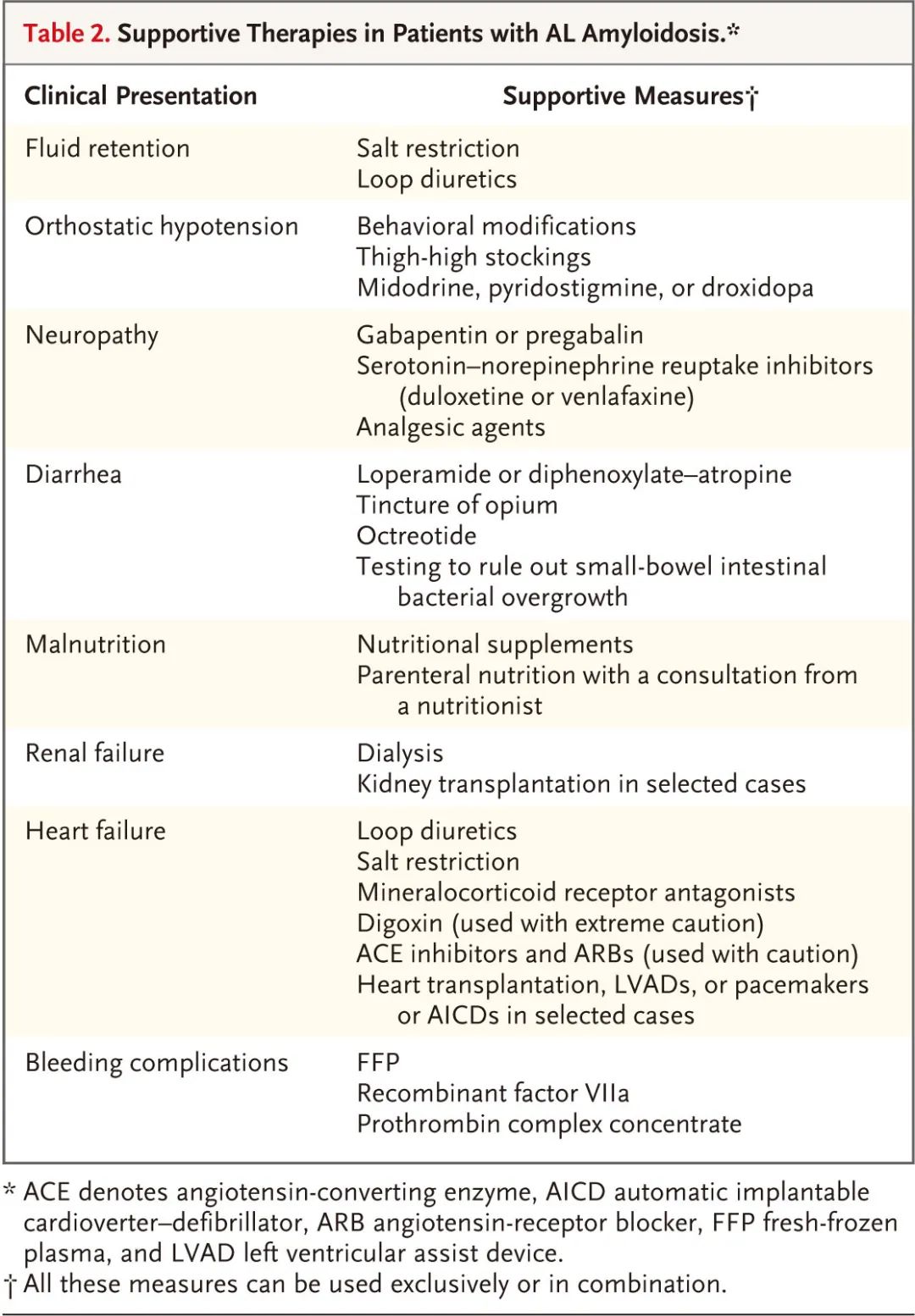
血液学和器官缓解标准
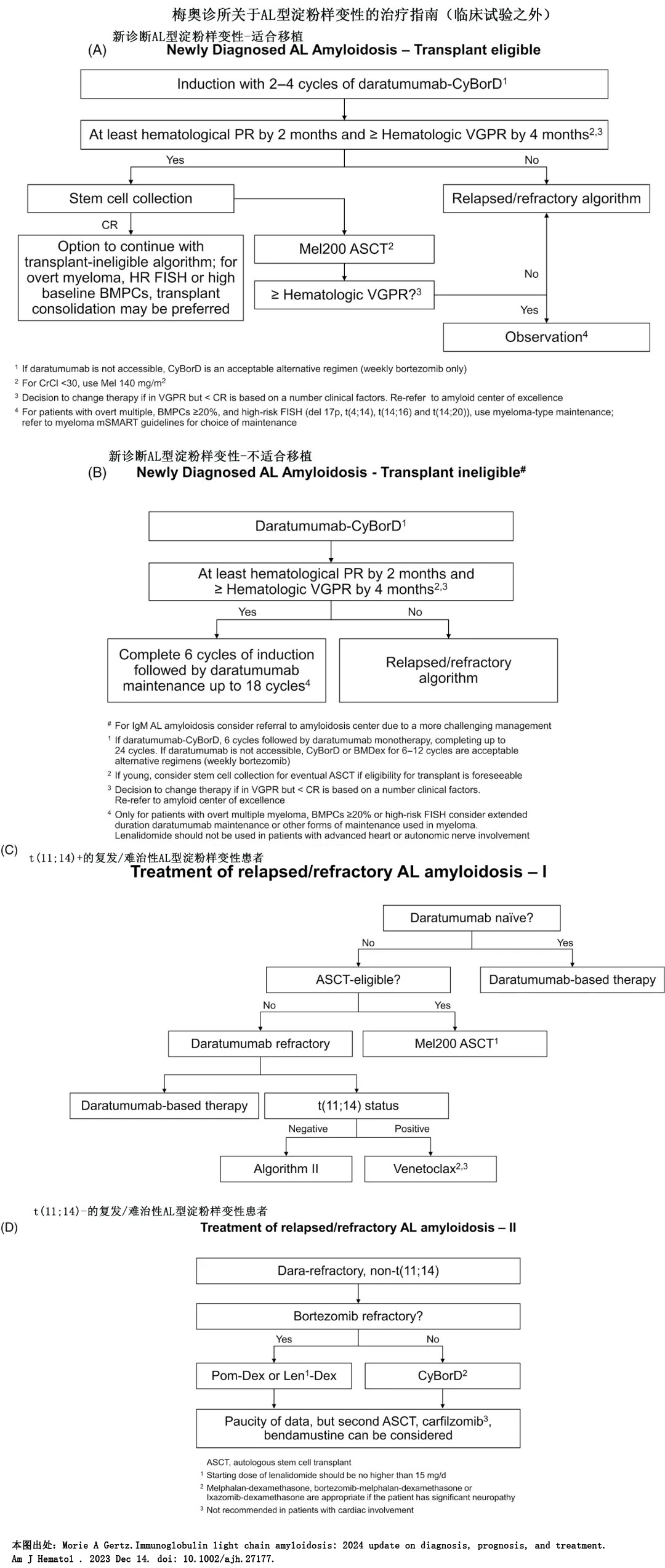
适合移植患者首选自体造血干细胞移植。约80%的患者不适合自体造血干细胞移植,其首选一线治疗方案为环磷酰胺、硼替佐米和地塞米松(VCd)联合达雷妥尤单抗,达雷妥尤单抗不可得时可单独使用VCd或硼替佐米-美法兰-地塞米松。硼替佐米-美法兰-地塞米松可克服1q21 gain和t(11;14)的不良预后。
一线治疗后进展的患者,如果缓解超过一年,可选择一线方案再次治疗,但改变方案更佳。选择范围包括蛋白酶体抑制剂、CD38单抗、免疫调节剂、维奈克拉治疗t(11;14)、苯达莫司汀、自体移植、双抗、CAR-T等。进展时需要考虑初始缓解的深度和持续时间,以及选择以前未使用过的药物,还必须考虑到患者健康水平和终末器官损伤,鼓励参加临床试验。
AL型淀粉样变性的治疗方案
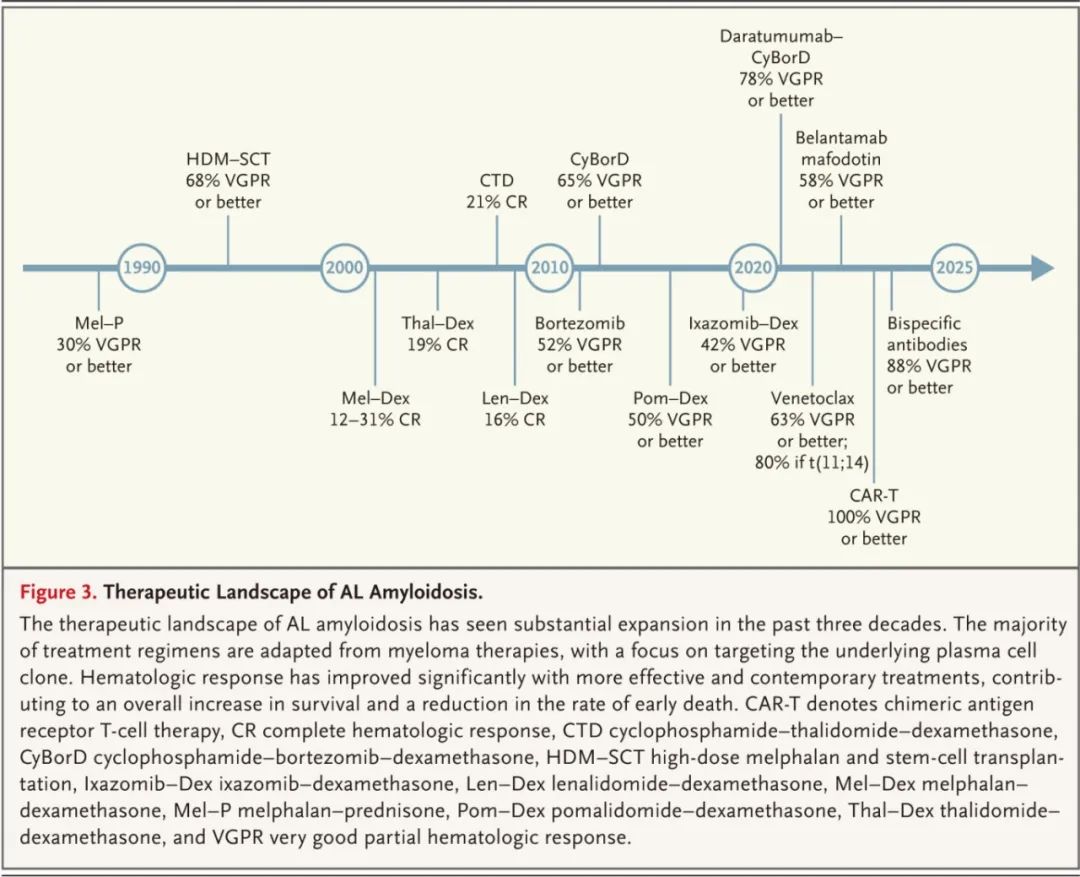
化疗不直接吸收或降解组织中的淀粉样蛋白沉积。目前正在研究两种抗体,birtamimab和anselamimab作为抗纤维药物,它们可通过激活免疫细胞进行化学和酶降解以及诱导抗体依赖性吞噬,从器官中去除淀粉样原纤维。
参考文献
Sanchorawala V.Systemic Light Chain Amyloidosis.N Engl J Med . 2024 Jun 27;390(24):2295-2307. doi: 10.1056/NEJMra2304088.


