重磅更新!儿童新型冠状病毒感染诊断、治疗和预防专家共识(第五版)
时间:2023-01-17 18:01:44 热度:37.1℃ 作者:网络
作者:蒋荣猛1谢正德2姜毅3陆小霞4金润铭5郑跃杰6尚云晓7徐保平8刘智胜9卢根10邓继岿11刘光华12王晓川13王建设14冯录召15刘薇16郑毅17舒赛男18陆敏19罗万军20刘苗3崔玉霞21叶乐平22申阿东23刘钢24高立伟8熊莉娟25白燕5林丽开26魏庄27薛凤霞8王天有28赵东赤29赵正言30邵剑波31黄永坚32何颜霞33李兴旺1杨永弘6,23申昆玲6,8
通信作者:李兴旺,Email:ditanlxw@163.com;杨永弘,Email:yyh628628@sina.com;申昆玲,Email:kunlingshen1717@163.com
作者单位:1首都医科大学附属北京地坛医院感染性疾病诊疗中心,北京100015;2国家儿童医学中心(北京),首都医科大学附属北京儿童医院,北京市儿科研究所,中国医学科学院儿童危重感染诊治创新单元,国家呼吸系统疾病临床医学研究中心,儿科重大疾病研究教育部重点实验室,儿童呼吸道感染性疾病研究北京市重点实验室,北京100045;3武汉大学人民医院儿科,武汉430060;4华中科技大学同济医学院附属武汉儿童医院呼吸科,武汉430016;5华中科技大学同济医学院附属协和医院儿科,武汉430022;6深圳市儿童医院呼吸科,深圳518038;7中国医科大学附属盛京医院小儿呼吸内科,沈阳110004;8国家儿童医学中心(北京),国家呼吸系统疾病临床医学研究中心,首都医科大学附属北京儿童医院呼吸科,北京100045;9华中科技大学同济医学院附属武汉儿童医院神经内科,武汉430016;10广州市妇女儿童医疗中心呼吸科,广州510623;11深圳市儿童医院感染科,深圳518038;12上海儿童医学中心福建医院,福建省儿童医院儿科,福州350005;13国家儿童医学中心(上海),复旦大学附属儿科医院临床免疫/过敏科,上海201102;14复旦大学附属儿科医院感染传染科,上海201102;15中国医学科学院北京协和医学院群医学及公共卫生学院,北京100730;16天津大学儿童医院,天津市儿童医院,天津300134;17首都医科大学附属北京安定医院,国家精神心理疾病临床医学研究中心,精神疾病诊断与治疗北京市重点实验室,北京100088;18华中科技大学同济医学院附属同济医院儿科,武汉430030;19上海市儿童医院呼吸科,上海200062;20华中科技大学同济医学院附属武汉儿童医院感染管理办公室,武汉430016;21贵州省人民医院儿科,贵阳550002;22北京大学第一医院儿科,北京100034;23国家儿童医学中心(北京),国家呼吸系统疾病临床医学研究中心,首都医科大学附属北京儿童医院,北京市儿科研究所,北京100045;24国家儿童医学中心,首都医科大学附属北京儿童医院感染科,北京100045;25华中科技大学同济医学院附属协和医院感染性疾病科,武汉430022;26武汉大学中南医院武汉大学医院管理研究所,武汉430071;27国家儿童医学中心(北京),首都医科大学附属北京儿童医院儿童保健中心,北京100045;28国家儿童医学中心,首都医科大学附属北京儿童医院血液肿瘤中心,北京100045;29武汉大学中南医院儿科,武汉430071;30浙江大学医学院附属儿童医院发育行为科,杭州310051;31华中科技大学同济医学院附属武汉儿童医院放射影像中心,武汉430016;32香港中文大学威尔斯亲王医院儿科,香港999077;33深圳市儿童医院重症医学科,深圳518038
蒋荣猛和谢正德对本文有同等贡献
本文刊发于中华实用儿科临床杂志,2023,38(1)
引用本文:蒋荣猛,谢正德,姜毅,等.儿童新型冠状病毒感染诊断、治疗和预防专家共识(第五版)——应对奥密克戎变异株[J].中华实用儿科临床杂志,2023,38(1):.DOI:10.3760/cma.j.cn101070-20230114-00036.[网络预发表].
声明:本篇内容已经过同行评议,作为优先出版方式在线发表,可作为有效引用数据。因优先发表的内容尚未完成规范的编校流程,不保证其内容与最终印刷版内容完全一致。
摘要
2023年1月8日起,我国将新型冠状病毒病(COVID-19)列为法定乙类传染病管理范畴并按照乙类管理。鉴于目前奥密克戎变异株为我国主要流行病毒株,为与时俱进地指导儿童新型冠状病毒(SARS-CoV-2)感染的救治工作,参考《新型冠状病毒感染诊疗方案(试行第十版)》、《儿童新型冠状病毒感染诊断、治疗和预防专家共识(第四版)》和儿科相关病毒感染诊疗策略,特制订《儿童新型冠状病毒感染诊断、治疗和预防专家共识(第五版)》,对相关病原学、流行病学、致病机制、临床表现、辅助检查、诊断、治疗等内容进行了相应更新,新增了COVID-19相关脑病、暴发性心肌炎等严重并发症的救治要点,供临床参考。
关键词
新型冠状病毒感染;儿童;奥密克戎变异株;诊断;治疗;预防;共识
肆虐全球的新型冠状病毒(SARS-CoV-2)感染已在全球流行3年多,2019新型冠状病毒病(COVID-19)给人类社会造成了巨大影响。根据世界卫生组织(WHO)的资料[1]:截至2023年1月1日,全球COVID-19确诊病例超过6.56亿例,其中死亡病例超过660万。SARS-CoV-2全球流行的第1年(2020年),主要是原始毒株和阿尔法(Alpha)、贝塔(Beta)、伽玛(Gamma)变异毒株,2020年12月后主要是德尔塔(Delta)变异株,自2021年11月后,陆续出现奥密克戎(Omicron)B.1.1.529、BA1、BA2、BA4、BA5变异株,其传染性增强、潜伏期缩短,且免疫逃逸能力增强,从而造成全球新一轮疫情暴发,儿童感染率明显升高,其致病力有所降低。2022 年 10 月份以来,免疫逃逸能力和传染性更强的 BF.7、BQ.1 和 BQ.1.1 等亚分支及重组变异株(XBB)的传播优势迅速增加,在部分国家和地区已经取代BA.5.2 成为优势流行株。国家疾病预防控制中心监测数据显示,我国现阶段流行的毒株以BA.5的亚分支BA.5.2和BF.7为主[2]。
目前,SARS-CoV-2疫苗接种在全球范围内已广泛应用,对降低危重症住院率和死亡率起了重要作用。我国3岁以上儿童疫苗第1剂次接种覆盖率和全程接种覆盖率分别达到98%和95%以上[3]。由于各区域接种率不同和个体遗传因素差异,并不能完全防止感染和重症的发生。儿童在感染后出现热性惊厥、急性坏死性脑病(acute necrotizing encephalopathy,ANE)、多系统炎症综合征(multisystem inflammatory syndrome in children,MIS-C)、精神行为异常等情况的增加需高度关注。
2023年1月8日起,我国将COVID-19列为法定乙类传染病管理范畴并按照乙类管理。为与时俱进地指导儿童SARS-CoV-2感染的救治工作,参考国家卫生健康委员会发布的《新型冠状病毒感染诊疗方案(试行第十版)》[4]、《儿童新型冠状病毒感染诊断、治疗和预防专家共识(第四版)》[5]和儿科相关病毒感染诊疗策略,特制订《儿童新型冠状病毒感染诊断、治疗和预防专家共识(第五版)》,以供临床参考。
病原学
SARS-CoV-2属于β冠状病毒属[4-5],有包膜,病毒颗粒呈圆形或椭圆形,直径60~140 nm,病毒颗粒中包含 4 种结构蛋白:刺突蛋白(spike,S)、包膜蛋白(envelope,E)、膜蛋白(membrane,M)、核壳蛋白(nucleocapsid,N)。基因组大小约为29.9 kb。核壳蛋白N包裹着病毒 RNA 形成病毒颗粒的核心结构——核衣壳,核衣壳由双层脂膜包裹,双层脂膜上镶嵌有SARS-CoV-2的S、M、N蛋白,其中,S蛋白上的受体结合域(receptor binding domain,RBD)能够识别宿主细胞受体血管紧张素转化酶 2(ACE2),并与之结合感染宿主细胞。SARS-CoV-2在人群中流行和传播过程中基因频繁发生突变,当 SARS-CoV-2不同的亚型或子代分支同时感染人体时,还会发生重组,产生重组病毒株;某些突变或重组会影响病毒生物学特性,如S蛋白上特定的氨基酸突变后,导致 SARS-CoV-2与 ACE2 亲和力增强,在细胞内复制和传播力增强;S蛋白一些氨基酸突变也会增加对疫苗的免疫逃逸能力和降低不同亚分支变异株之间的交叉保护能力,导致突破感染和一定比例的再感染。根据目前相关数据统计,对人类影响最大的变异株包括:Alpha B.1.1.7、Beta B.1.351、Gamma P.1、Delta B.1.617.2和Omicron B.1.1.529[4-5]。Omicron变异株是目前流行的优势变异株,已报道BA.1、BA.2、BA.3、BA.4、BA.5[6-7],XE、XF和、XD和XBB等多个系(lineage)和BQ.1亚系(sub-lineage),其中XE(BA.1和BA.2重组)、XF(BA.1和英国Delta重组)、XD (BA.1和Delta变体重组)和XBB(BA.2.10.1和 BA.2.75亚系重组)是重组变异毒株,BQ.1 是BA.5亚系[8-9],我国已经监测到BQ.1、XBB传入,但在我国尚未形成优势传播,优势传播还是以BA.5.2和BF.7为主[2]。Omicron变异株S蛋白及RBD相较于原始株具有34个以上的突变,这些突变使其具有更强的传播能力和免疫逃逸能力,其基本再生数(R0)为9.5(Delta 变异株的R0为3.0),BA.4/5具有的L452R、F486V 和R493Q 突变,是导致其高免疫逃逸能力的关键突变位点[10]。因此,需持续监测SARS-CoV-2的基因突变及新变异株的出现及其生物学特性的变化。
SARS-CoV-2在不同的物体表面的存活时间存在较大差异。在常温下,SARS-CoV-2在气溶胶中可存活3~16 h,在不锈钢和塑料表面保存其感染性达3~4 d,在厚纸板和钞票上可存活1~2 d,而在面巾纸上只能存活30 min左右[11],在通风不良的公共汽车空气中存在至少30 min[12];低温环境中其存活时间更长,如在4 ℃条件下,14 d内病毒浓度仅下降0.7 log TCID50/mL(10%左右)[13]。Omicron变异株(BA.1和BA.2)比其他SARS-CoV-2病毒株有更好的环境稳定性[14]。病毒对紫外线和热敏感,56 ℃ 30 min、乙醚、75%乙醇、含氯消毒剂、过氧乙酸和氯仿等脂溶剂均可有效灭活病毒,但氯已定不能有效灭活病毒。
流行病学
2.1 传染源 主要是SARS-CoV-2感染者(包括症状感染者和无症状感染者),症状感染者在潜伏期即有传染性,发病后3 d内传染性最强;无症状感染者是不容易被发现的重要传染源。
2.2 传播途径 (1)经呼吸道飞沫和密切接触传播是主要的传播途径。(2)在相对封闭的环境中经气溶胶传播。(3)接触被病毒污染的物品后也可造成感染。(4)有SARS-CoV-2母婴垂直传播的相关报道,目前仅见于妊娠后期的感染病例。
家庭、学校和托幼机构聚集性发病是儿童SARS-CoV-2感染的主要特点。
2.3 易感人群 儿童普遍易感,有基础疾病(先天性心脏病、慢性肺疾病、神经系统疾病、重度营养不良、肿瘤、肥胖、糖尿病、遗传性疾病、先天性和获得性免疫功能缺陷或低下等)者易发生重症。感染后或接种SARS-CoV-2疫苗后可获得一定的免疫力。
2.4 季节特点 一年四季均可发生,高温和紫外线在一定程度上可减弱其传播,因此,夏季发病相对较低,秋冬季增加。
致病机制
SARS-CoV-2主要致病机制与病毒直接损害、宿主过强的免疫应答反应和个体遗传因素有关,具体包括以下几个方面。
3.1 病毒直接损害 SARS-CoV-2可与呼吸道上皮细胞、肾、心、肠道、脑、血管内皮、免疫细胞等人体多种细胞的ACE2受体结合,直接造成脏器损伤[15-17]。直接侵犯肠道上皮细胞,破坏肠道微环境,出现腹泻、呕吐、食欲减退等;通过跨突触传播或血源性传播直接侵入神经细胞导致头痛、头晕等,病情进展可出现脑炎、脑脊髓炎等。Omicron是迄今为止突变位点最多的SARS-CoV-2变异株,包括S-pro突变和非S-pro突变,S-pro突变有利于病毒利用质膜和胞内体途径进入体内[18],且更易侵犯上呼吸道[19-20];与野生型SARS-CoV-2相比,Omicron变异株的S蛋白及其RBD位点的突变,使其与ACE2亲和力更高,免疫逃逸能力增强,因此传染性更强,且疫苗和治疗性单克隆抗体的中和活性大大降低[6]。
3.2 过强的免疫应答引起的免疫损害 包括:(1)炎症因子风暴,也称作细胞因子风暴,即感染后机体引发过强的免疫反应,大量免疫细胞活化(单核巨噬细胞、辅助性T淋巴细胞、细胞毒性T淋巴细胞等)、促炎因子释放,造成肿瘤坏死因子(TNF)-α、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、α干扰素、β干扰素、γ干扰素等迅速大量产生,引起全身炎症反应以及自身免疫反应[21-22]。(2)凝血功能异常,血管内皮损伤和大量细胞因子释放会通过多种途径激活凝血系统,使凝血/纤溶系统功能紊乱,介导血栓形成,加重多脏器损害。儿童多系统炎症综合征(multisystem inflammatory syndrome in children, MIS-C)的发生与病毒感染后的异常免疫反应和广泛的血管内皮损伤相关[23]。
3.3 宿主个体遗传因素 在重症及致死性病例中,3%~5%存在Ⅰ型干扰素通路相关的基因缺陷,如Toll样受体3(TLR3)、干扰素调节因子7(IRF7)和IRF9等,10%~20%检测到干扰素自身抗体,造成内源性干扰素生成严重不足或缺乏[24-25]。
病理生理改变[26-33]
呼吸系统最常受累。病毒侵犯引起呼吸道上皮细胞脱落、充血水肿,黏液分泌增加,气道腔内可见黏液及黏液栓形成,导致气道狭窄。累及肺泡腔,出现Ⅱ型肺泡上皮细胞增生,部分细胞脱落,肺泡腔内见浆液、纤维蛋白性渗出物及透明膜形成,伴单核和巨噬细胞渗出,弥漫性肺泡损伤,可导致呼吸窘迫。肺泡间隔血管充血、水肿,可见单核和淋巴细胞浸润及血管内透明血栓形成。部分伴有机化性肺炎、肺梗死、肺出血和纤维化等病理表现。
消化道、肝、脾、胰腺、肾、心脏、脑、淋巴结、皮肤等全身各器官也可受累,造成组织细胞损伤,其内均可检测到SARS-CoV-2核酸。感染部位小血管可见内皮细胞脱落、内膜或全层炎症;可见血管内混合血栓形成、血栓栓塞及相应部位的梗死;主要脏器(肺、肝等)微血管可见透明血栓形成,如广泛的肺泡毛细血管微血栓形成等。
临床表现[4-5,34-35]
潜伏期为1~14 d,多为2~4 d。临床表现多样,儿童患者以轻症为主,大多数患儿预后良好,一般无长期后遗症。
5.1 全身表现 以发热、乏力、肌肉酸痛为主。部分患儿可为高热,一般不超过3 d。
5.2 呼吸系统表现 以咳嗽、鼻塞、流涕、咽痛等症状多见。可表现为急性喉炎、急性喉气管炎,出现声音嘶哑、犬吠样咳嗽,伴或不伴有吸气性喉鸣和上呼吸道梗阻造成的呼吸窘迫。肺炎患儿可出现呼吸急促、喘息,肺部可闻及湿啰音和哮鸣音,重症可发展为呼吸困难、发绀,极少数可快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和及多器官功能衰竭(如急性肾损伤/肾衰竭等)。
5.3 消化道系统表现 部分患儿出现食欲下降、呕吐、腹泻等消化道症状。
5.4 神经和精神系统表现 可出现头痛、肌痛易激惹、嗅觉或味觉下降减退等非特异性神经系统症状表现。少数患儿出现特异性神经系统受累表现,如惊厥发作、脑病、脑炎或脑膜炎、急性播散性脑脊髓膜炎、脑血管病、吉兰-巴雷综合征等。已有神经系统等基础疾病及未接种疫苗的患儿,在急性期易出现可能危及生命的神经系统重症;极少数患儿感染后快速进展为COVID-19相关脑病如ANE,临床主要表现为发热后出现惊厥、意识障碍(迅速进展至昏迷)等急性脑病症状和多器官功能衰竭,重者可导致死亡。
另外,少数患儿可能出现睡眠异常、认知功能障碍、焦虑抑郁情绪及冲动攻击行为等,重症患儿可能发生急性或慢性心理应激反应。
5.5 循环系统表现 部分患儿出现心率增快或心律失常,也可仅表现为面色苍白/青灰、紫绀、精神反应差、胸闷,重症者起病急,因症状隐匿容易被忽视,快速进展为急性心力衰竭、恶性心律失常等,极少数患儿可发生暴发性心肌炎或心源性休克,甚至猝死。
5.6 皮肤系统表现 部分患儿在发热伴随或者热退后出现皮疹,类型多样,可表现为急性荨麻疹、斑丘疹样(麻疹样)皮损、多形红斑样皮损等。
5.7 COVID-19 相关的MIS-C 主要表现为发热(>38℃)且超过3 d,并出现如下2个及以上系统器官受累的体征,包括:(1) 皮疹或双侧非化脓性结膜炎或皮肤粘膜炎(口、手或足部);(2)低血压或休克;(3)心肌功能障碍、心包炎、瓣膜炎,或冠状动脉异常;(4)凝血障碍;(5)急性胃肠道症状(腹泻、呕吐或腹痛)且除外其他微生物感染引起的休克综合征。
实验室检查
6.1 血液学检查[36-37] (1)外周血白细胞总数正常或降低,可见淋巴细胞计数减少,C反应蛋白(C-reactive protein,CRP)和红细胞沉降率(erythrocyte sedimentation rate,ESR)升高,降钙素原(procalcitonin,PCT)通常正常。极少数患儿出现肝酶、乳酸脱氢酶、肌酶、肌红蛋白、肌酐、铁蛋白和肌钙蛋白增高。(2)重症和危重症患儿D-二聚体升高,外周血淋巴细胞数进行性减少;可有IL-1、IL-6、IL-8、TNF-α等炎症因子水平升高。(3)出现MIS-C时,炎症标志物(CRP、ESR、PCT、铁蛋白和IL-6等)显著升高,中性粒细胞增多,淋巴细胞减少,D-二聚体、肌钙蛋白和B型利钠肽升高。
6.2 病原学检查[4-5,38]
6.2.1 核酸检测 在鼻咽(口咽)拭子、痰液和其他下呼吸道样本、血液、脑脊液等标本检测到SARS-CoV-2核酸。荧光定量 PCR 是目前最常用的 SARS-CoV-2核酸检测方法。
6.2.2 抗原检测 呼吸道标本的SARS-CoV-2抗原检测操作简单、快速,适于门急诊和自我检测,抗原检测的敏感性低于核酸检测,阴性不能除外SARS-CoV-2感染。
6.2.3 病毒分离培养 从呼吸道等标本中可分离、培养获得 SARS-CoV-2。
6.2.4 血清学抗体检查 (1)对于已接种SARS-CoV-2疫苗的患者,不建议将血清SARS-CoV-2抗体检测用于SARS-CoV-2感染的诊断;(2)对于未接种SARS-CoV-2疫苗的患者,血清中抗SARS-CoV-2特异性IgM和IgG抗体均为阳性时有助于确诊,单纯IgM抗体检测阳性则需排除非特异性反应,一般不能作为确诊的依据。由于病毒感染后血清特异性抗体的产生并达到检测的阈值需要一定时间,故发病早期IgM和IgG抗体双阴性不能除外感染。因此,IgM和IgG检测在SARS-CoV-2感染早期诊断的价值有限,适用于回顾性诊断和血清流行病学调查。
影像学检查[35,39-45]
7.1 胸部影像学检查 对于SARS-CoV-2无症状感染者和仅表现为急性上呼吸道感染的患儿,一般不需要进行影像学检查;如果下呼吸道感染症状明显或持续,或者肺部有异常体征,需考虑行X线胸片或CT检查。
7.1.1 X线胸片检查 可出现局限性斑片状影,重症表现为双肺多发实变影或“白肺”表现。
7.1.2 胸部CT检查 早期多表现为单发或多发的局限磨玻璃影,可呈淡薄云雾状或细网格状,内可见增粗血管影,少数呈局限实变影。病情进展可表现为磨玻璃影增多,或者范围扩大有融合趋势,进而呈大片实变影。重症者表现为单侧或双侧肺呈弥漫性实变和磨玻璃影混合存在影,内见支气管充气征,以实变影为主,少数表现为“白肺”,胸腔积液和气胸极少见。多数患儿肺部病变可完全吸收好转,间质纤维化罕见。
7.2 头颅影像学检查 高度怀疑患儿合并有中枢神经严重损害,尤其是ANE时应首选头颅MRI检查,不具备条件者行头颅CT检查。
ANE的影像学主要特征是对称性、多灶性脑损害,白质与灰质均可受累,病灶主要分布在丘脑(100%)、上脑干被盖、侧脑室周围白质和小脑髓质。头颅MRI典型表现为:丘脑在表观弥散系数(ADC)图上呈“三色模式”(中央高信号和周围低信号环,以及丘脑周围高信号)或“双色模式”(丘脑中央低信号及边缘高信号)。早期主要表现为脑水肿,若病情加重则表现为点状出血、坏死,大部分存活病例可遗留脑萎缩、含铁血黄素沉积、囊腔形成等退行性改变,并持续数月至数年。
诊断[4-5]
8.1 诊断原则 根据流行病学史、临床表现、实验室检查等综合分析,作出诊断。SARS-CoV-2核酸检测阳性为确诊的首要标准。
8.2 诊断标准[4-5] (1)具有 SARS-CoV-2感染的相关临床表现。(2)具有以下1种或以上病原学、血清学检查结果:① SARS-CoV-2核酸检测阳性;② SARS-CoV-2抗原检测阳性;③ SARS-CoV-2分离、培养阳性;④恢复期 SARS-CoV-2特异性 IgG 抗体水平为急性期 4 倍或以上。
8.3 临床分型[4-5,46]
8.3.1 无症状感染 呼吸道等标本SARS-CoV-2病原学检测呈阳性,整个感染过程中无相关临床表现,如发热、干咳、咽痛等可自我感知或可临床识别的症状与体征。
8.3.2 轻型 以急性上呼吸道感染为主要表现,如咳嗽、咽痛、鼻塞等,可伴有发热、乏力、头痛、肌痛等,临床表现和查体无下呼吸道受累征象。
8.3.3 中型 有咳嗽、气促等呼吸道症状,但呼吸频率(respiratory rate,RR)<30 次/min、静息状态下吸空气时指氧饱和度>93%。影像学检查可见肺炎改变,但未达到重症肺炎程度。
8.3.4 重型 符合下列任何1项者。(1)出现气促:<2月龄,RR≥60次/min;2~12月龄,RR≥50次/min;1~5岁,RR≥40次/min;>5岁,RR≥30次/min,除外发热和哭闹的影响。(2)静息状态下,吸空气时指氧饱和度≤93%。(3)有呼吸困难表现:伴有呻吟、鼻翼扇动或三凹征,发绀,间歇性呼吸暂停。(5)出现惊厥或意识障碍。(6)拒食或喂养困难,有脱水征。(7)肺部高分辨率CT检查结果显示双侧或多肺叶浸润、短期内病变快速进展>50%或出现胸腔积液。
8.3.5 危重型 符合以下情况之一者:(1)出现呼吸衰竭,且需要机械通气;(2)出现休克;(3)出现急性脑病、ANE或合并其他器官严重功能障碍需要重症监护治疗。
8.4 重症和危重症的早期识别
8.4.1 重症高危人群[5,47-57] 有基础疾病的患儿,包括先天性心脏病、慢性肺疾病、神经系统疾病、重度营养不良、肿瘤、肥胖、糖尿病、遗传性疾病、先天性和获得性免疫功能缺陷或低下等。另外,早产儿和出生低体重儿感染也需重点关注病情进展。
8.4.2 预警指标[4-5] 符合下列指标任何1项者提示可能病情恶化。
8.4.2.1 临床特征 (1)持续高热3~5 d不退、病程>1周且症状、体征无改善或进行性加重者。(2)呼吸急促,除外发热和哭吵的影响。(3)静息状态下,指氧饱和度SpO2≤95%。(4)出现精神反应差、惊厥后意识障碍等。(5)末梢毛细血管充盈时间延长。(6)出现严重的消化道症状:呕吐、腹泻和腹痛等。
8.4.2.2 血液和生化指标 (1)外周血淋巴细胞显著减少和/或血小板减少,CRP显著增高,PCT显著增高。(2)生化指标进行性升高,如心肌酶、肝酶、乳酸脱氢酶、脑钠肽、乳酸等。(3)D-二聚体、IL-1、IL-6、铁蛋白显著增高。(4)不能解释的代谢性酸中毒。
8.4.2.3 有较为严重的基础疾病或出现其他病原混合感染。
鉴别诊断[4-5]
主要与流感病毒、呼吸道合胞病毒、鼻病毒、副流感病毒、腺病毒、人偏肺病毒、其他冠状病毒等所引起的呼吸道感染相鉴别,以及要与肺炎支原体肺炎、细菌性肺炎、衣原体肺炎及川崎病等相鉴别。
在诊断时要密切关注SARS-CoV-2与包括流感病毒、呼吸道合胞病毒、肺炎链球菌、金黄色葡萄球菌、A族链球菌在内的其他病原混合感染的情况。
治疗
10.1 治疗原则[4-5] (1)无症状感染:无需药物治疗,但需密切监测病情变化。(2)轻型:局部应用干扰素α喷雾剂治疗及对症处理。(3)中型:可予以干扰素α雾化治疗,根据病情需要予以支持及对症治疗。可配合儿童在监护下行俯卧位通气。(4)重型:在对症和支持等治疗基础上,予以氧疗、呼吸循环支持、糖皮质激素、血液净化等治疗。(5)危重型:综合治疗基础上,多学科积极合作、尽早抗炎、多脏器功能支持、纠正休克和出凝血功能障碍,防治并发症,必要时加用抗菌药物治疗。
此外,对于早产儿及小婴儿,应加强营养、喂养及护理,加强生长发育监测。
10.2 一般治疗及监测[4-5,35,58] 患儿需注意休息,保证充分热量和液体摄入,维持水电解质、内环境稳定和微生态平衡,可服用酪酸梭菌或双歧杆菌等微生态制剂,调整肠道菌群,提高机体免疫力;保持呼吸道通畅,湿化气道,必要时给予吸氧。根据病情需要密切监测生命体征、血氧饱和度、CRP、肝肾及心肌酶学相关生化指标、凝血功能,动脉血气分析等,必要时行胸部影像学、炎症因子、铁蛋白等检测。
10.3 对症治疗[4-5,35,59-61] 积极控制高热。体温超过38.5℃伴有明显不适者应及时使用退热药物治疗,常用退热药物有布洛芬和对乙酰氨基酚。保持患儿安静,出现惊厥时需及时止惊。
呼吸道分泌物增多且黏稠者进行祛痰治疗,常用药物有:吸入用乙酰半胱氨酸溶液或吸入用盐酸氨溴索溶液雾化吸入。必要时雾化后吸痰。
出现腹泻者,应综合评估患儿水电解质失衡和脱水情况,轻度脱水者首选口服补液盐,重者需静脉补液,静脉补液时应密切关注肺部情况。可服用酪酸梭菌(二联)活菌散等肠道微生态制剂,缓解腹泻症状,缩短病程。必要时可酌情加用蒙脱石散/混悬液。
出现急性喉炎或急性喉气管炎表现者,需尽快评估上气道梗阻和缺氧程度,及时给予吸氧,同时保持环境空气湿润,足够液体摄入,维持水电解质平衡,避免患儿烦躁和哭闹。药物治疗首选糖皮质激素。轻症可单剂口服地塞米松0.15~0.60 mg/kg,最大剂量为16 mg;或口服泼尼松龙1~2 mg/(kg? d),最大剂量为60 mg/d;中度、重度病例首选地塞米松(0.6 mg/kg,最大剂量为16 mg)口服,不能口服者静脉或肌内注射;也可同时给予糖皮质激素雾化吸入,常用药物包括:布地奈德、丙酸氟替卡松等。紧急情况下也可雾化吸入 L-肾上腺素以快速缓解上气道梗阻症状,每次 0.5 mL/kg(最大量 5 mL),持续 15 min, 若症状不缓解,15~20 min钟后可重复吸入。气道梗阻严重者应予气管插管或气管切开、机械通气,维持气道通畅。
出现喘息以及肺部哮鸣音者,在综合治疗的基础上可加用支气管舒张剂和糖皮质激素雾化吸入,常用药物包括沙丁胺醇、异丙托溴铵、布地奈德、丙酸氟替卡松等。
伴有皮疹者,需除外药物影响和原有皮肤疾病加重等情况。轻症者可口服抗组胺药,严重者需全身应用糖皮质激素或IL-6抑制剂等。局部皮损处需要注意皮肤屏障修复和对症处理,必要时皮损处外涂糖皮质激素制剂。疑似或确诊MIS-C者参照MIS-C治疗原则进行救治。
10.4 抗病毒治疗 我国尚无批准用于儿童的SARS-CoV-2感染的特异性抗病毒药物。
10.4.1干扰素[62-66] 根据国内外使用干扰素α治疗病毒感染性疾病以及SARS-CoV-2感染的相关研究,干扰素α能有效降低病毒载量,尽早使用有助于减轻症状,缩短病程,可用于儿童SARS-CoV-2感染。
用法如下:(1)干扰素α喷雾剂:鼻腔每侧1~2喷、口咽部共8~10喷,8~10次/ d,疗程5~7 d。用于无症状感染者及上呼吸道感染患儿。(2)干扰素α雾化:干扰素α20万~40万IU/kg或2~4 μg/kg,生理盐水2 mL,雾化吸入,2次/ d,疗程5~7 d。用于肺炎等下呼吸道感染患儿。
10.4.2 小分子抗病毒药[4-5,35] 我国国家药品监督管理局(NMPA)应急附条件批准可用于治疗COVID-19的小分子抗病毒药物包括:奈玛特韦片和利托那韦片组合包装、莫诺拉韦胶囊和阿兹夫定片,适用人群为发病 5 d以内的轻、中型且伴有进展为重症高风险因素的成年患者,目前我国尚未批准上述药物可用于18岁以下青少年和儿童。使用人群、适应证以及其他获批可用于治疗COVID-19小分子抗病毒药物根据NMPA官方发布调整。
奈玛特韦片和利托那韦片组合包装在美国、日本等国已获批可用于发病5 d以内的轻、中型且伴有进展为重症高风险因素的12~17岁青少年患者(体重>40 kg)。用法:奈玛特韦 300 mg 与利托那韦 100 mg 同时服用,每12 小时 1 次,连续服用 5 d。使用前应详细阅读说明书。
10.4.3 单克隆抗体[4,67] 安巴韦单抗/罗米司韦单抗注射液联合应用可用于治疗轻/中型且伴有进展为重型高风险因素的成人和青少年(12~17 岁,体质量≥40 kg)患者。使用人群和适应证根据NMPA官方发布调整。用法:二药的剂量分别为1 000 mg,在给药前两种药品分别以100 mL生理盐水稀释后,经静脉序贯输注给药,静脉滴注速度不高于4 mL/min,之间使用生理盐水100 mL冲管。输注期间需对患者进行临床监测,并在输注完成后对患者进行至少1 h的观察。
10.4.4 COVID-19免疫球蛋白[4-5,35] 仅限用于病程早期有高危因素、病毒载量较高、病情进展较快的患者。使用剂量为100~400 mg/kg,静脉输注,根据患者病情改善情况,次日可再次输注,总次数不超过5次。
10.4.5 康复者恢复期血浆[4-5] 仅用于在病程早期用于有高危因素、病毒载量较高、病情进展较快的患儿。输注剂量为200~500 mL(4~5 mL/kg),可根据患者个体情况及病毒载量等决定是否再次输注。
10.5 抗菌药物[4-5,35] 合理使用抗菌药物,尤其要避免广谱抗菌药物联合使用。高度怀疑有继发细菌感染者,建议尽早根据当地细菌感染病原谱分布特点经验性选择抗菌药物,或根据细菌培养药敏结果应用相应敏感的抗菌药物治疗。
10.6 重症和危重症病例的治疗[4-5,35,68-72] 在对症治疗的基础上,积极防治并发症,治疗基础疾病,预防继发感染,及时进行器官功能支持。
10.6.1 呼吸支持 无创机械通气2 h病情无改善,或患儿不能耐受无创通气、气道分泌物增多、剧烈咳嗽,或血流动力学不稳定,应及时改为有创机械通气。有创机械通气采取小潮气量“肺保护性通气策略”,以降低呼吸机相关肺损伤。俯卧位通气是公认有效的呼吸支持措施,无论是鼻导管吸氧、经鼻高流量、无创呼吸支持还是有创呼吸支持,都应尽可能给予俯卧位通气,每天至少12 h。必要时采取肺复张或体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)等。
10.6.2 循环支持 危重型患儿合并休克,应在充分液体复苏的基础上,改善微循环,合理使用血管活性药物,必要时进行血流动力学监测。
10.6.3 糖皮质激素 糖皮质激素使用须严格掌握适应证,对于氧合指数进行性恶化、影像学进展迅速、机体炎症反应过度激活状态的重症和危重症患儿,可酌情短期使用(3~5 d)。可选择甲泼尼龙1~2 mg/(kg? •d),静脉注射,或地塞米松0.2~0.4 mg/(kg•d)(最大剂量不超过6 mg),静脉注射,1次/d。应避免长时间、大剂量使用糖皮质激素,尽可能减少不良反应。
10.6.4 抗凝治疗 评估患儿发生静脉血栓的危险因素,有危险因素者给予预防性抗凝治疗,同时监测凝血功能,有D-二聚体显著增高或血栓形成的高风险患儿可以使用抗凝治疗,首选低分子肝素。
10.6.5 IL-6抑制剂 对于重型、危重型且实验室检测IL-6 水平明显升高者可试用托珠单抗。用法:首次剂量 4~8 mg/kg,推荐剂量 400 mg,生理盐水稀释至 100 mL,输注时间> 1 h;首次用药疗效不佳者,可在首剂应用12 h后追加应用 1 次(剂量同前),累计给药次数最多为2次,单次最大剂量不超过 800 mg。注意过敏反应,有结核等活动性感染者禁用。
10.6.6 儿童支气管肺泡灌洗或钳取等支气管镜介入治疗 重症、危重症病例明确有各级气道内阻塞时,在三级防护措施下可酌情及时实施儿童支气管镜检查和支气管肺泡灌洗及钳取等介入治疗。
10.6.7 血液净化治疗 血液净化系统包括血浆置换、吸附、灌流、血液/血浆滤过等,建议仅在有急性肾损伤、严重代谢性酸中毒等指征时应用,或用于重型、危重型患儿炎症因子风暴早中期的救治。
10.7 严重并发症的救治要点
10.7.1 COVID-19相关脑病、ANE[4,35,45-46] 应积极控制体温,给予甘露醇等降颅压及镇静、止惊治疗;病情进展迅速者及时气管插管机械通气;尽早给予大剂量甲泼尼龙20~30 mg/ (kg? d)(最大剂量不超过1 000 mg/d)冲击治疗,连用3 d,随后根据病情逐渐减量;丙种球蛋白(IVIG)静脉注射,总量2 g/kg,分1~2 d给予。IL-6明显升高或其他实验室指标提示炎症因子风暴者,酌情选用血液净化、托珠单抗,不能除外代谢相关脑病时可采用改善线粒体代谢的鸡尾酒疗法(维生素B1、维生素B6、左卡尼汀等)。至于COVID-19相关脑炎、脑膜炎、吉兰-巴雷综合征等治疗原则与其他病因引起的相关疾病相同。
10.7.2 暴发性心肌炎[73-74] 严密监护评估血流动力学状态,维护血流动力学稳定和脏器功能,积极营养和保护心肌,加用免疫抑制治疗。可给予甲泼尼龙1~2 mg/(kg?d)和IVIG 2 g/kg治疗。若出现急性心力衰竭,加用正性肌力药、利尿剂和血管扩张剂。出现心动过缓或完全房室传导阻滞时,使用阿托品或异丙肾上腺素。出现室性心动过速或室颤者首选电击复律,药物复律可选用胺碘酮。必要时安装心脏临时起搏器或行ECMO治疗。
10.7.3 MIS-C[4-5,23,75-77] 治疗原则:在对症支持治疗的基础上尽早抗炎、纠正休克和脏器功能支持。
对于满足MIS-C诊断标准的患儿,首选IVIG 2 g/kg 和甲泼尼龙 1~2 mg/(kg?d)治疗;若无好转或加重,建议使用大剂量甲泼尼龙20~30 mg/(kg? d)冲击治疗,或加用TNF-α阻滞剂(英夫利昔单抗)等免疫治疗。对于同时满足MIS-C和川崎病标准的患者,在川崎病标准治疗基础上可加用糖皮质激素治疗。
血小板计数明显升高者,建议酌情加用低剂量阿司匹林治疗 [3~5 mg/(kg?d),最大剂量≤81 mg/ d],直至血小板计数和冠状动脉均恢复至正常。但对于有活动性出血或严重出血风险或血小板计数≤80×109/L的MIS-C患儿则避免使用,以免加重出血风险。
10.7.4 急性肾损伤[78-79] 危重型病例可合并急性肾损伤,应积极寻找病因,如低灌注和药物等因素。在积极纠正病因的同时,注意维持水、电解质、酸碱平衡。可选择连续性肾替代治疗(CRRT),使用指征包括:(1)高钾血症;(2)严重酸中毒;(3)利尿剂无效的肺水肿或水负荷过多。
10.8 精神心理治疗[4-5] 如果患儿(尤其是年长儿)出现情绪不稳、紧张恐惧、焦虑抑郁或有其他心理障碍时,需要积极予以心理干预及心理行为治疗。治疗方法主要包括:心理危机干预、认知行为治疗、催眠疗法,必要时可考虑使用抗焦虑或抗抑郁药物等。
10.9 中医治疗[4-5] 儿童患者的中医证候特点、核心病机与成人基本一致,可参照国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第十版)》,结合儿童患者临床症候和生理特点,辨证酌量使用。
出院标准[4-5,80]
病情明显好转,生命体征平稳,体温正常超过24 h,肺部影像学显示急性渗出性病变明显改善,可以转为口服药物治疗,没有需要进一步处理的并发症等情况时,可考虑出院。
预防[81-85]
12.1 特异性预防 疫苗接种依然是预防病毒感染、降低感染后重症率和死亡率的有效方法。根据靶点和技术的不同,目前已上市的SARS-CoV-2疫苗分有灭活疫苗、核酸疫苗、病毒载体疫苗、蛋白亚单位疫苗等,灭活疫苗和蛋白亚单位疫苗安全性相对较高。对于Omicron变异株而言,目前已公布有效性的SARS-CoV-2疫苗的保护效力还需要进一步验证。SARS-CoV-2疫苗的不良反应主要为注射部位疼痛、红肿,疲乏以及发热等。
灭活疫苗已在我国3岁及以上儿童中广泛接种。确诊SARS-CoV-2感染的患儿在感染后6个月内不建议接种SARS-CoV-2疫苗,在感染6个月后可考虑进行加强针的接种,可不限于同一个疫苗产品。暂不推荐SARS-CoV-2疫苗与其他疫苗同时接种,其他疫苗与新冠病毒疫苗的接种间隔应>14 d。当因动物致伤、外伤等原因需接种狂犬病疫苗、破伤风疫苗、免疫球蛋白时,可不考虑与新冠病毒疫苗的接种间隔予以紧急接种。
12.2 非药物干预措施(non-pharmaceutical interventions,NPIs) 呼吸道病毒感染的NPIs是指通过个人防护措施、环境消毒及社会政策等方式减少病毒传播,降低病毒感染率,延迟感染高峰,缩小感染范围以及控制疾病流行范围。目前临床研究及实践证实,NPIs可为儿童提供有效防护,已成为儿童预防SARS-CoV-2感染的重要手段。适用于儿童NPIs的方式包括:(1)2岁以上儿童佩戴医用外科口罩,高危儿童可选用医用防护口罩;(2)正确执行手卫生,推荐儿童使用皂液和流动水洗手;(3)保持社交距离,必要时进行隔离;(4)居室保持良好的通风换气,相关物品做好清洁和消毒。
12.3 增强免疫力,保护易感人群 均衡膳食、充足睡眠、保持口腔健康、适量运动、作息规律、避免过度疲劳,提高儿童自身免疫力是预防感染的重要手段。积极保持情绪稳定和心理健康。若产妇确诊或疑似感染,建议新生儿与产妇及时分开隔离,并由专科医师做好新生儿评估,尽可能保证母乳喂养。
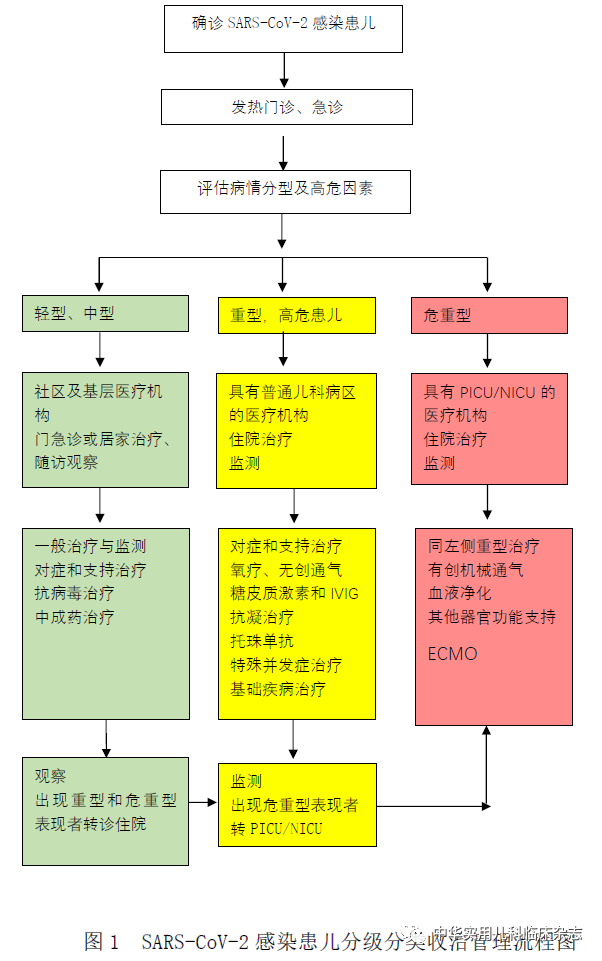
分级分类收治管理流程
各级医疗机构的发热门诊或急诊如接诊到疑似或确诊SARS-CoV-2感染的患儿,应根据患儿病情进行分级分类收治,轻型或中型患儿,可以在门急诊治疗观察或居家对症治疗观察;对于重型和危重型患儿或存在发生重型/危重型的高危患儿,应及时收治到相应医疗机构住院治疗。
根据患儿病情和各级医疗机构救治条件和诊疗水平,提出分级分类收治管理流程如下(图1)。
参考文献
[1] World Health Organization. Weekly epidemiological update on COVID-19 - 4 January 2023[EB/OL]. (2023-01-04)[2023-01-12]. https://www.who.int/publications/m/item/weekly-epidemiological-update-on-covid-19---4-january-2023.
[2] 中国疾病预防控制中心.关于BQ.1,你需要知道的几件事[EB/OL]. (2022-12-13) [2023-01-05].https://www.chinacdc.cn/yyrdgz/202212/t20221213_263008.html.
Chinese Center for Disease Control and Prevention.A few things you need to know about the BQ.1[EB/OL]. (2022-12-13) [2023-01-05]. https://www.chinacdc.cn/yyrdgz/202212/t20221213_263008.html.
[3] 马晓伟.国务院关于儿童健康促进工作情况的报告[EB/OL].(2022-06-22)[2023-01-06]http://www.npc.gov.cn/npc/c30834/202206/3442472183a94b29a3edd6a1cf978aa1.shtml.
[4] 中华人民共和国国家卫生健康委员会. 新型冠状病毒感染诊疗方案(试行第十版)[EB/OL]. (2023-01-05)[2023-01-06]. http://www.nhc.gov.cn/ylyjs/pqt/202301/32de5b2ff9bf4eaa88e75bdf7223a65a/files/02ec13aadff048ffae22759 3a6363ee8.pdf.
National Health Commission of the People’s Republic of China. Diagnosis and treatment plan of SARS-CoV-2
Infection (Trial Version 10) [EB/OL].(2023-01-05)[2023-01-06]. http://www.nhc.gov.cn/ylyjs/pqt/202301/32de5b2ff9bf4eaa88e75bdf7223a65a/files/02ec13aadff048ffae22759 3a6363ee8.pdf.
[5] 蒋荣猛, 谢正德, 姜毅, 等. 儿童新型冠状病毒感染诊断、治疗和预防专家共识(第四版)[J]. 中华实用儿科临床杂志, 2022,37(14):1053-1065. DOI: 10.3760/cma.j.cn101070-20220610-00698.
Jiang RM, Xie ZD, Jiang Y,et al. Diagnosis, treatment and prevention of severe acute respiratory syndrome coronavirus 2 infection in children: experts′ consensus statement (Fourth Edition)[J].Chin J Appl Clin Pediatr, 2022, 37(14): 1053-1065. DOI: 10.3760/cma.j.cn101070-20220610-00698.
[6] Desingu PA, Nagarajan K. Omicron BA.2 lineage spreads in clusters and is concentrated in Denmark[J]. J Med Virol, 2022, 94(6): 2360-2364.DOI:10.1002/jmv.27659.
[7] World Health Organization. WHO Director-General′s opening remarks at the WHO press conference-13 April 2022[EB/OL]. (2022-04-13)[2023-01-05]. https://www.who.int/director-general/speeches/detail/3.
[8]UK Health Security Agency. COVID-19 variants identified in the UK – latest updates[EB/OL]. (2022-10-28)[2023-01-05]. https://www.gov.uk/government/news/covid-19-variants-identified-in-the-uk-latest-updates.
[9] Global Virus Network. COVID-19 variants and vaccines.[EB/OL].[2021-06-21].https://gvn.org/covid-19-variants-and-vaccines.
[10] Wang Q, Guo Y, Iketani S, et al. Antibody evasion by SARS-CoV-2 Omicron subvariants BA.2.12.1, BA.4 and BA.5[J].Nature,2022,608(7923):603-608.DOI: 10.1038/s41586-022-05053-w.
[11 ] Aboubakr HA, Sharafeldin TA, Goyal SM. Stability of SARS-CoV-2 and other coronaviruses in the environment and on common touch surfaces and the influence of climatic conditions: a review[J]. Transbound Emerg Dis, 2021, 68(2): 296-312.DOI:10.1111/tbed.13707.
[12] Ren SY, Wang WB, Hao YG, et al. Stability and infectivity of coronaviruses in inanimate environments[J]. World J Clin Cases, 2020, 8(8): 1391-1399.DOI:10.12998/wjcc.v8.i8.1391.
[13 ] van Doremalen N, Bushmaker T, Morris DH, et al. Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1[J]. N Engl J Med, 2020, 382(16): 1564-1567.DOI:10.1056/NEJMc2004973.
[14] Hirose R, Itoh Y, Ikegaya H, et al. Differences in environmental stability among SARS-CoV-2 variants of concern: both omicron BA.1 and BA.2 have higher stability[J]. Clin Microbiol Infect,2022,28(11):1486-1491.DOI: 10.1016/j.cmi.2022.05.020.
[15] Markus H, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor[J]. Cell, 2020, 181(2): 271-280.e8.DOI:10.1016/j.cell.2020.02.052.
[16] Sardu C, Gambardella J, Morelli MB, et al. Hypertension, thrombosis, kidney failure, and diabetes: is COVID-19 an endothelial disease? a comprehensive evaluation of clinical and basic evidence[J]. J Clin Med, 2020, 9(5): 1417.DOI:10.3390/jcm9051417. [17] Ren X, Wen W, Fan X, et al. COVID-19 immune features revealed by a large-scale single-cell transcriptome atlas[J]. Cell,2021,184(7):1895-1913.e19.DOI: 10.1016/j.cell.2021.01.053.
[18] Hu B, Chan JF, Liu H, et al. Spike mutations contributing to the altered entry preference of SARS-CoV-2 omicron BA.1 and BA.2[J]. Emerg Microbes Infect,2022,11(1): 2275-2287.
[19] Meng B, Abdullahi A, Ferreira IATM, et al. Altered TMPRSS2 usage by SARS-CoV-2 Omicron impacts infectivity and fusogenicity[J].Nature,2022,603 (7902) :706-714.DOI: 10.1038/s41586-022-04474-x.
[20] Machado-Curbelo C, Gutiérrez-Gil J, González-Quevedo A. A Shift in SARS-CoV-2 Omicron Variant’s Entry Pathway Might Explain Different Clinical Outcomes[J].MEDICC Rev,2022, 24(3-4): 68-71.DOI: 10.37757/mr2022.v24.n3-4.10.
[21] Li H, Liu L, Zhang D, et al. SARS-CoV-2 and viral sepsis: observations and hypotheses[J].Lancet,2020,395(10235):1517-1520.DOI:10.1016/S0140-6736(20)30920-X.
[22] Chi H, Chang L, Chao YC, et al. Pathogenesis and Preventive Tactics of Immune-Mediated Non-Pulmonary COVID-19 in Children and Beyond[J].Int J Mol Sci,2022,23(22):14157.DOI: 10.3390/ijms232214157.
[23] American Academy of Pediatrics.What is the case definition of multisystem inflammatory syndrome in children (MIS-C)?[EB/OL].(2022-10-06)[2023-01-06].https://www.aap.org/en/pages/2019-novel-coronavirus-covid-19-infections/clinical-guidance/multisystem-inflammatory-syndrome-in-children-mis-c-interim-guidance.
[24] Zhang Q, Bastard P, Liu Z, et al. Inborn errors of type I IFN immunity in patients with life-threatening COVID-19[J]. Science, 2020, 370(6515): eabd4570.DOI:10.1126/science.abd4570.
[25] Bastard P, Gervais A, Le VT, et al. Autoantibodies neutralizing type I IFNs are present in -4% of uninfected individuals over 70 years old and account for -20% of COVID-19 deaths[J]. Sci Immunol, 2021, 6(62): eabl4340.DOI:10.1126/sciimmunol.abl4340.
[26] Deshmukh V, Motwani R, Kumar A, et al. Histopathological observations in COVID-19: a systematic review[J]. J Clin Pathol, 2021, 74(2): 76-83.DOI:10.1136/jclinpath-2020-206995.
[27] Calabrese F, Pezzuto F, Fortarezza F, et al. Pulmonary pathology and COVID-19: lessons from autopsy. The experience of European Pulmonary Pathologists[J]. Virchows Arch, 2020, 477(3): 359-372.DOI:10.1007/s00428-020-02886-6.
[28] Wiersinga WJ, Rhodes A, Cheng AC, et al. Pathophysiology, transmission, diagnosis, and treatment of coronavirus disease 2019 (COVID-19): a review[J]. JAMA, 2020, 324(8): 782-793.DOI:10.1001/jama.2020.12839.
[29] Menger J, Apostolidou S, Edler C, et al. Fatal outcome of SARS-CoV-2 infection (B1.1.7) in a 4-year-old child[J]. Int J Legal Med, 2022, 136(1): 189-192.DOI:10.1007/s00414-021-02687-9.
[30] Nomura E, Finn LS, Bauer A, et al. Pathology findings in pediatric patients with COVID-19 and kidney dysfunction[J].Pediatr Nephrol,2022,(2022-02-15) [2022-05-25]. https://pubmed.ncbi.nlm.nih.gov/35166918.DOI: 10.1007/s00467-022-05457-w. [published online ahead of print].
[31] Gomes I, Karmirian K, Oliveira JT, et al. SARS-CoV-2 infection of the central nervous system in a 14-month-old child: a case report of a complete autopsy[J]. Lancet Reg Health Am,2021,2:100046.DOI: 10.1016/j.lana.2021.100046.
[32]Duarte-Neto AN, Caldini EG, Gomes-Gouvêa MS, et sl. An autopsy study of the spectrum of severe COVID-19 in children: From SARS to different phenotypes of MIS-C[J].EClinicalMedicine,2021,35:100850. DOI: 10.1016/j.eclinm.2021.100850.
[33] Goussard P, Schubert P, Parker N, et al. Fatal SARS-CoV-2 Omicron variant in a young infant: autopsy findings[J]. Pediatr Pulmonol,2022,57(5):1363-1365.DOI: 10.1002/ppul.25881
[34] 季涛云,姜玉武. 重视儿童新型冠状病毒感染的神经系统受累及其防治[J/OL]. 中华儿科杂志,2022,61:网络预发表. DOI:10.3760/cma.j.cn112140-20221217-01053.
[35] 国家儿童医学中心, 首都医科大学附属北京儿童医院, 新型冠状病毒感染重症救治专家组, 等. 儿童新型冠状病毒感染重症早期识别和诊治建议[J]. 中华儿科杂志, 2023(61):网络预发表. DOI: 10.3760/cma.j.cn112140-20221228-01069.
Expert Group on Intensive Care for SARS-CoV-2 Infection, Beijing Children′s Hospital, Capital Medical University, National Center for Children′s Health,et al..Recommendations for early identification, diagnosis and treatment of severe SARS-CoV-2 infection in children[J]. Chin J Pediatr, 2023(61):Epub ahead of print. DOI:10.3760/cma.j.cn112140-20221228-01069
[36] Liguoro I, Pilotto C, Bonanni M, et al. SARS-COV-2 infection in children and newborns: a systematic review[J]. Eur J Pediatr, 2020, 179(7): 1029-1046.DOI:10.1007/s00431-020-03684-7.
[37] Henderson LA, Canna SW, Friedman KG, et al. American college of rheumatology clinical guidance for multisystem inflammatory syndrome in children associated with SARS-CoV-2 and hyperinflammation in pediatric COVID-19: version 3[J]. Arthritis Rheumatol, 2022, 74(4): e1-e20.DOI:10.1002/art.42062.
[38] Scohy A, Anantharajah A, Bodéus M, et al. Low performance of rapid antigen detection test as frontline testing for COVID-19 diagnosis[J]. J Clin Virol, 2020, 129: 104455.DOI:10.1016/j.jcv.2020.104455.
[39] 中华医学会放射学分会.新型冠状病毒肺炎的放射学诊断:中华医学会放射学分会专家推荐意见(第1版) [J].中华放射学杂志,2020,54(4):279-285.DOI:10.3760/cma.j.cn112149-20200205-00094.
Chinese Society of Radiology, Chinese Medical Association.Radiological diagnosis of COVID-19:expert recommendation from the Chinese Society of Radiology (First edition) [J].Chin J Radiol,2020,54(4): 279-285.DOI:10.3760/cma.j.cn112149-20200205-00094
[40] 马慧静,邵剑波,王永姣,等.新型冠状病毒肺炎儿童高分辨率CT表现[J].中华放射学杂志,2020, 54(4):310-313.DOI:10.3760/cma.j.cn112149-20200206-00100.
Ma HJ, Shao JB, Wang YJ,et al.High resolution CT features of COVID-19 in children[J].Chin J Radiol,2020, 54(4):310-313.DOI:10.3760/cma.j.cn112149-20200206-00100.
[41] Ma H, Hu J, Tian J, et al. A single-center, retrospective study of COVID-19 features in children: a descriptive investigation[J]. BMC Med, 2020, 18(1): 123.DOI:10.1186/s12916-020-01596-9.
[42] Peng X, Guo Y, Xiao H, et al. Overview of chest involvement at computed tomography in children with coronavirus disease 2019 (COVID-19)[J]. Pediatr Radiol, 2021, 51(2): 222-230.DOI:10.1007/s00247-020-04826-7.
[43] Akl EA, Bla?i? I, Yaacoub S, et al. Use of chest imaging in the diagnosis and management of COVID-19: a WHO rapid advice guide[J]. Radiology, 2021, 298(2): E63-E69.DOI:10.1148/radiol.2020203173.
[44] Rubin GD, Ryerson CJ, Haramati LB, et al. The Role of Chest Imaging in Patient Management during the COVID-19 Pandemic: A Multinational Consensus Statement from the Fleischner Society[J]. RADIOLOGY, 2020,296(1):172-180.
[45] Afshar-Oromieh A, Prosch H, Schaefer-Prokop C, et al. A comprehensive review of imaging findings in COVID-19 - status in early 2021[J]. Eur J Nucl Med Mol Imaging, 2021, 48(8): 2500-2524.DOI:10.1007/s00259-021-05375-3.
[46] Shen K, Yang Y, Wang T, et al. Diagnosis, treatment, and prevention of 2019 novel coronavirus infection in children: experts’ consensus statement[J]. World J Pediatr, 2020, 16(3):223-231.DOI:10.1007/s12519-020-00343-7.
[47] Woodruff RC, Campbell AP, Taylor CA, et al. Risk Factors for Severe COVID-19 in Children[J]. Pediatrics, 2022,149(1):e2021053418. DOI:10.1542/peds.2021-053418.
[48] Centers for Disease Control and Prevention. Severity and Underlying Medical Conditions: Information for Healthcare Professionals [EB/OL]. (2022-10-19)[2023-01-05]. https://www.cdc.gov/coronavirus/2019-ncov/hcp/pediatric-hcp.html#severity-underlying-medical-conditions.
[49] Kompaniyets L, Agathis NT, Nelson JM, et al. Underlying medical conditions associated with severe COVID-19 illness among children[J]. JAMA Netw Open, 2021, 4(6): e2111182.DOI:10.1001/jamanetworkopen.2021.11182.
[50] Wanga V, Gerdes ME, Shi DS, et al. Characteristics and clinical outcomes of children and adolescents aged <18 years hospitalized with COVID-19 - six hospitals, United States, July-August 2021[J]. MMWR Morb Mortal Wkly Rep, 2021, 70(5152): 1766-1772.DOI:10.15585/mmwr.mm705152a3.
[51] Nachega JB, Sam-Agudu NA, Machekano RN, et al. Assessment of Clinical Outcomes Among Children and Adolescents Hospitalized With COVID-19 in 6 Sub-Saharan African Countries[J]. JAMA Pediatr, 2022,176(3):e216436. DOI:10.1001/jamapediatrics.2021.6436. [52] Fernandes DM, Oliveira CR, Guerguis S, et al. Severe Acute Respiratory Syndrome Coronavirus 2 Clinical Syndromes and Predictors of Disease Severity in Hospitalized Children and Youth[J]. J Pediatr, 2021,230:23-31.DOI:10.1016/j.jpeds.2020.11.016.
[53] Bailey LC, Razzaghi H, Burrows EK, et al. Assessment of 135?794 pediatric patients tested for severe acute respiratory syndrome coronavirus 2 across the United States[J]. JAMA Pediatr, 2021, 175(2): 176-184.DOI:10.1001/jamapediatrics.2020.5052.
[54] Williams N, Radia T, Harman K, et al. COVID-19 severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection in children and adolescents: a systematic review of critically unwell children and the association with underlying comorbidities[J]. Eur J Pediatr, 2021, 180(3): 689-697.DOI:10.1007/s00431-020-03801-6.
[55] McCormick DW, Richardson LC, Young PR,et al. Deaths in children and adolescents associated with COVID-19 and MIS-C in the United States[J].Pediatrics,2021,148(5):e2021052273.DOI: 10.1542/peds.2021-052273.
[56] Tripathi S, Christison AL, Levy E, et al. The impact of obesity on disease severity and outcomes among hospitalized children with COVID-19[J]. Hosp Pediatr, 2021, 11(11): 297-e316.DOI:10.1542/hpeds.2021-006087.
[57] Zhou B, Yuan Y, Wang S, et al. Risk profiles of severe illness in children with COVID-19: a meta-analysis of individual patients[J]. Pediatr Res, 2021, 90(2): 347-352.DOI:10.1038/s41390-021-01429-2.
[58] Tang L, Gu S, Gong Y, et al. Clinical Significance of the Correlation between Changes in the Major Intestinal Bacteria Species and COVID-19 Severity[J].Engineering (Beijing),2020,6(10):1178-1184.DOI: 10.1016/j.eng.2020.05.013.
[59] 中华医学会临床药学分会.雾化吸入疗法合理用药专家共识(2019年版)[J].医药导报,2019,38(2): 135-146.DOI:10.3870/j.issn.1004-0781.2019.02.001.
Chinese Medical Association Clinical Medicine Association.Expert consensus on rational drug use of aerotom inhalation therapy (2019 edition) [J].Medical Guide,2019,38(2):135-146.DOI: 10.3870/j.issn.1004-0781.2019.02.001.
[60] Shen K, Hong J, El BA, et al. International expert opinion on the use of nebulization for pediatric asthma therapy during the COVID-19 pandemic[J]. J Thorac Dis, 2021, 13(7): 3934-3947.DOI:10.21037/jtd-21-841.
[61] Martens K, Vanhulle E, Viskens A, et al. Fluticasone propionate suppresses the SARS-CoV-2 induced increase in respiratory epithelial permeability in vitro[J].Rhinology,2022,DOI: 10.4193/Rhin22.223. Epub ahead of print. PMID: 36479866.
[62]申昆玲,尚云晓,张贺,等.重组人干扰素α2b喷雾剂(假单胞菌)治疗儿童急性上呼吸道感染有效性 和安全性多中心随机对照临床研究[J].中国实用儿科杂志,2019,34(12):1010-1016.DOI: 10.19538/j.ek2019120610.
Shen KL, Shang YX, Zhang H,et al.A multicenter randomized controlled clinical study on the efficacy and safety of recombinant human interferon α2b spray (P.putida) in treatment of acute upper respiratory tract infections in children[J].Chin J Pract Pediatr,2019,34(12):1010-1016.DOI:10.19538/j.ek2019120610.
[63] 徐艳利, 李颖, 陈益平, 等. 重组人干扰素α2b喷雾剂治疗小儿手足口病有效性和安全性的多中心对照 临床研究 [J] . 中华传染病杂志,2018,36 (2): 101-106. DOI: 10.3760/cma.j.issn.1000-6680.2018.02.008.
Xu YL,Li Y,Chen YP, et al. A multicenter controlled clinical study on the efficacy and safety of recombinant human interferon α2b spray in the treatment of hand, foot and mouth disease in children[J]. Chin J Infect Dis, 2018,36(2): 101-106. DOI: 10.3760/cma.j.issn.1000-6680.2018.02.008.
[64] Ye YZ, Dou YL, Hao JH,et al.Efficacy and safety of interferon α-2b spray for herpangina in children: a randomized, controlled trial[J].Int J Infect Dis,2021,107:62-68.DOI: 10.1016/j.ijid.2021.04.049.
[65] Bhushan BLS, Wanve S, Koradia P, et al. Efficacy and safety of pegylated interferon-alpha2b in moderate COVID-19: a phase 3, randomized, comparator-controlled, open-label study[J]. Int J Infect Dis, 2021,111:281-287.DOI:10.1016/j.ijid.2021.08.044
[66] Zhou Q, MacArthur MR, He X, et al. Interferon-alpha2b Treatment for COVID-19 Is Associated with Improvements in Lung Abnormalities[J]. Viruses, 2020,13(1):44. DOI:10.3390/v13010044.
[67] 国家药品监督管理局. 国家药监局应急批准腾盛华创医药技术(北京)有限公司新冠病毒中和抗体联合 治疗药物安巴韦单抗注射液(BRII-196)及罗米司韦单抗注射液(BRII-198)注册申请[EB/OL]. (2021-12-08)[2023-01-05]. http://www.nhc.gov.cn/yzygj/s7653p/202203/acbffef3d9b74d8ba90e43f8ab091512.shtml.
National Medical products Administration. The National Medical products Administration approved the registration application of the novel coronavirus neutralizing antibody combined treatment drugs ambacimivir injection (BRII-196) and romistatin injection (BRII-198) of Tengsheng Huachuang Pharmaceutical Technology (Beijing) Co., Ltd. in an emergency[EB/OL] (2021-12-08)[2023-01-05].
http://www.nhc.gov.cn/yzygj/s7653p/202203/acbffef3d9b74d8ba90e43f8ab091512.shtml
[68] 中华人民共和国国家卫生健康委员会. 新冠肺炎重型、危重型患者护理规范[EB/OL]. (2020-03-30)[2023-01-05]. http://www.nhc.gov.cn/yzygj/s7653p/202003/8235a35f35574ea79cdb7c261b1e666e.shtml.
National Health Commission of the People′s Republic of China.Nursing standards for severe and critically ill patients of coronavirus disease 2019[EB/OL].(2020-03-30)[2023-01-05].http://www.nhc.gov.cn/yzygj/s7653p/202003/8235a35f35574ea79c db7c261b1e666e.shtml.
[69] 中华人民共和国国家卫生健康委员会. 新冠肺炎康复者恢复期血浆临床治疗方案(试行第二版)[EB/OL]. (2020-03-04)[2023-01-05]. http://www.nhc.gov.cn/yzygj/s7658/202003/61d608a7e8bf49fca418a6074c2bf5a2.shtml.
National Health Commission of the People′s Republic of China.Clinical treatment plan for plasma recovery in patients recovering from coronavirus disease 2019 (Trial second edition) [EB/OL].(2020-03-04)[2023-01-05].
http://www.nhc.gov.cn/yzygj/s7658/202003/61d608a7e8bf49fca418a6074c2bf5a2.shtml
[70] 赵建平,胡轶,杜荣辉,等.新型冠状病毒肺炎糖皮质激素使用的建议 [J].中华结核和呼吸杂志,2020, 43 (3):183-184.DOI:10.3760/cma.j.issn.1001-0939.2020.03.008.
Zhao JP, Hu Y, Du RH,et al.Expert consensus on the use of corticosteroid in patients with 2019-nCoV pneumonia[J].Chin J Tuberc Respir Dis,2020,43(3):183-184.DOI: 10.3760/cma.j.issn.1001-0939.2020.03.008.
[71] 李宗儒,高占成,公丕花.重型新型冠状病毒肺炎抗炎治疗的研究进展[J].中国呼吸与危重监护杂志,2021,20(1):64-69.DOI:10.7507/1671-6205.202008079.
Li ZR, Gao ZC, Gong PH.Advances in anti-inflammatory treatment of severe patients with Coronavirus Disease 2019[J].Chin J Respir Crit Care Med,2021,20(1):64-69.DOI:10.7507/1671-6205.202008079
[72] 中国医师协会儿科医师分会内镜专业委员会,中国医师协会内镜医师分会儿童呼吸内


