【Blood Adv】阿替利珠单抗联合R-CHOP治疗初治DLBCL的初步探索
时间:2022-10-31 11:59:59 热度:37.1℃ 作者:网络
R-CHOP方案是目前晚期 DLBCL 的标准一线治疗,尽管标准 R-CHOP 治疗可治愈约60%的 DLBCL 患者,但其余患者会因 R-CHOP 耐药而发生难治性或复发性疾病,且这些患者结局不佳,一线难治 DLBCL 患者中位总生存期 (OS) 仅有半年左右。
与标准R-CHOP相比,将R改为新型抗 CD20 抗体奥妥珠单未改善无进展生存期 (PFS),此外在 R-CHOP 基础上加入多种新型靶向药物(R-CHOP +X),包括来那度胺、硼替佐米和伊布替尼等,与 R-CHOP 相比它们在随机2/3期试验中均未改善结局。一项 polatuzumab vedotin 联合 R-环磷酰胺、多柔比星和泼尼松的 III 期研究中,与 R-CHOP 相比,PFS延长(HR= 0.73,P= 0.02;2年PFS 76.7% vs 70.2%),但仍无 OS 获益。
阿替利珠单抗是一种靶向程序性死亡配体 1(PD-L1) 的人源化免疫球蛋白 G1 单克隆抗体,在多种肿瘤类型和血液恶性肿瘤中显示出良好的抗肿瘤活性。此外临床前研究和1期临床研究表明,靶向治疗和联合PD-1 抑制可带来任一单药均未达到的持久缓解,从而可能增强治疗活性;例如一项抗体帕博利珠单抗联合 R-CHOP 的 I 期研究中,初治 DLBCL 患者的2年 PFS 率为83%。
因此,纪念斯隆凯特琳癌症中心Anas Younes教授等假设,在 R-CHOP 基础上加用阿替利珠单抗 (atezo-R-CHOP)可增强抗肿瘤免疫激活,产生稳健且持久的抗肿瘤反应,有可能改善患者结局。并开展了一项Ib/II期研究,评估atezo-R-CHOP 诱导治疗后 阿替利珠单抗单药巩固治疗在初治 DLBCL 患者中的安全性和疗效,研究结果近日发表于《Blood Advances》。

研究设计
本研究是一项在初治 FL 或 DLBCL 患者中进行的开放标签、非随机、1b/2期研究,包括初始安全性导入期和扩展期;该研究还评估了阿替利珠单抗+奥妥珠单抗+苯达莫司汀(Atezo-G-Benda)和阿替利珠单抗+奥妥珠单抗+CHOP (Atezo-G-CHOP)在滤泡性淋巴瘤 (FL) 患者中的安全性和疗效。本文仅报告了入组扩展期的初治DLBCL患者数据。
该研究入组条件包括年龄≥18岁、既往未经治疗的晚期DLBCL(定义为III 期或 IV 期伴IPI ≥2,或 II 期伴巨大肿瘤)、ECOG为0‒2。
诱导治疗包括:第1-8周期标准R-CHOP 治疗,然后从第2周期开始加入阿替利珠单抗1200 mg静脉 (IV) 给药(每3周一次)。诱导结束 (EOI) 时达到完全缓解 (CR) 的患者在每周期第1天(21天/周期)接受阿替利珠单抗1200 mg IV巩固治疗,持续17个周期。从第2周期开始加用阿替利珠单抗,是为了降低利妥昔单抗首次输注期间输液相关反应 (IRR) 增加的风险,与利妥昔单抗相关的 IRR 的发生率和严重程度随着第二次和后续输注而显著降低。
主要疗效终点是 EOI 时的 CR 率(改良Lugano 2014标准,PET-CT评估),次要疗效终点包括 EOI 时研究者评估的 CR 率(Lugano 2014标准)、IRC和研究者评估的 EOI 时 CR 率(改良 Cheson 2007 版标准)以及 IRC 和研究者评估的 EOI 时客观缓解率 (ORR)(Lugano 2014和改良Cheson 2007)。探索性疗效终点包括OS、PFS和微小残留病 (MRD)(通过二代测序)。
研究结果
患者
共42例 DLBCL 初治患者入组并接受 R-CHOP 治疗,其中2例患者在开始阿替利珠单抗治疗前退出研究。如表1所示,52%的患者年龄≥65岁,62%为男性。大多数患者在诊断时为晚期(Ann Arbor III/IV期:95%),69%为高-中/高 (3-5) IPI 风险组,74%伴结外受累。
7例患者在 EOI 前中止研究治疗(AE,n = 4;PD,n = 1;其他,n= 2);另外4例患者 (9.5%) 在 EOI 时中止 (PD,n= 2;PR,n= 2)。所有31例 CR 患者均开始巩固治疗,其中16例在巩固阶段停药(AE,n= 8;PD,n= 3;医生决定,n= 1;受试者退出,n= 4)。
临床疗效
中位随访32.3个月,中位治疗持续时间为11.1个月。初诊至治疗的中位时间为0.74个月。接受至少一剂阿替利珠单抗的患者在 EOI 时可评价疗效 (N= 40)。EOI 时的临床缓解率见表2。EOI时 IRC 通过 PET-CT 评估的 CR 率(主要疗效终点)(改良Lugano 2014 标准)为77.5%,10.0%的患者达到PR。EOI 时 IRC 评估的 CR 率(Lugano 2014 和改良Cheson 2007)分别为80.0%和77.5%,研究者评估的 CR 率为77.5% (Lugano 2014) 和75.0%(改良Cheson 2007),EOI 时相应的 ORR 范围为87.5%-90.0%。
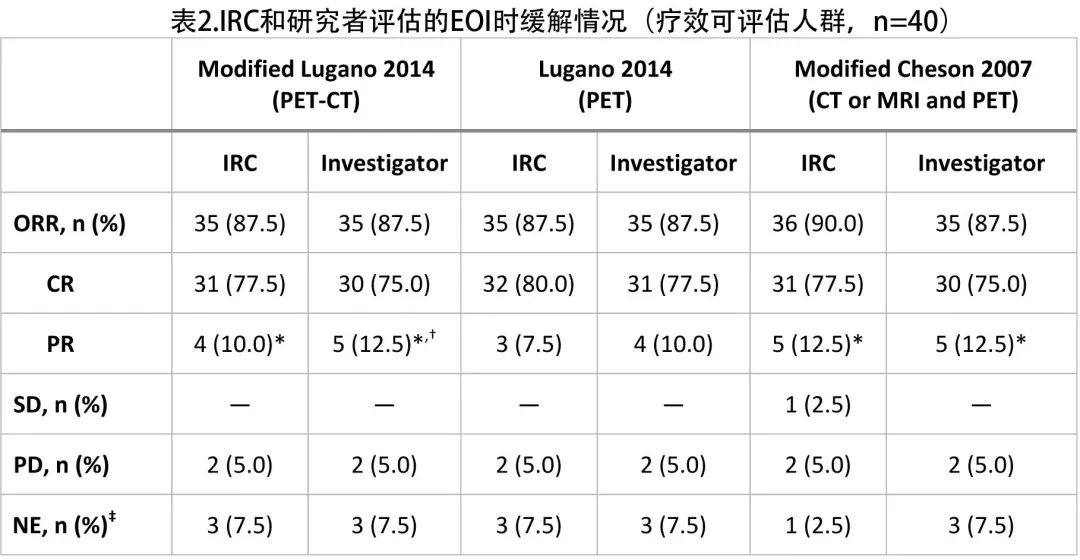
第3年时,研究者评估的 PFS 和 OS 率分别为77.4%和87.2%(图1)。
探索性分析
14/40例患者在 EOI 时 MRD 可评估(基线时阳性且 EOI 时有可用样本),基线时 MRD 阴性是患者在 EOI 时 MRD 不可评价的最常见原因。在 MRD 可评估患者中,13例患者在 EOI 时 MRD 阴性(10-5灵敏度),其中11例 (84.6%) 经研究者和 IRC 评估为CR,1例 (7.7%) 为PR(表3)。EOI时 MRD 阴性的2例患者后来复发。
通过单克隆抗体 SP263 测定的 PD-L1 高表达 (IHC 2-3) 似乎与 EOI 时 CR 率显著改善无关。
安全性
安全性人群 (N= 42) 中所有患者均发生至少一次AE,32例患者 (76.2%) 发生至少一次3-4级AE。诱导治疗期内最常见的3/4级 AE 为中性粒细胞减少 (45.2%) 和发热性中性粒细胞减少 (11.9%)(表4)。共有15例患者 (35.7%) 因 AE 停药,包括6例患者 (14.3%) 在诱导治疗期停药(表4)。导致任何研究治疗中止的最常 (> 5%) 报告 AE 为中性粒细胞减少和脂肪酶升高(各7.1%)。
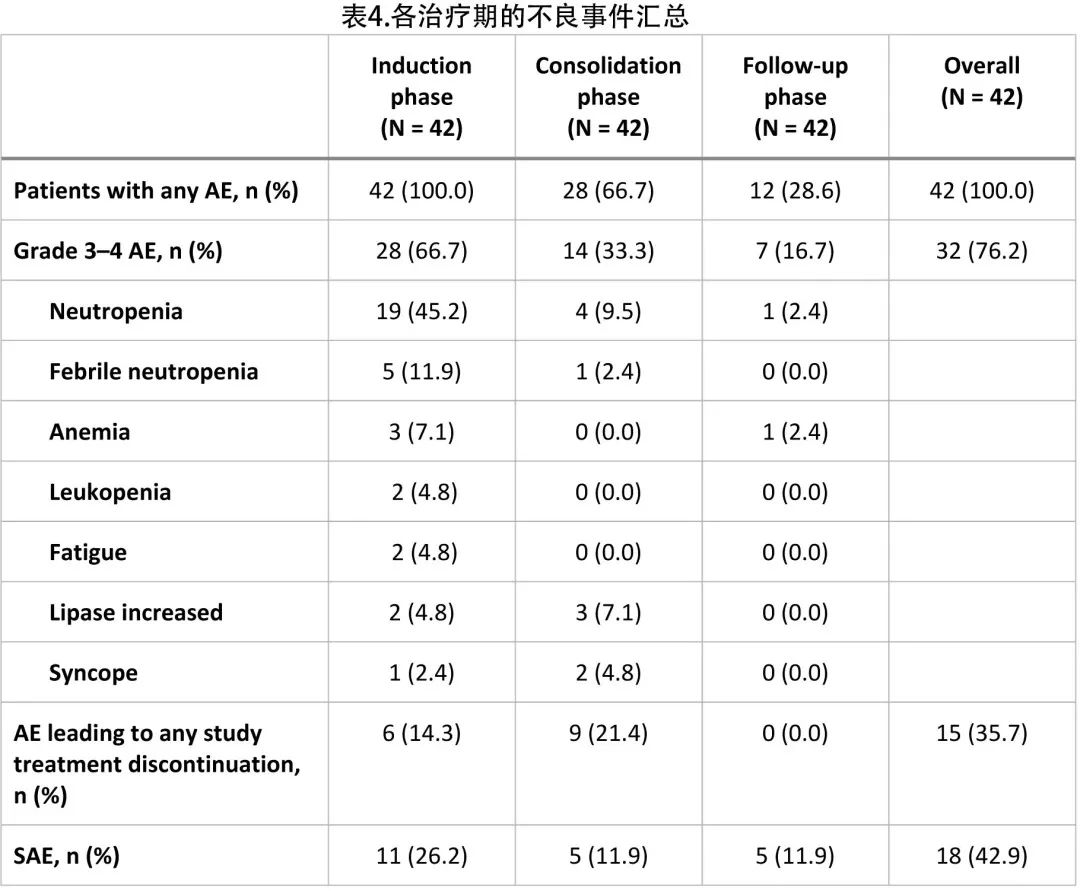
最常见的所有等级 AE 为中性粒细胞减少 (52.4%)、便秘 (42.9%) 和疲乏(40.5%;表5)。
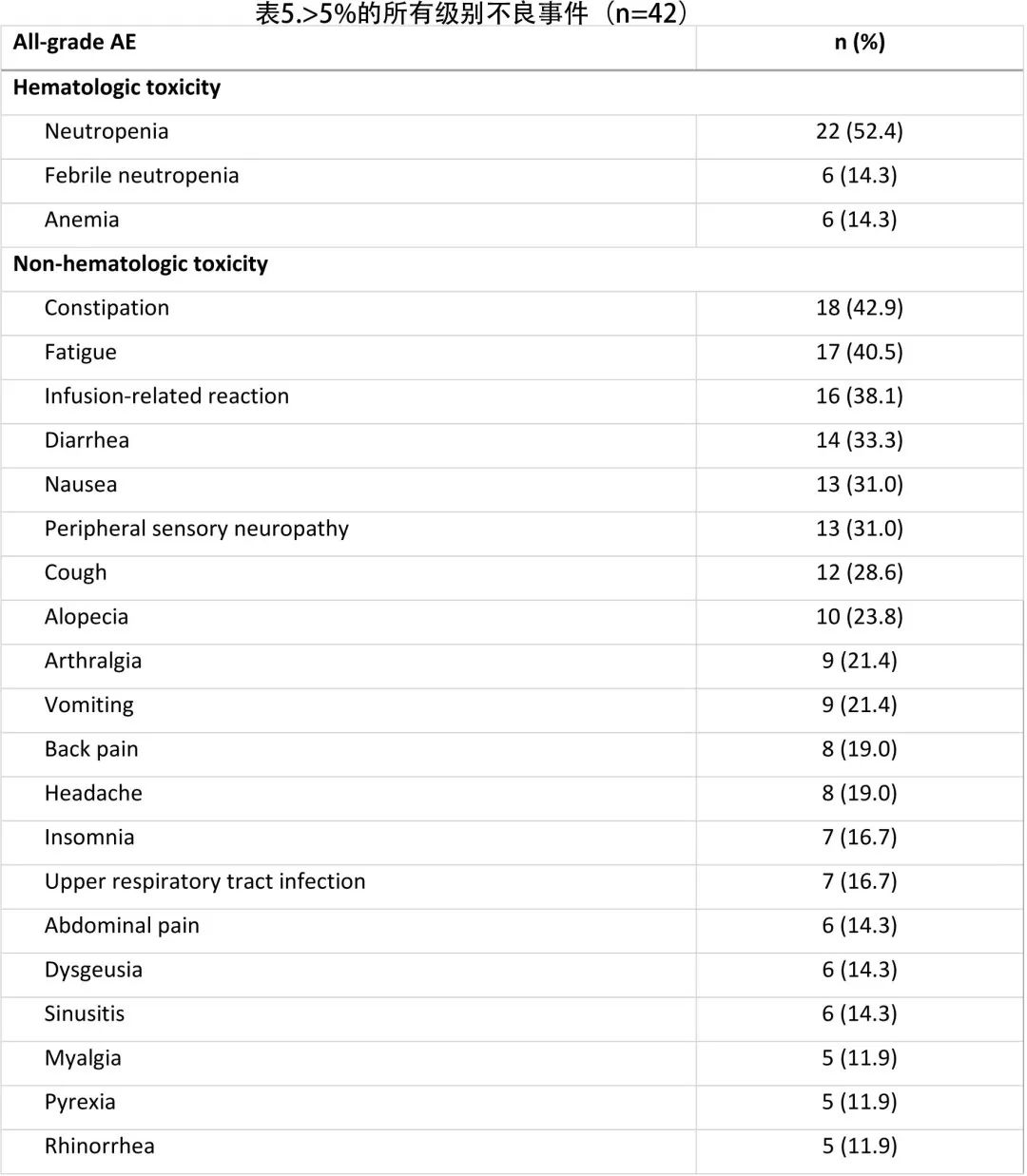
在17例患者 (40.5%) 发生阿替利珠单抗相关的特别关注AE (AESI),大多数事件发生在巩固治疗期间 (28.6%)。最常见的阿替利珠单抗相关AESI 为脂肪酶升高 (9.5%)、淀粉酶升高 (7.1%)、甲状腺功能减退 (7.1%) 和胰腺炎 (4.8%);在报告的17例 AESI 中,大多数事件(65%;包括脂肪酶和淀粉酶升高)在分析时是可逆的(表6)。
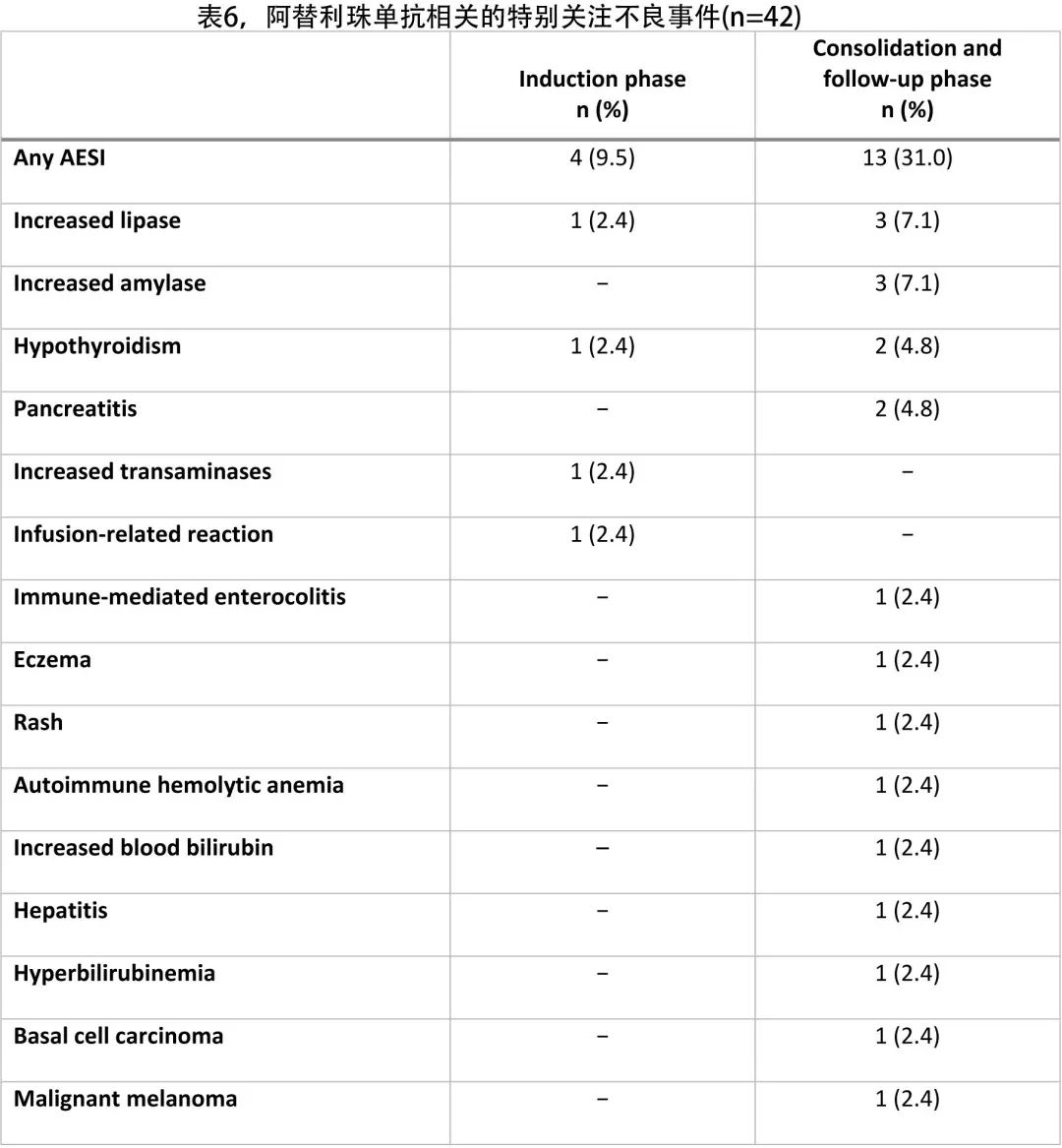
最常见的 SAE 为发热性中性粒细胞减少 (14.3%),最常见的治疗相关 SAE 为发热性中性粒细胞减少 (7.1%)、感染性肺炎 (7.1%) 和IRR(4.8%)。共报告5例死亡 (11.9%),其中4例死亡 (9.5%) 为 PD导致,1例5级事件 (2.4%)为 AE导致(未证实的进行性多灶性白质脑病,与 阿替利珠单抗和利妥昔单抗相关;该患者在发生 AE 时为PR)。
23例患者 (54.8%) 发生导致任何研究治疗给药中断的AE。按系统器官分类,最常 (≥20%) 报告的类别为血液及淋巴系统疾病 (23.8%);导致给药中断的最常 (≥10%) 报告 AE 为中性粒细胞减少 (16.7%) 和外周感觉神经病变 (11.9%)。
结论
对于初治 DLBCL 患者,在 R-CHOP 治疗的基础上加如阿替利珠单抗,EOI 时 PET-CR 率高达77.5%,ORR为87.5%,并且atezo-R-CHOP 联合治疗的总体安全性特征可控。但阿替利珠单抗联合 R-CHOP似乎会引入了通常与 R-CHOP 不相关的AE,而与阿替利珠单抗的已知安全性特征一致,包括淀粉酶和脂肪酶升高、胰腺炎和甲状腺功能减退症。
总的来说,本研究在初治 DLBCL 患者中证实 atezo-R-CHOP 联合治疗可提供持久的临床活性,安全性特征与各药物的已知毒性一致。
参考文献
Anas Younes,et al.Safety and efficacy of atezolizumab with rituximab and CHOP in previously untreated diffuse large B-cell lymphoma.Blood Adv . 2022 Oct 26;bloodadvances.2022008344.
使用小程序
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


