自然·癌症:饿几天,就能增强癌症患者得免疫治疗效果
时间:2020-02-04 10:38:15 热度:37.1℃ 作者:网络
免疫检查点阻断疗法已成为当今最热门的免疫疗法之一,该疗法的出现彻底改变了目前癌症治疗的格局,而PD-1(programmed cell death protein 1)免疫阻断疗法正是其中最典型的代表。
肺癌,又称原发性支气管肺癌,是最常见的肺部原发性恶性肿瘤,根据组织病理学特点的不同可分为非小细胞肺癌和小细胞肺癌。我国2015年统计数据显示,肺癌分别为男性和女性人群恶性肿瘤发病率的第一和第二位,而死亡率均居于首位。
PD-1免疫阻断疗法在非小细胞肺癌(NSCLC)中表现出显著疗效,PD-1/PDL-1重新激活抗原特异性效应T细胞,增强对癌症的免疫反应。然而,它们在很大比例的患者中是无效的,此外,随着时间的推移,一些最初的反应者最终会产生耐药性。这些现象的发生极大地阻碍了PD-1免疫阻断疗法在临床上的应用。
那我们又该如何区克服PD-1免疫阻断疗法的不足呢?免疫系统作为一个复杂精妙的系统,与人体其他系统密切相关,我们能否通过调整人体状态从而规避PD-1免疫阻断疗法无效现象及耐药机制呢?
近日,国际顶尖学术期刊Nature的新创子刊 —— Nature Cancer 发表了一篇有关PD-1免疫阻断疗法的研究论文:Short-term starvation reduces IGF-1 levels to sensitize lung tumors to PD-1 immune checkpoint blockade。
研究由西班牙纳瓦拉大学应用医学研究中心(CIMA)等机构联合完成。该研究表明:短期禁食可以降低机体内胰岛素样生长因子1(IGF-1)水平,增加肺癌对PD-1免疫阻断检查点抑制剂的敏感性。

肿瘤微环境中存在免疫抑制细胞亚群是PD-1免疫阻断疗法的耐药机制之一,如髓源性抑制细胞(MDSCs)、免疫抑制巨噬细胞、调节性T细胞(Treg细胞)和未成熟的树突状细胞等,它们阻止细胞毒性T细胞的浸润和活化。因此,若想克服PD-1耐药现象,应在恢复效应T细胞方面提供实质性的治疗改进。
代谢改变是癌症的一个核心特征。短期禁食(STS)会引起广泛的代谢适应,包括体内激素和生长因子水平的变化,如胰岛素、胰高血糖素、胰岛素样生长因子1(IGF-1)和糖皮质激素等。
正常细胞在机体短期禁食状态下会减缓细胞分裂速度,并重新编程其代谢和能量需求,从而应对营养压力。
与之相反,肿瘤细胞在控制这种代谢转换方面存在困难,因此大量的研究事实表明短期禁食能增强肿瘤组织对化疗的敏感性。值得注意的是,禁食状态和化疗之间的协同作用似乎依赖于抗肿瘤免疫反应。基于此,Daniel Ajona等对STS是否能增强PD-1免疫阻断疗法的疗效进行研究。
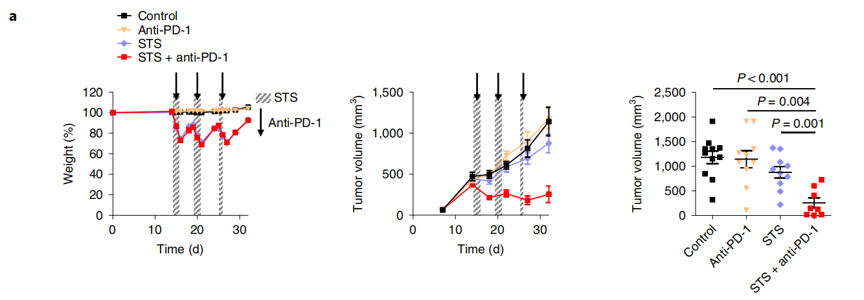
研究人员在三种临床前肺癌模型中证明STS与PD-1阻断剂协同作用可以有效抑制肺癌的进展和转移。这种协同的抗肿瘤活性与循环系统中IGF-1的减少和肿瘤细胞中IGF-1受体(IGF-1R)信号的下调有关。联合使用IGF-1R抑制剂和PD-1免疫检查点阻断剂可协同减少小鼠肺癌模型中肿瘤的生长。
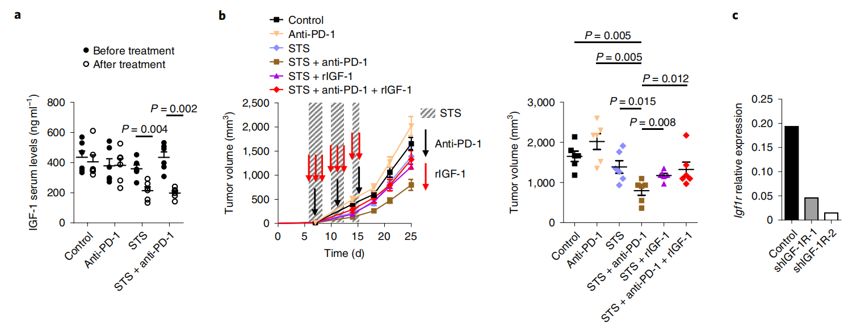
有趣的是,这种协同作用需要CD8 T细胞的参与,提高肿瘤内CD8/Treg细胞的比值,可以增强抗肿瘤特异性免疫作用。此外,研究者表明在非小细胞肺癌患者中,血浆IGF-1高水平或肿瘤组织IGF-1R高表达与抗PD-1/PDL-1免疫治疗的耐药性产生相关。因此,临床上可通过联合IGF-1R抑制剂和PD-1阻断剂从而克服PD-1免疫疗法的耐药现象。
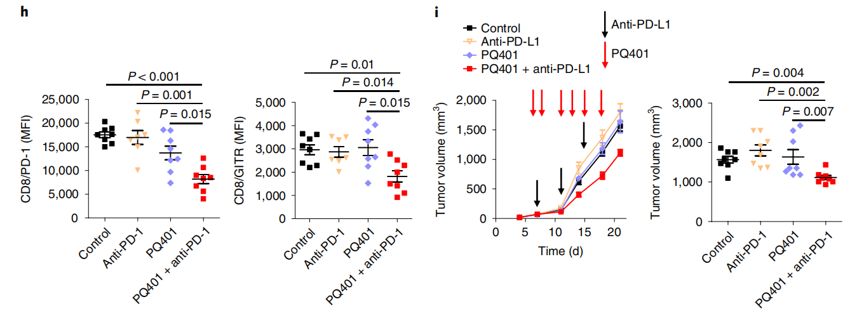
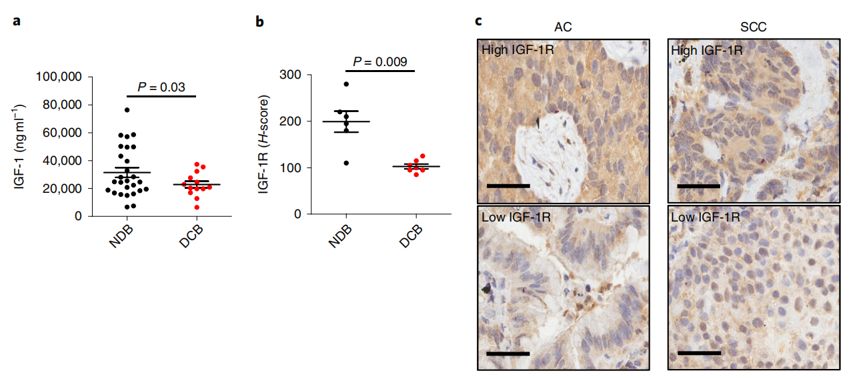
总的来说,本研究在细胞水平和小鼠模型上证实了短期禁食可以降低机体内胰岛素样生长因子1(IGF-1)水平,增加肺癌对PD-1免疫阻断检查点抑制剂的敏感性。
这一研究结果为临床治疗非小细胞肺癌提供了新思路——IGF-1R抑制剂和PD-1阻断剂联合用药。除此之外,IGF-1R在患者肺癌组织上的表达水平也可以作为预测患者预后的标志物(过表达→预后差),同时IGF-1通路也可以应用于预测肺癌患者对抗PD-1/PDL-1免疫治疗的效应。
肿瘤治愈是现代医学急需攻克的难题,而免疫治疗是彻底克服癌症和肿瘤的曙光!希望在广大生命科学及医学工作者的努力下,共筑“无癌”新世界!
论文链接:
https://doi.org/10.1038/s43018-019-0007-9


