Nature Genetics:林东昕/郑健团队等首次揭示RNA甲基化可调控DNA甲基化
时间:2022-10-20 20:59:19 热度:37.1℃ 作者:网络
人类细胞的基因表达调控十分复杂而且严密,但又受许多因素的影响。基因表达紊乱可导致许多疾病包括癌症。影响基因表达最重要的因素之一是表观遗传修饰(epigenetic modification),如DNA甲基化修饰、组蛋白乙酰化修饰等。
DNA甲基化修饰改变引起的基因表达改变在肿瘤的发生发展中起重要作用。例如,癌细胞基因组常常有癌基因的低甲基化和抑癌基因的高甲基化改变,但DNA甲基化改变的机制目前并不完全清楚。除了DNA甲基化,基因转录产物RNA也可以被甲基化修饰。
目前知道的最普遍的RNA甲基化修饰是甲基腺嘌呤N6甲基化(m6A)。mRNA的m6A修饰会影响mRNA本身的稳定性及其翻译成蛋白质的效率;最近的研究也表明RNA-m6A修饰还可逆向影响染色质重塑和组蛋白修饰等。
近日,中山大学肿瘤防治中心林东昕/郑健实验室联合美国希望城国家医疗中心贝克曼研究所陈建军教授,在 Nature Genetics 期刊上发表了题为:RNA m6A regulates transcription via DNA demethylation and chromatin accessibility 的研究论文。
该研究发现,RNA在转录过程中的m6A修饰可直接使邻近的DNA去甲基化,从而使染色质可及性及所在基因表达增加。该研究首次揭示RNA甲基化可调控DNA甲基化,对进一步理解复杂的基因表达调控机制具有重大意义。

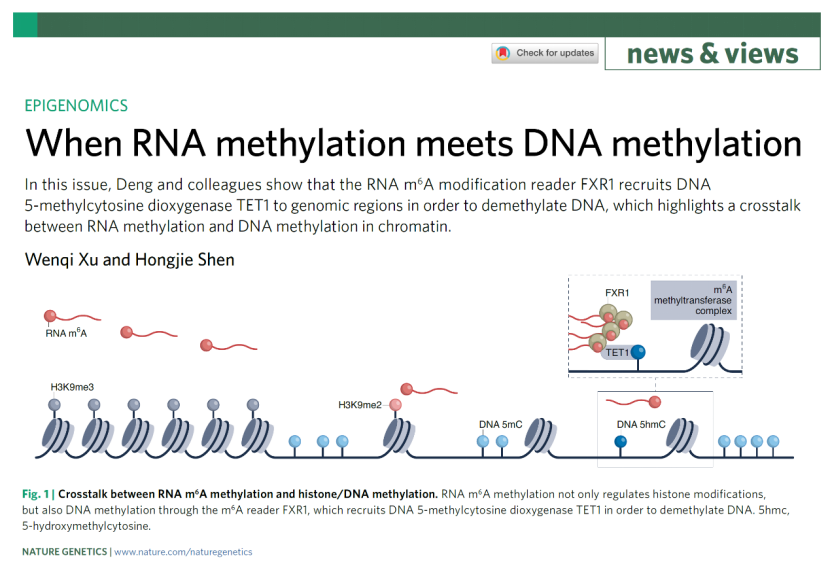
该研究首先运用体外培养的细胞,进行了一系列生物化学、分子生物学及细胞遗传学等实验,证实RNA在转录同时产生的m6A,可通过m6A识别蛋白FXR1募集去甲基转移酶TET1,使其邻近的DNA去甲基化(图1)。为了探究RNA m6A调控DNA去甲基化的生物学功能以及该调控机制异常与疾病的关系,该研究以食管癌为对象进行了深入的研究。
结果发现,敲除METTL3,TET1或FXR1基因表达,均可导致定位区域染色质可及性改变,进而影响相应区域基因的转录。他们发现,食管癌组织中RNA m6A含量显着高于癌旁正常组织,但总体DNA甲基化水平降低。由高RNA m6A导致的DNA去甲基化而高表达的基因均富集于癌症相关通路。敲除METTL3、TET1或FXR1均可抑制食管癌细胞增殖、侵袭和迁移,并且FXR1功能依赖于METTL3和TET1存在,进一步说明RNA m6A负向调控DNA甲基化在食管癌的发生发展中起重要作用。这些发现为深入研究RNA修饰在癌症中的作用提供了新思路。
Nature Genetics 同期发表了来自复旦大学生物医学研究院沈宏杰研究员的题为:When RNA methylation meets DNA methylation 的评述文章,他们认为这项研究揭示了RNA-m6A与DNA-5mC互作在调控染色质可及性和基因转录的重要作用,该机制涉及食管鳞癌的发生发展,为相关表观调控领域的深入探究提供了新的方向。
中山大学肿瘤防治中心博士研究生邓爽、特聘副研究员张嘉良、博士研究生苏佳纯以及生物信息平台左志向研究员为本文的共同第一作者。郑健研究员、林东昕院士以及陈建军教授为该研究论文的共同通讯作者。
中山大学肿瘤防治中心林东昕院士实验室自2015年成立以来,专注于肿瘤基因组学和肿瘤表观遗传学等方面的研究。团队长期招聘博士后、特聘副研究员和研究员,热诚欢迎有肿瘤学、生物化学、分子生物学和生物信息学等背景的人才加入(联系方式:zhengjian@sysucc.org.cn)。
原始出处:
Deng, S., Zhang, J., Su, J. et al. RNA m6A regulates transcription via DNA demethylation and chromatin accessibility. Nat Genet 54, 1427–1437 (2022). https://doi.org/10.1038/s41588-022-01173-1.


