梅斯盘点:10类23种不限癌种的抗肿瘤类药物
时间:2022-10-20 05:59:07 热度:37.1℃ 作者:网络
在以往的认知里,靶向药、免疫治疗药是特定癌种、特定基因突变、特定靶点、特定通路才能用的药。不少患者基因检测结果没有理想的靶点,失去用药机会,或者尝试跨适应症用药,但跨适应症无法报销或申请赠药。现在,泛癌种广谱抗癌药(也称不限癌种的抗肿瘤类药物)的研发成功和上市,给了大家新希望!打破癌种限制让更多患者有药可用!
这种不不好用癌种的治疗策略,也被称为“精准治疗”,主要源于基因检测的结果。根据基因检测的结果,一旦发现对应的靶点,就可以使用某个对应的靶向治疗药物。
靶点检测最初从乳腺癌和肺癌比较常见,目前逐步向所有的癌种扩展,包括卵巢癌,胃癌等 。例如,非小细胞肺癌患者要检测EGFR、ROS1以及ALK,乳腺癌患者要检测HER2,胃癌患者要检测HER2。但是,相比起数百种之多的癌症驱动基因,每一类癌症当中,能够被应用于治疗的基因突变还是太少了,远不能满足所有患者的需求。而且目前有靶点的药物的类别也仍然有限,实体瘤主要包括PD-1/PD-L1,EGFR,ROS1,RET,ALK,MET,BRAF V600E,NTRK,BRCA1/2,KRAS,MSI-H及dMMR,Claudin 18.2,FGFR, BCMA, GPC3, Mesothelin, TP53; 血液肿瘤包括CD19, CD7等,不少靶点的药物还在研发过程中,梅斯小编带您盘点这些药物。
但是,随着抗体生产技术,基因治疗技术等提升,靶向新药呈现加速趋势,未来不限癌种的“广谱抗癌”会越来越频繁。
目前已经(获得FDA或NMPA批准)上市的具有实体瘤适应症的“广谱抗癌药”已经有10款,分别是PD-1抑制剂派姆单抗(Keytruda)、多斯塔利单抗(dostarlimab-gxly)、斯鲁利单抗和恩沃利单抗,NTRK抑制剂拉罗替尼和恩曲替尼(Entrectinib),Dabrafenib+曲美替尼,佩米替尼片(Pemigatinib),selpercatinib (塞尔帕替尼)。正处于研发中的还有大量不限癌种药物正在上市的过程中。目前这里盘点了近20种药物,有10种正在上市前的研发过程中,但是因为希望很大,因此,也列入盘点之列。
一、PD-1/PD-L1类
PD-1作为免疫治疗药物当中的代表,PD-1抑制剂为癌症的精准治疗打开了一扇全新的门。这类药物能够调动患者自身的免疫能力来杀死癌细胞,疗效好、副作用少,同时能够与其它多类癌症治疗药物配合,取得更加出色的疗效。
而在“广谱抗癌”这方面,PD-1抑制剂其实也走在了前列。首款获批用于实体瘤适应症的药物,并非我们所以为的拉罗替尼或者恩曲替尼,而是派姆单抗。
1、派姆单抗(Keytruda):MSI-H及dMMR的实体瘤
2017年5月FDA批准派姆单抗的实体瘤适应症,用于微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)、且无其它治疗选择的实体瘤患者,成为全球首个不区分肿瘤来源的免疫药物。作为获批时的依据,派姆单抗治疗各类实体瘤患者,整体缓解率为39.6%,其中78%的患者缓解持续超过了6个月。
2020年6月,Keytruda第二项“不限癌种”的新适应症获批。用于治疗具有高组织肿瘤突变负荷(TMB-H)≥10个突变/兆碱基(使用FDA指定的检测)的无法切除或转移性实体瘤的成年和儿科患者。此次TMB作为分子标记物获批,意味着广谱抗癌范围再次扩大,将有更多的患者可以获益。
不过,由于检测技术限制等因素,Keytruda的不限癌种并没有成为主流。真正将这一类药物推上抗癌“前线”的,其实是后面这两款NTRK抑制剂。有关Keytruda资讯报道:Keytruda报道
2、多斯塔利单抗:dMMR的实体瘤
2021年8月18日,FDA加速批准了多斯塔利单抗(Dostarlimab-gxly,Jemperli)的适应症,用于治疗错配修复缺陷(dMMR)的复发或晚期实体瘤成年患者。患者应当已经接受过现有的标准方案治疗,且没有其它疗效更好的替代选择。
作为批准的依据,Ⅰ期GARNET试验验证了多斯塔利单抗治疗实体瘤、子宫内膜癌以及其它非子宫内膜癌患者的疗效。
结果显示,在dMMR的实体瘤患者中多斯塔利单抗取得了41.6%的缓解率,其中包括了超过9%的完全缓解率;除此以外,超过95.4%的患者缓解持续了半年以上,中位缓解持续时间长达34.7个月,接近3年!详细见:NEJM:PD-1免疫治疗使14例晚期直肠癌肿瘤完全消失
此前2021年4月,多斯塔利单抗已经加速获批了dMMR的复发及晚期子宫内膜癌适应症,此次批准之后更是将适应症拓展至全部类型的复发及晚期实体瘤。
3、皮下注射PD-L1恩沃利单抗
2021年12月,恩沃利单抗(恩维达)获批上市用于MSI-H/dMMR晚期结直肠癌、胃癌及其它实体瘤。这是首个且目前唯一获准上市的皮下注射PD-L1抗体药物。
临床数据显示,恩维达治疗二线及以上患者的客观缓解率(ORR)为44.7%,完全缓解12例(11.7%)。晚期CRC患者、晚期胃癌患者、其他晚期实体瘤患者和所有患者分别有89.3%、100%、100%、93.2%的缓解者仍在持续缓解中,具有明显的持久性。
4、斯鲁利单抗:MSI-H的实体瘤
2022年3月24日,中国NMPA附条件批准了由上海复宏汉霖生物研发的PD-1抑制剂斯鲁利单抗(H药,Serplulimab,HLX10),用于单药治疗经标准治疗失败后、不可切除、转移性高度微卫星不稳定型(MSI-H)实体瘤患者。
该批准基于Ⅱ期ASTRUM010试验的结果。试验共入组108例患者;其中68例患者为主要疗效分析人群,整体缓解率39.7%。
除此以外,在受试者当中,45例敏感性疗效分析结直肠癌亚组人群的客观缓解率(ORR)高达46.7%;58例敏感性疗效分析人群的12个月生存(OS)率达82.4%,疾病控制时间较长。国内专家认为,这样的疗效与国内外PD-1是完全可以相媲美的。详细:JAMA:斯鲁利单抗治疗广泛期小细胞肺癌获最长OS结果(ASTRUM-005研究)
5、由PD-1衍生出来的各类双靶点药物
两款PD-1抑制剂能做到的事情,PD-1与其它靶点的“双抗”自然也不会逊色。目前最常见的PD-1“双抗”靶点组合包括PD-1/CTLA-4、PD-1/VEGF等等,这些药物各有特点,已经在部分适应症的临床试验当中展现出了卓越的疗效。
另外,还有一些新型的免疫治疗靶点,正在研发中,一旦研发成功,可能就是天然不限瘤肿。
二、NTRK抑制剂
第一款NTRK抑制剂拉罗替尼的获批,真正将“广谱抗癌”这个概念摆在了患者们的面前。拉罗替尼的热潮不仅带“火”了广谱抗癌这个概念,更是将NTRK这个靶点的价值提到了最高。
自其成功之后,追随拉罗替尼脚步的新药越来越多,能够序贯于拉罗替尼等第一代NTRK抑制剂之后、用于治疗耐药患者的第二代NTRK抑制剂,也如雨后春笋,大量出现。第二代药物中TPX-0005、AB-106、ICP-723、SIM-1803、HG030等等,都已经取得了非常出色的疗效,或者展现出了值得期待的疗效。
1、拉罗替尼:NTRK突变的实体瘤
2018年年底,一款被誉为“神药”的新药拉罗替尼(Larotrectinib,Vitrakvi,维泰凯)的问世,FDA批准用于成人和小儿具有神经营养受体酪氨酸激酶(NTRK)基因融合的实体瘤治疗,引发全球惊呼。“首款广谱抗癌药”、“缓解率75%”等众多的光环,让拉罗替尼和它背后的靶点NTRK走上了抗癌的舞台。详细:英国NICE推荐TRK抑制剂VITRAKVI(larotrectinib),用于NTRK基因融合阳性的实体瘤
这款药物之所以让人印象深刻,最大的三个看点在于:
第一,不限癌种。只要存在NTRK融合,包括乳腺癌、结直肠癌、肺癌、甲状腺癌等17种癌症类型,同时对成人和儿童都是可以使用的。并且对于婴儿纤维肉瘤和甲状腺癌,胃肠间质瘤的有效率可以高达100%!
第二,总缓解率高达75%。根据获批时依据的3项临床试验(NCT02122913、NCR02576431和NCT02637687)结果,对于NTRK阳性的各类实体瘤患者,拉罗替尼治疗的整体缓解率为75%,其中完全缓解率22%,部分缓解率53%;且患者的缓解持续时间非常长,中位缓解持续时间达到了35.2个月,中位无进展生存期25.8个月。
第三,快速持久的响应。这款药起效非常快,并且一旦有效,带来的缓解效果明显。数据显示,平均的起效时间仅为1.84个月,73%的患者响应的持续时间超过6个月。(一个案例报道显示,2岁的梭形细胞肉瘤女孩再接受拉罗替尼治疗后24小时内就出现了快速响应,症状迅速改善。)
实际上,在多达17类癌症的治疗中,拉罗替尼的疗效都相当之出色!
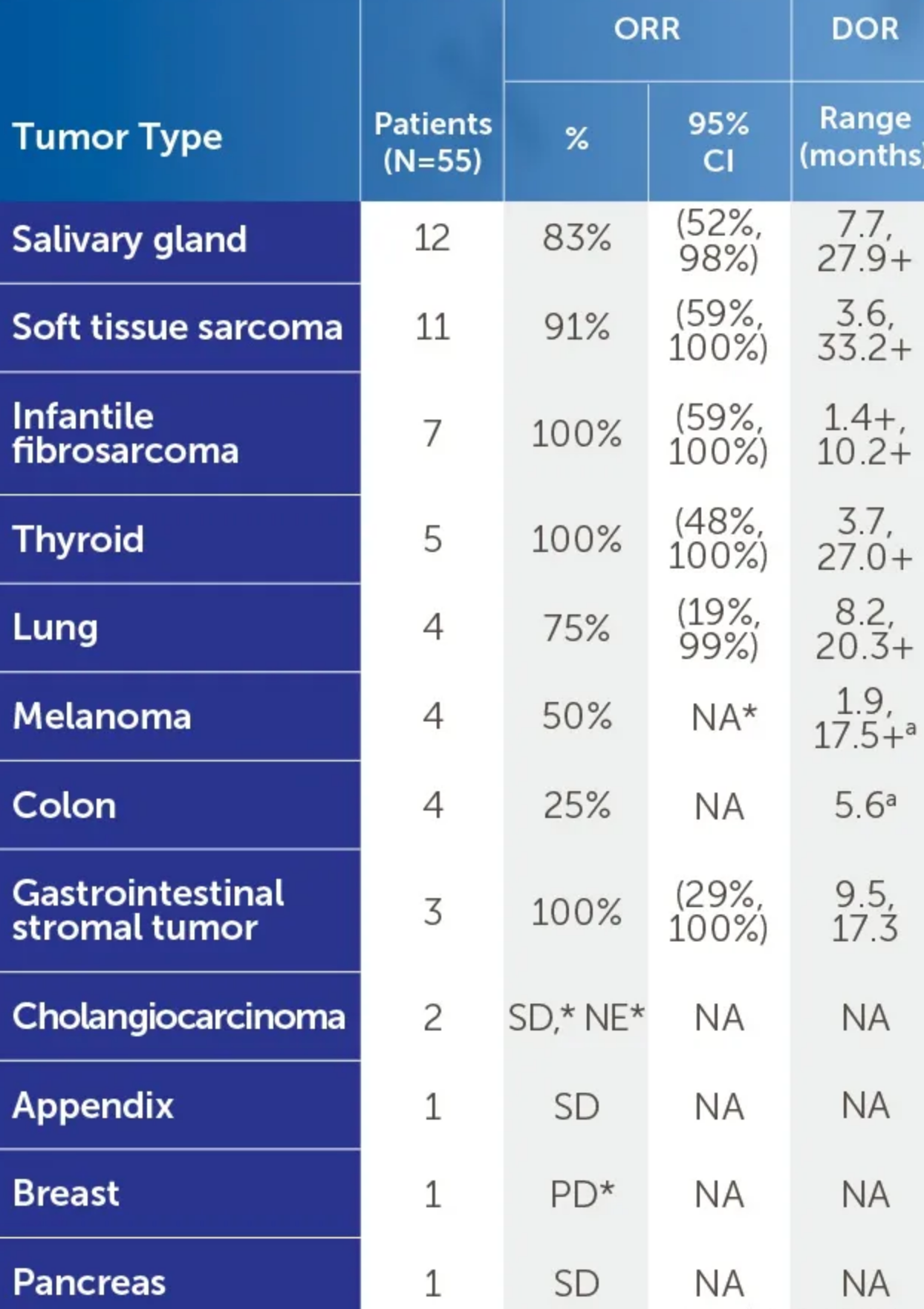
整体缓解率高、完全缓解率高、缓解持续时间长、患者从治疗中持续获益时间长,拉罗替尼完全符合患者对于一款靶向治疗药物的期待,再加上广谱抗癌的特性,也因此被称为“治愈系”的药物。目前在国内已上市。
2、恩曲替尼:NTRK突变的实体瘤
2019年8月15日,FDA加速批准了恩曲替尼(Entrectinib,罗圣全)的上市申请,用于NTRK突变的实体瘤患者,这是第三款不限癌种的药物。
在NTRK融合阳性实体瘤患者中,entrectinib(恩曲替尼,RXDX-101)的客观缓解率ORR(肿瘤缩小)为57.4%,并且在横跨10种不同类型肿瘤中均观察到了客观缓解(肿瘤缩小)。存在脑转移的患者中,entrectinib的颅内客观缓解率ORR为54.5%,其中超过1/4实现完全缓解(病灶全部消失)。研究人员报告中位缓解持续时间为 20 个月(95% CI,13-38.2),中位 无进展生存期(PFS )为 13.8 个月(95% CI,10.1-19.9)。
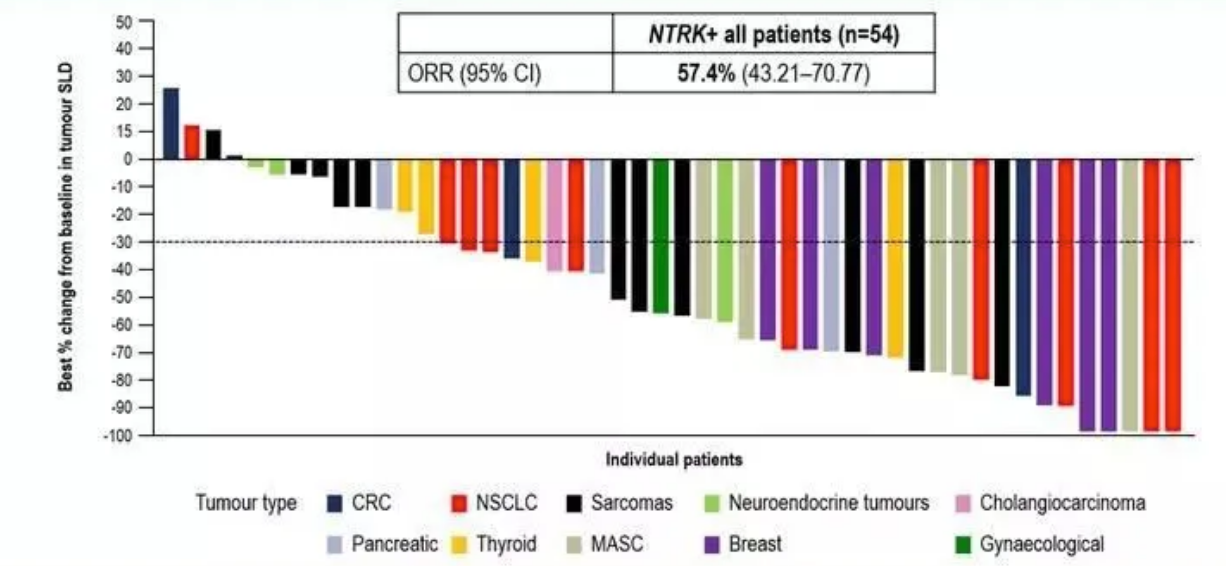
恩曲替尼的亚洲背景更深厚,曾经公开过专门针对亚洲患者的疗效分析结果。在NTRK阳性的患者中,基线存在脑转移的患者整体缓解率75.0%,其中颅内病灶缓解率100%,基线未发生脑转移的患者整体缓解率66.7%;取得了临床缓解的患者中位缓解持续10.4个月,所有患者中位无进展生存期14.9个月。
同为NTRK抑制剂,恩曲替尼的上市迟了半年有余,那么自然需要拿出一些与拉罗替尼不同的优势来。事实上,恩曲替尼是一款多靶点的药物,治疗ROS1突变的癌症,效果同样非常出色。除此以外,入脑活性也是恩曲替尼值得重视的优势之一。2022年7月,在中国也获批上市。详细:黄金靶点NTRK第二代抑制剂VC004初步疗效喜人,国内多家有类似管线
3、Selitrectinib
它是第二代NRTK类抑制剂。在2019年美国癌症研究协会(AACR)年会上,报告了Selitrectinib最新临床试验结果。截至2018年12月03日,共有31名(7例儿童,24例成人)肿瘤患者,包括肉瘤、胃肠道间质瘤、胰腺癌、乳腺癌等11种类型的肿瘤患者,接受了Selitrectinib进行治疗。Selitrectinib治疗具有TRK激酶域突变患者的ORR为45%,治疗期间出现的不良事件(TEAE)为头晕、食欲不振、恶心、呕吐、贫血、肌痛、腹痛、疲劳和淋巴细胞减少症。详细见:第二代广谱抗癌TRK抑制剂,或可解决恩曲替尼或拉罗替尼耐药的问题
4、ICP-723
ICP-723是由我国诺城健华自主研发的新一代NTRK抑制剂,可以治疗携带NTRK融合基因的晚期或转移性实体瘤,包括乳腺癌、结直肠癌、肺癌、甲状腺癌等,以及对第一代NTRK抑制剂拉罗替尼和恩曲替尼耐药的患者。
截至 2022 年 2 月 11 日,在 I 期剂量递增试验中,共有 17 例患者接受了 ICP-723 的治疗,剂量为 1~8 mg,每天一次。安全性良好,没有观察到 剂量限制毒性(DLT)。17例患者中,5例患者确认为NTRK基因融合阳性,客观缓解率(ORR)为80%,其中部分缓解4例,疾病控制率(DCR)为100%。在4毫克及以上剂量组中,客观缓解率为100%。
三、RET抑制剂
RET蛋白是一种膜受体酪氨酸激酶,RET基因的突变和融合可以导致RET信号通路过度激活,从而导致肿瘤的发生和发展。RET基因发生突变会引发多种肿瘤,包括NSCLC、乳头状TC、结直肠癌、卵巢癌、胰腺癌、胸膜间皮瘤、胃癌、胆管癌等。
1、selpercatinib (LOXO-292,塞尔帕替尼)
2020年5月8日,FDA批准selpercatinib(Retevmo),也就是大名鼎鼎的LOXO-292优先审批,适应症为晚期RET融合阳性非小细胞肺癌、RET突变型甲状腺髓样癌(MTC)和RET融合阳性甲状腺癌的患者。详细:Lancet Oncol:Selpercatinib在RET融合阳性实体肿瘤中的疗效可期
Retevmo也是首个被批准专门用于治疗携带RET基因变异的癌症患者的精准疗法。最新的结果显示,selpercatinib也是名副其实的广谱抗癌药,对于多种实体肿瘤显示出了惊艳的临床疗效。详细:FDA 批准 Selpercatinib 用于不限癌种治疗携带RET基因融合的局部晚期或转移性实体瘤患者
2021年11月,Selpercatinib在中国递交上市申请获受理,并被纳入优先审评。
2、普拉替尼
2018年6月,基石药业与Blueprint Medicines公司达成了独家合作和许可协议,获得了普拉替尼在大中华地区的独家开发和商业化权利。
2021年3月,普拉替尼在国内首次获批,用于治疗既往接受过含铂化疗的转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者,成为国内首个批准上市的高选择性RET抑制剂。同时,普拉替尼也成为了我国首款使用乐城真实世界数据辅助审评审批的药物。
2022年3月,普拉替尼扩展新的适应症,用于需要系统性治疗的晚期或转移性RET突变型甲状腺髓样癌(MTC)成人和12岁及以上儿童患者的治疗,以及需要系统性治疗且放射性碘难治(如果放射性碘适用)的晚期或转移性RET融合阳性甲状腺癌成人和12岁及以上儿童患者的治疗。成为了我国首个且唯一获批用于RET突变甲状腺髓样癌及RET融合阳性甲状腺癌的选择性RET抑制剂。
2021 ASCO年会上披露的试验结果显示,在RET融合阳性NSCLC患者中,普拉替尼具有持久的临床获益。在68例未经系统性治疗的患者中,总体缓解率(ORR)为79%。
四、HRD类药物(BRCA1/2基因、同源重组修复、以及PARP抑制剂)
关于BRCA1/2基因、同源重组修复(HRR;“同源重组”是HR,后一个R是repair,即“修复”)相关基因、同源重组修复缺陷(HRD)以及PARP抑制剂,可以归为这一类。
HRD这种状态,能够存在于非常多类型的癌症当中。乳腺癌、卵巢癌、前列腺癌、胰腺癌最常见,其它癌症当中也有一定的比例,总得来说,当PARP抑制剂的适应症从BRCA突变拓展至HRD,再拓展至HRR相关基因突变的时候,它们可能触及的适应症已经几乎遍及了所有实体瘤。
1、多斯塔利单抗
2021年8月,dostarlimab-gxly (Jemperli,多斯塔利单抗)上市,错配修复缺陷复发 (dMMR) 复发或晚期实体瘤成人患者既往治疗并且没有令人满意的替代选择的患者;
结果显示,在dMMR的实体瘤患者中多斯塔利单抗取得了41.6%的出色缓解率,其中包括了超过9%的完全缓解率;除此以外,超过95.4%的患者缓解持续了半年以上,中位缓解持续时间长达34.7个月,接近3年!详细见:NEJM:PD-1免疫治疗使14例晚期直肠癌肿瘤完全消失
五、FGFR:肝胆消化道肿瘤
FGF/FGFR信号传导通路几乎存在于所有器官的发育、血管的生成以及淋巴管的生成当中,是人体最重要的通路之一。FGF家族“成员”数量高达22种以上,通过四个重要基因(FGFR1、FGFR2、FGFR3和FGFR4)激活。
FGFR是胆管癌最常见的突变类型之一,在肝癌的靶向治疗当中也具有至关重要的意义,对于胰腺癌等也有一定的潜力,可以说是一个肝胆消化道肿瘤的“小广谱”靶点。
一些研究中指出,FGFR 1~3突变在胆管癌中约占11%~45%,因而成为了现在靶向药物治疗肝内胆管癌最重要的研究方向之一。FGFR4在肝癌等中也比较特异。两款重磅药物疗效的公开,为这一靶点的治疗思路提供了证明。
1、Bemarituzumab:无进展生存9.5个月
Bemarituzumab 是一种针对FGFR2b(一种 FGF 受体) 的首创的人源化 IgG1 单克隆抗体。2021年4月20日,FDA授予安进公司研发的Bemarituzumab突破性疗法称号,用于联合改良的FOLFOX6方案(mFOLFOX6),一线治疗FGFR2b阳性、HER2阴性的局部晚期或转移性胃及胃食管交界处癌患者。5%~10%的胃癌患者存在FGFR2b高表达或FGFR2基因扩增,而在HER2-患者中,这一比例更是高达30%。
根据2021年胃肠道肿瘤专题研讨会上公开的FIGHT研究结果,在意向性治疗(ITT)的患者共155例中,Bemarituzumab+mFOLFOX6治疗的患者中位无进展生存期9.5个月,1年无进展生存率52.5%;而使用安慰剂+mFOLFOX6治疗的患者,中位无进展生存期7.4个月,1年无进展生存率33.8%。详细:Lancet Oncol:Bemarituzumab联合mFOLFOX6治疗晚期胃或胃-食管交界处腺癌的疗效可期
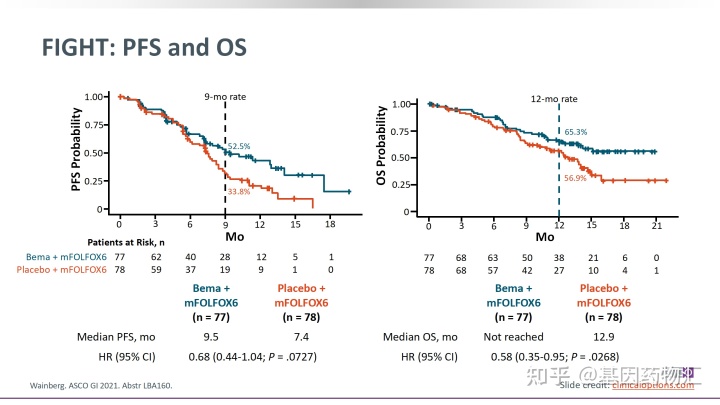
(1)亚组分析:表达水平更高,生存期更长
亚组分析同样支持这一结果。在FGFR2b表达水平更高,即免疫组化(IHC)2+/3+占样本的10%以上的亚组中,Bemarituzumab+mFOLFOX6治疗的患者中位无进展生存期为14.1个月,1年无进展生存率57.0%,显著超过了安慰剂+mFOLFOX6治疗患者的7.3个月和26.4%。联合治疗组患者的中位总生存期尚未达到,而安慰剂组患者的中位总生存期为11.1个月。
在FGFR2b表达水平较高,即免疫组化(IHC)2+/3+占样本的5%以上的亚组中,Bemarituzumab+mFOLFOX6治疗的患者中位无进展生存期为10.2个月,1年无进展生存率56.3%,显著超过了安慰剂+mFOLFOX6治疗患者的7.3个月和28.6%。
(2)缓解率:高至47%,持续12.2个月
在响应率及持续时间方面,Bemarituzumab+mFOLFOX6治疗的整体缓解率为47%,中位缓解持续12.2个月,显著超过了安慰剂+mFOLFOX6治疗的33%和7.1个月。
(3)中位总生存期(OS)分别为19.2个月 vs 13.5个月(HR:0.60,95% CI:0.38-0.94)
FDA在公告中称,超过10%的局部晚期或转移性胃及胃食管交界处癌患者存在FGFR2b的过表达,Bemarituzumab方案将为这部分患者提供全新的解决方案。
2、佩米替尼(Pemigatinib):缓解率36%
2020年4月17日,首款针对胆管癌的靶向药物获得了FDA的加速批准,正式走上临床。Pemigatinib(Pemazyre)是一款FGFR2靶点的靶向药物,获批用于治疗经治的FGFR2突变胆管癌患者。这是首款获批用于治疗胆管癌的靶向药物,为晚期胆管癌的治疗带来了零的突破。2022年4月,信达生物宣布其引进的佩米替尼片(Pemigatinib,商品名:达伯坦)在中国获批上市,用于既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者的治疗。
在FIGHT-202实验中共纳入107例不可手术切除或转移性的FGFR2阳性胆管癌患者,所有患者至少接受过1种前线治疗方案并发生了进展。结果显示,患者的整体缓解率为36%,其中3例患者达到了临床完全缓解;患者中位缓解持续时间9.1个月,在达到了临床缓解的患者中,7例患者的缓解持续了超过12个月。
3、Infigratinib:缓解率23.1%,无进展生存7.3个月
2021年5月29日,FDA宣布批准Infigratinib(Truseltiq)上市,用于治疗曾经接受过治疗的FGFR2融合及重排突变的局部晚期或转移性胆管癌患者。
研究结果显示,接受Infigratinib治疗的患者,整体缓解率为23.1%,中位无进展生存期7.3个月;发生响应的患者中,缓解持续超过6个月的患者占32.0%,中位缓解持续时间5.0个月。
亚组分析结果显示,曾接受过二线治疗的患者整体缓解率为34%,三线治疗及以上的患者整体缓解率为13.8%;最多的患者曾接受过8种前线治疗方式。详细:Pemigatinib治疗FGFR2融合或重排的晚期胆管癌,CHMP持积极评价
4、Futibatinib:缓解率37.3%,无进展生存7.2个月
4月1日,FDA授予FGFR抑制剂Futibatinib(TAS-120)突破性疗法称号,用于治疗经治的FGFR2基因重排及融合突变的局部晚期或转移性胆管癌患者。
根据2020年的ESMO大会上公开的研究结果,在最少6个月的随访期内,所有接受Futibatinib治疗的患者的整体客观缓解率达到37.3%,其中完全缓解率1.5%,部分缓解率35.8%。
整体来说,所有患者的疾病控制率达到了82.1%,中位缓解持续时间为8.3个月;所有达到临床缓解的患者,从开始接受治疗到能够被判定为临床缓解的时间中位数为2.5个月。所有患者的中位无进展生存期为7.2个月;6个月无进展生存率为61%,6个月总生存率为86%。
5、BLU-554:对肝癌有较好疗效,胆管癌试验正在进行
BLU-554是一款FGFR4抑制剂,目前其在肝癌适应症的临床试验中已经取得了一定的疗效。
根据国际肝癌大会上曾经公开的研究数据,BLU-554治疗FGF 19(FGFR4的配体)高表达的晚期肝癌患者,整体缓解率16%,疾病控制率68%。
截至目前,全球有三种获批准泛FGFR抑制剂:分别是Incyte公司的Pemazyre(即Pemigatinib,佩米替尼)、强生的Balversa(厄达替尼)及QED Therapeutics的Infigratinib(英菲格拉替尼)。除上述三种药品外,还有15种泛FGFR抑制剂处于不同临床开发阶段的候选药物。国内有ABSK091,Gunagratinib,Fisogatinib,Roblitinib
六、HER2
HER2与EGFR(又叫HER1)同属于HER这个家族。因HER2异常而导致的癌症可以说是“从头到脚”,在肺癌中检出率约2.5%,乳腺癌中检出率约15%~25%,胃癌约20%,胆管癌约20%,卵巢癌约27%,子宫内膜癌中检出率可以达到18%~80%。
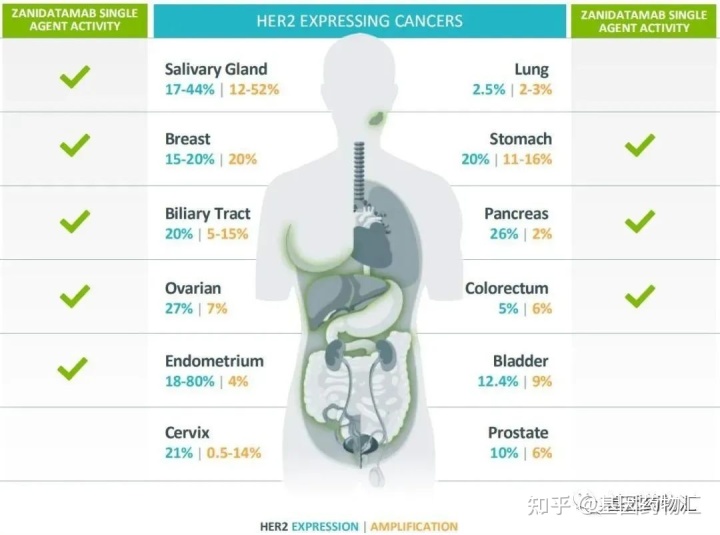
这一类型的突变导致的癌症如此广泛,自然也在广谱抗癌这个领域受到了重点关注。
1、Zanidatamab(泽尼达妥单抗 ):冲击实体瘤适应症
目前,首款冲击实体瘤适应症的HER2抑制剂是HER2双特异性抗体Zanidatamab。Zanidatamab的开发基于Zymeworks的Azymetric平台,可以同时结合HER2的两个非重叠表位,这被称为双特异性结合。这种创新设计产生了多种新的作用机制,包括双重HER2信号阻断、增强结合和从细胞表面清除HER2蛋白以及强效效应功能,从而在患者中产生令人鼓舞的抗肿瘤活性。,已经于2020年12月在胆管癌的适应症上获得了FDA的突破性疗法指定。
2021年ESMO大会上,研究者公布了Zanidatamab一线治疗 HER2 阳性胃食管腺癌的数据。在36例患者中,Zanidatamab联合CAPOX(卡培他滨/奥沙利铂)或FP(5FU/顺铂)或mFOLFOX6(5FU/亚叶酸/奥沙利铂)等化疗方案治疗,患者的整体缓解率为75%,疾病控制率为89%;中位缓解持续时间为16.4个月,中位无进展生存期为12个月。
其中,Zanidatamab联合CAPOX或FP方案的疾病控制率最高,为100%。详细:治疗胃食管腺癌达到90.9%疾病控制率,Zymeworks HER2靶向双特异性抗体显“奇效”
这只是一个癌种的数据,我们非常期待这款被称为“具有广谱抗癌潜力”的新药,能够在更多适应当中展现实力。
七、KRAS类
KRAS 是人类癌症中最常发生突变的癌基因,突变发生在大约 25% 的 NSCLC 中。KRASG12C突变发生在大约 14% 的腺癌和 0.5-4% 的鳞状 NSCLC 中。这种突变也发生在 3-4% 的结直肠癌和 1-2% 的胆道癌和胰腺癌中。KRAS突变涉及的癌症种类非常多。常见的癌种,包括非小细胞肺癌、结直肠癌、胰腺癌等,以及相对罕见的子宫内膜癌、睾丸生殖细胞癌等,都可能因KRAS突变导致。
RAS基因家族目前已知的成员包括KRAS,NRAS和HRAS,其中KRAS突变最为常见,大约占85%。在所有KRAS突变中,KRAS p.G12C单核苷酸变异(密码子12处的甘氨酸被半胱氨酸取代)是NSCLC中最常见的变异,肺腺癌的这一突变携带率约为13% 。
从研究者的角度来说,靶向KRAS的药物研发非常困难,既往研究的药物疗效并不理想,甚至于KRAS一度被视为“不可成药”的靶点;从患者的角度来说,发生了这类突变的患者治疗非常困难,对于许多常用治疗方案不敏感,患者生存期难以保障。
但随着靶向治疗研究的发展,这一难题逐渐被攻克,至今已经有一款KRAS抑制剂Sotorasib获批上市,另一款同类药物Adagrasib也提交了申请,迈出了上市前的最后一步。
1、Sotorasib: ORR为37.1%
Sotorasib作为首个进入临床试验的靶向KRAS p.G12C口服抑制剂,自2019年9月在ASCO上首次惊艳亮相后,研究进展势如破竹,于2021年5月获得FDA批准上市,治疗既往至少接受过一次系统治疗的KRAS p.G12C突变局部晚期或转移性NSCLC患者。
对曾接受过三种以上的治疗方案KRAS p.G12C突变NSCLC患者,sotorasib治疗的ORR为37.1%,中位PFS为6.8个月,中位OS数据——12.5个月。详细见:NEJM:Sotorasib治疗KRASp.G12C突变晚期非小细胞肺癌II期临床数据喜人
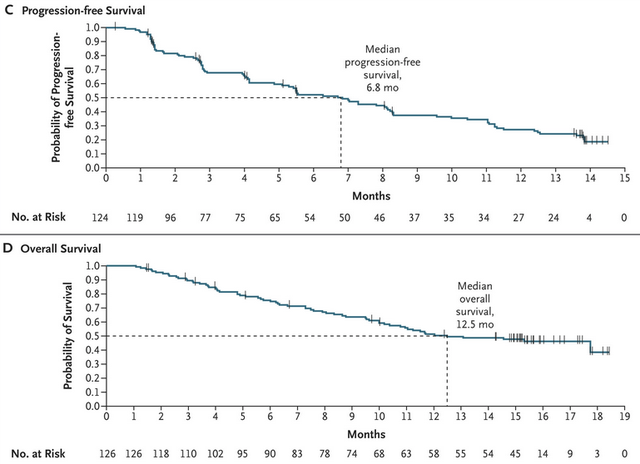
PFS和OS的Kaplan-Meier曲线
令人振奋的是,sotorasib不仅见效迅速,而且疗效持久!
在治疗的第六周,患者接受第一次疗效评估时,就有33例(71.7%)患者达到缓解。46例客观缓解的患者,从治疗开始到缓解经历的中位时间仅有1.4个月,说明sotorasib起效迅速,而中位缓解持续时间(DoR)达到11.1个月,9个月时仍有57.3%的患者处在缓解状态。
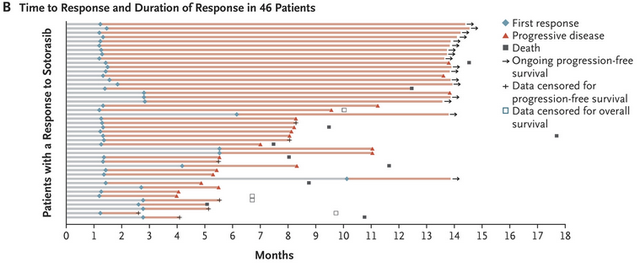
46例客观缓解的患者治疗后达到缓解的时间,以及缓解持续的时间
目前3期研究结果也部分公布,详细:ESC 2022:靶向KRAS G12C Sotorasib治疗NSCLC首个III期结果公布,ORR为28.1%
2、Adagrasib(阿达格拉西):中位 DoR 为 8.5 个月
sotorasib 的药物半衰期为 5 小时,而阿达格拉西为 23 小时,阿达格拉西的剂量依赖性延长暴露,以及阿达格拉西潜在的中枢神经系统 (CNS) 渗透。Adgrasib 继续在 NSCLC 和其他晚期实体癌中作为单一疗法和与其他疗法联合进行评估。
截至 2021 年 10 月 15 日,共有 116 名KRASG12C突变的晚期 NSCLC 患者接受了治疗,中位随访时间为 12.9 个月。在这些患者中,98.3% 的患者既往接受过化疗和免疫检查点抑制剂治疗。在基线时有可测量疾病的 112 名患者中,48 名患者 (42.9%) 有确认的客观反应。
中位 DoR 为 8.5 个月(95% 置信区间 [CI] 6.2 至 13.8),中位 PFS 为 6.5 个月(95% CI 4.7 至 8.4)。截至 2022 年 1 月 15 日,中位随访时间为 15.6 个月,中位 OS 为 12.6 个月(95% CI 9.2 至 19.2)。在 33 名先前接受过治疗的稳定 CNS 转移患者中,颅内确认的客观缓解率为 33.3%(95% CI 18.0 至 51.8)。详细:NEJM丨肺癌,KRAS新药adagrasib再显锋芒,ORR高达42.9%
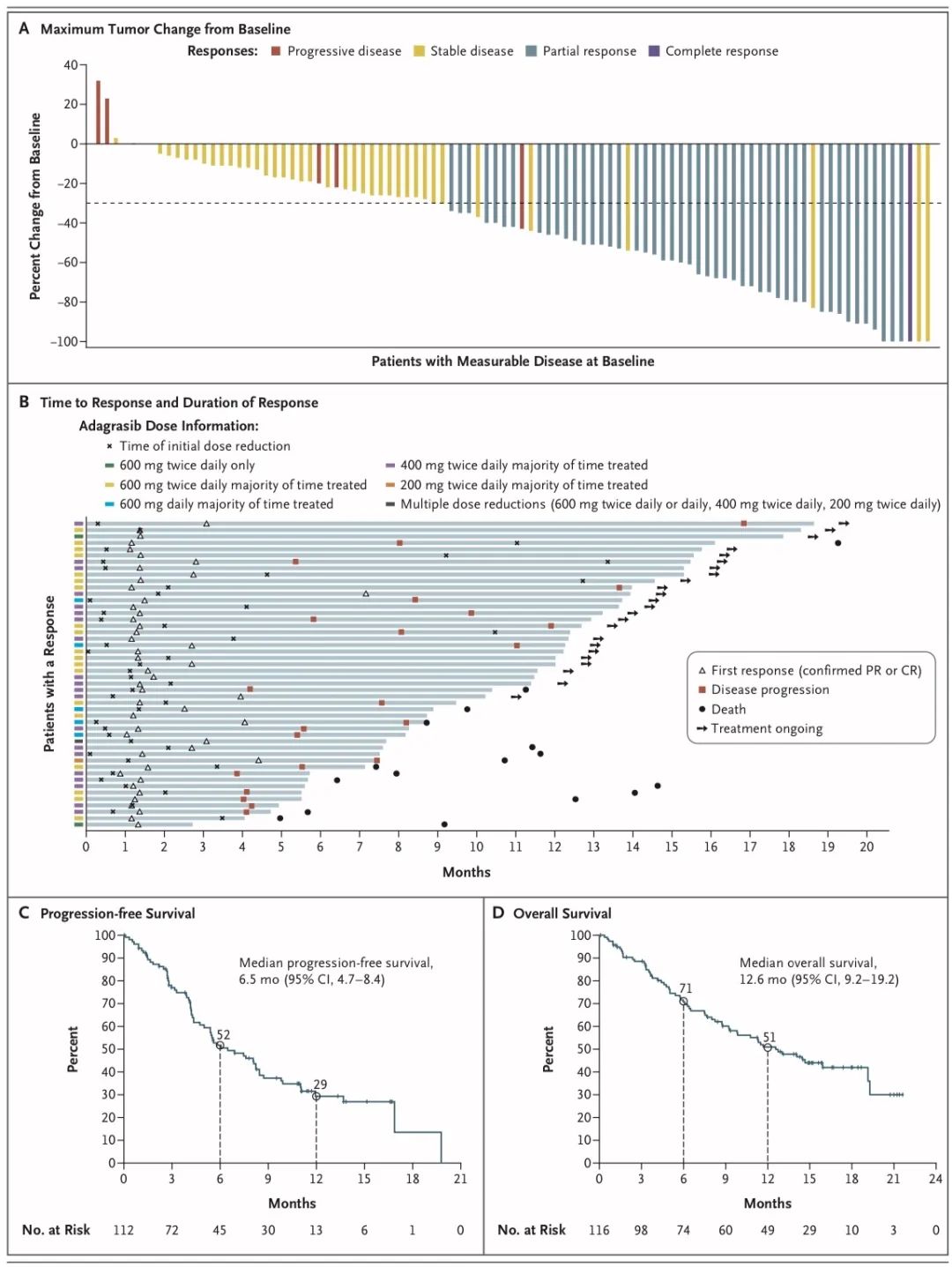
3、JDQ443:疾病控制率82.1%
研究者公布了截至2021年1月5日,JDQ443治疗多种KRAS G12C阳性实体瘤患者的数据。受试39例患者分为4个剂量组,分别包括200 mg每天一次、400 mg每天一次、200 mg每天两次和300 mg每天两次。
在所有剂量水平上,已经得到确认和未确认的整体缓解率为28.2%。至该结果公布时,其中2例患者的病情未完成评估。在目前的受试患者中,已经确认的整体缓解率为20.5%,疾病控制率82.1%。
根据这一阶段的结果,研究人员将推荐的剂量定为200 mg,每天两次。
4、D-1553
是由益方生物自主开发的一款新型、高效且口服的KRAS G12C抑制剂。在2022年美国肿瘤研究协会(AACR)年会上,益方生物首次公布了其口服KRAS G12C抑制剂D-1553在癌症患者中的临床I期数据,这使得D-1553成为了首个公布临床数据的国产KRAS抑制剂。
在一项针对携带KRAS G12C突变的晚期或转移性实体瘤患者的国际多中心一期研究中 ,D-1553在22例患者中耐受性良好,没有任何剂量限制性毒性。在21例可评估的患者中,观察到19.0%确认的肿瘤客观缓解率,达到了85.7%的疾病控制率。在剂量水平低至每天300mg时已观察到肿瘤缓解。
在另一项由上海胸科医院陆舜教授为主要研究者,针对携带KRAS G12C突变的非小细胞肺癌(NSCLC)患者的研究分析中包括了59例患者,其中52例为可评估患者,肿瘤客观缓解率达到40.4%,疾病控制率高达90.4%。这些患者均为晚期或转移性癌症患者,大多数已经接受了二线或二线以上的系统性抗癌药物治疗。
数据显示,在PR2D(600mg/BID,BID为一日两次)剂量下,D-1553在32例患者中评估的客观缓解率达到40.6%,疾病控制率为84.4%。安全性方面,D-1553耐受性良好,未达到剂量限制性毒性。
5、JAB-21822
是加科思自主研发的KRAS G12C抑制剂。临床前研究数据表明,其可单独使用,治疗含KRAS G12C突变的实体瘤,同时在KRAS G12C抑制剂治疗发生耐药后,联合SHP2抑制剂有望有效克服和逆转KRAS抑制剂的耐药问题。
截至2022年4月1日共入组72例晚期实体瘤患者。其中有疗效评估的KRAS G12C突变的非小细胞肺癌患者共32例,客观缓解率(ORR)为56.3%(18/32),疾病控制率(DCR)为90.6%(29/32)。在400mg/d及800mg/d的剂量组中,客观缓解率为66.7%(8/12),疾病控制率为100%(12/12)。此外,JAB-21822在剂量递增阶段无剂量限制性毒性(DLT),400mg/d及800mg/d剂量组中三级或四级治疗相关不良反应为2.5%(1/40)
八、BRAF V600E突变
BRAF基因在所有人体肿瘤中突变率大约为8%,但是不同肿瘤之间的差别也很大。多见于毛细胞白血病(100%)、黑色素瘤(50%)、甲状腺乳头状癌(45%)、结直肠癌(约10%)和非小细胞肺癌(约10%)等瘤种。目前发现的BRAF突变超过40种,其中80%以上的突变形式为V600E突变。
1、达拉非尼(dabrafenib)联合曲美替尼
2022年6月, dabrafenib联合曲美替尼用于治疗 6岁及以上患有不可切除或转移性实体瘤、携带 BRAF V600E突变且在先前治疗后进展且没有令人满意的替代治疗选择的成人和儿童患者。能覆盖20类成人及儿童肿瘤。
这是全球首款且目前唯一一个获批用于BRAF V600E突变成人及儿童泛瘤种治疗药物组合,同时,这也是BRAF/MEK抑制剂首次获批用于儿童患者的治疗。
该批准是基于II期ROAR(罕见肿瘤学不可知研究)篮子研究、NCI-MATCH子方案研究和X2101研究的结果。在三项临床试验中证明的临床疗效和安全性。在II期ROAR(罕见肿瘤学不可知研究)篮子研究和NCI-MATCH子方案研究中,达拉非尼+曲美替尼使BRAF V600E实体瘤患者的总体反应率高达80%,包括高级别和低级别胶质瘤、胆道癌和某些妇科和胃肠道癌症。另一项研究(研究X2101)证明了达拉非尼+曲美替尼联合使用在儿科患者中的临床益处和可接受的安全性。
试验结果表明,3组患者(A组VS B组VS C组)的客观反应率(ORR)为27%VS 63%VS 61%,完全缓解率(CR)为1%VS 4%VS 3%,部分缓解率(PR)为26%VS 60%VS 58%,持续反应时间(DOR)为21个月VS 36个月VS 22个月,DOR≥6个月的患者比例为52%VS 64%VS 59%。详细:“双靶组合”新适应症在我国获批,「达拉非尼」联合「曲美替尼」为BRAF V600突变型非小细胞肺癌患者带来新选择
九、TP53 Y220C突变
TP53是一种肿瘤抑制基因,当该基因发生突变时,会导致p53失活,从而导致肿瘤的发生。突变的p53具有致癌特性,赋予癌细胞生长优势和对抗癌治疗的抵抗。据估计,超过50%的癌症都带有p53蛋白突变,包括乳腺癌、肺癌、前列腺癌、结直肠癌和子宫癌。然而p53也是最难于靶向的靶点之一,目前全球尚未批准一款靶向p53的有效疗法。
 图注:TP53作用机制示意图
图注:TP53作用机制示意图
TP53突变是所有人类癌症中最常见的基因组事件,大约30%包含热点突变。TP53 Y220C是一个关键热点TP53错义突变,它使p53不稳定,在大约1%的实体瘤中发现。
1、PC14586
2022年7月29日,《OncLive》医学在线期刊公布了PC14586在TP53 Y220C突变局部晚期或转移性实体瘤患者中的抗肿瘤活性和安全性。
PC14586是一款first-in-class小分子p53重激活剂,旨在选择性地结合TP53 Y220C突变蛋白中存在的缝隙,并恢复p53野生型(正常)构象和转录活性,从而产生有效的临床前抗肿瘤活性。美国食品和药物管理局(FDA)已授予PC14586快速通道资格,用于治疗具有TP53 Y220C突变的局部晚期或转移性实体瘤患者。
PYNNACLE是一项开放标签、多中心I/II期临床试验,主要为了评估PC14586在携带TP53 Y220C突变的晚期实体瘤患者中的安全性、耐受性、药代动力学、药效学和疗效。
入组患者的人群特征包括:中位年龄为62岁,大多数患者为女性(n=25;61%)和白种人(n=31;76%)。大多数患者ECOG评分为1(n=23;56%);既往治疗的中位线数为3(n=23;57.5%);93%的患者生殖细胞TP53 Y220C突变呈阴性。
在这些研究中,主要的癌症类型是卵巢(n=11;26.8%),其次是胰腺(n=8;19.5%),乳腺(n=6;14.6%),前列腺(n=5;12.2%),结肠(n=5;12.2%),子宫内膜(n=2;4.9%)、头颈部(n=2;4.9%),小细胞肺(n=1;2.4%)、生殖细胞(n=1;2.4%)。
在可评估疗效的患者中(n=33/41),根据RECIST v1.1标准,研究者评估的客观缓解率(ORR)为24.2%(n=8),包括6例部分缓解(PR)和2例未经证实的PR。15例患者疾病稳定(SD),7例患者疾病进展(PD)。
其他结果显示,当按剂量水平细分时,在每天接受150mg至600mg的可评估患者中未观察到反应(n = 8/10);4例患者SD和4例PD。
在接受1150mg至1500mg(每日两次,BID)(n=25/31)剂量范围内的反应可评估患者中,ORR为32.0%(n=8),包括6例PR和2例未确认的PR;还报告了11例SD和3例PD。
关于治疗时间,13例患者在数据截止时仍在治疗,8例应答者中有6例患者在继续治疗。
十、Claudin 18.2:消化道肿瘤
Claudin 18.2属于紧密连接蛋白家族中的一种亚型,在多种肿瘤组织中高度表达,比如胃癌(60%~80%)、胰腺癌(50%)、食管癌(30%~50%)和肺癌(40%~60%)等,但是在正常组织中几乎没有表达,因而具有出色的治疗潜力。
与老牌靶点HER2相比,Claudin 18.2最大的特点在于,具有这一靶点的患者数量约占全部胃癌患者的50%~60%。这意味着,过半数的患者能够跨过“突变类型”这个门槛,有机会使用这一靶点的药物。
针对Claudin 18.2靶点的研究方向主要分为靶向药物与CAR-T细胞免疫疗法两类。详细见:半年内国产6款Claudin18.2创新药物获批临床,全球在研进入热潮、靶向claudins的癌症治疗、Nat Med:科济生物Claudin18.2 CAR-T细胞治疗实体瘤初获突破
小结:
上述10个靶点是目前实体瘤最引人关注的跨适应症靶点(血液肿瘤除外),不过,仍然有很多新的靶点也在研发之中,分别取得了不同的研究进展。广谱抗癌药最大的价值在于,它们让许多癌症患者不必再苦苦等待药物获批上市,仅一次批准,就能有众多癌种的患者获益。尤其是针对一些“小瘤肿”,因为很少有企业专门针对小瘤肿开发特定的治疗药物。
基因分型和靶向治疗信号通路的确证,为“异病同治”靶向治疗提供了新的思路。泛癌种新药的横空出世,让更多幸运的患者等来了新的希望和治疗选择。
而且,通过靶点的靶向治疗,也是未来肿瘤治疗的重要趋势。随着靶向药物越来越多,一个病人可能拥有多个有效治疗靶点,因此,未来多靶点药物联合治疗同样值得期待。
参考资料:
肿瘤类型无关治疗(tumor agnostic treatment),https://www.medsci.cn/article/show_article.do?id=5bfce38394fb
盘点2017-2021年美国FDA批准的抗肿瘤新药,https://www.medsci.cn/article/show_article.do?id=38cde25295d6
https://zhuanlan.zhihu.com/p/534241874


